影响猪肌间脂肪沉积的主要因素及潜在调控机理
2021-04-13杨茜梓胡睿智贺建华伍树松
杨茜梓 胡睿智 贺建华 伍树松,2*
(1.湖南农业大学动物科学技术学院,长沙410128;2.湖南省畜禽安全生产协同创新中心,长沙410128)
猪肉是我国居民日常膳食的主要肉类来源。2017年,我国人均猪肉消费量是世界其他国家平均水平的4.6倍,猪肉产量约占全球产量的48.19%[1]。为提高畜产品的产量,我国早期研究主要追求畜禽的生长速度、饲料转化率和瘦肉率。长期的品种选育形成了目前以增长快、瘦肉率高为特征的畜禽品种。随着经济社会的发展和人民生活水平的提高,消费者在对猪肉及肉制品的需求量提高的同时,对肉品质的要求也越来越高。现如今瘦肉型猪品种的繁育已经很成熟,但瘦肉率的提高,伴随着的是肌间脂肪的降低。而中国许多优秀的地方品种由于具有更高的肌间脂肪含量,也有着更好的肉质。肌间脂肪在某些方面是比较特殊的脂肪组织,其含量的多少表现为肌肉间大理石花纹的评分,并且与猪肉的风味、嫩度和多汁性等性状密切相关,是决定猪肉品质的重要指标之一[2]。因此,控制肌间脂肪沉积量对于提高肉品质有重要作用。肌肉的脂肪沉积受多种因素影响,如遗传、营养、环境、外源激素等,外源激素一般指人工合成的或人工提取的与机体分泌的激素发挥相同作用的化学物质[3]。但目前关于靶向调控肌间脂肪沉积的研究较少,而肌间、肌内和皮下等不同的脂肪组织具有相似的代谢特征和沉积机理[4],因此探究各因素对肌间脂肪沉积的调控作用及相关机理尤为关键。本文结合国内外研究现状对肌间脂肪沉积规律和营养调控手段进行综述,以期为提高猪肉品质提供理论依据。
1 肌间脂肪概述
肌肉中的脂肪组织分为肌内脂肪和肌间脂肪[5],二者的功能与特点相似但又存在区别,但对于改善肉品质均有重要作用。肌内脂肪存在于肌内膜、肌外膜和肌束膜上[6]。肌间脂肪存在于肌纤维之间[7],主要在猪体重达到20 kg前发育[8]。虽然肌间脂肪和皮下脂肪的生长速率和组成相近[9],但有研究表明腹部肌间脂肪的沉积速率比皮下和肾周脂肪快[10-11],与皮下脂肪以及肾周脂肪相比,肌间脂肪的脂质含量最低,且不饱和程度高于肾周脂肪,低于皮下脂肪[10]。
研究表明肌间脂肪占总脂肪的20%~35%[8,11],肌间脂肪与总脂肪含量呈正相关关系[12]。肌间脂肪的含量直接影响肉的风味、组织的系水力和肉色[13]。虽然大量的研究集中在肌内脂肪对肉品质的影响[14-15],但在意大利杜洛克猪的育种计划中,肌肉中的肌间脂肪含量已被作为其干腌火腿的品质特征之一[16]。肌间脂肪也是决定肉产品是否优质的关键因素,因此研究影响肌间脂肪沉积的因素以及沉积的机理对于提高肉品质有着重要作用。
2 肌间脂肪的主要调控因素及潜在机理
2.1 肌间脂肪的种间差异
品种直接决定猪的遗传性状,不同品种猪的肌间脂肪含量不同。肌间脂肪含量在我国地方品种与国外选育品种猪之间存在明显差异。有研究表明,在体重为20~90 kg的生长期内,合成系配套杂交猪、大白公猪、大白母猪和梅山猪的肌间脂肪含量分别为4.29、4.56、5.22和7.62 kg[17]。李盼等[18]对地方品种藏猪和滇南小耳猪与大白猪脂肪沉积差异进行的研究表明,藏猪和滇南小耳猪硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase,SCD)表达量显著高于大白猪,SCD主要调节脂肪酸的生物合成。陶璇等[19]研究发现SCD基因在藏猪和杜洛克猪中表达量与肌内脂肪呈正相关。淮南猪脂肪组织中脂肪酸合酶(fatty acid synthase,FAS)的活性显著高于长白猪[20]。可见我国地方品种猪具有优良的肌间和肌内脂肪沉积能力。此外,Wood等[21]研究表明,大白猪生长速度快于杜洛克猪,且脂肪更薄,杜洛克猪背最长肌含有较高的脂质浓度和较低的水分含量。造成上述种间差异的主要原因之一是不同品种猪的脂肪沉积相关基因表达水平不同。
2.2 表观遗传对肌间脂肪沉积的影响
表观遗传学是指在基因的DNA序列没有发生改变的情况下,基因的功能发生可遗传的变化,并最终导致表型的变化。基因修饰、蛋白质与蛋白质、DNA和其他分子的相互作用会影响和调控基因的表达、功能和特性,这在一定程度上解释了为什么同一品种猪的不同组织、不同部位的脂肪含量不相同。DNA甲基化是调控基因转录活性和表达的典型因素之一,其与基因的表达水平呈负相关[22]。已有报道指出,DNA的甲基化能影响脂肪的沉积[23]。例如瘦肉型的长白猪背脂与ATP合酶活性相关基因甲基化水平高于中国地方品种荣昌猪[24],表明较低能量代谢水平可能导致脂质合成效率降低。瘦肉型(杜洛克)猪与肥胖型(陆川)猪脂肪组织基因组差异甲基化区域比较后发现,瘦肉型猪的DNA甲基化水平较肥胖型猪高[25]。肥胖小鼠的过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)α DNA甲基化水平显著高于正常小鼠[26]。此外,还有研究表明猪浅表脂肪组织中与脂质代谢相关的基因相比与深层脂肪组织,DNA甲基化程度更高[27],这证明不同的脂肪组织甲基化程度也存在不同。
2.3 肌间脂肪沉积的相关分子机制
研究表明,肌间脂肪的含量与总脂肪量密切相关[17],而直接影响脂肪沉积的主要原因是脂肪酸的运转、脂肪合成代谢以及分解代谢的相关蛋白表达[28]。大量研究表明,腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路是调控脂肪沉积与分解的关键通路。
AMPK是一种丝氨酸(Ser)/苏氨酸(Thr)激酶[29],关键功能是调节细胞内的能量平衡[30]。AMPK包括α催化亚基、β和γ调节亚基,α亚基的N端包含Ser/Thr激酶区和1个需要被磷酸化的Thr172位点,C端主要负责联系β亚基;β亚基包含1个糖原结合区和1个联系α、γ亚基的C末端结合区;与AMP、ADP结合的γ亚基,能够促进α亚基的Thr172位点被上游激酶磷酸化,从而激活AMPK[31]。AMPK的激活受到AMP与ATP比值的调节,当细胞的ATP水平降低,通过高浓度5’-AMP和AMPK的γ亚基相互作用来激活AMPK,AMPK会通过降低生物合成来保存ATP[32],并通过响应激素和营养信号来参与全身能量平衡的调节,其激活可促进ATP生成机制,如诱导脂肪酸氧化,同时抑制脂肪生成和脂肪细胞分化,并刺激肌肉对葡萄糖的摄取[33-34]。而蛋白磷酸酯酶-1(PP1)、蛋白磷酸酯酶-2A(PP2A)和蛋白磷酸酯酶-2C(PP2C)3种蛋白激酶则能使Thr172残基去磷酸化,抑制AMPK的激活。中国地方猪民猪相较于大白猪,因为AMPK的低水平表达,从而有更高的脂肪沉积[35],可见AMPK表达水平与肌间脂肪沉积量存在潜在负相关关系。
PPAR是核激素受体家族中的配体激活受体,与配体结合激活后,与视黄醇X受体(retinoid X receptor,RXR)形成异二聚体,形成的PPAR-RXR异二聚体与靶基因启动子上游的PPAR反应元件结合,最终调节靶基因的转录。AMPK能提高PPARαmRNA的表达、降低PPARγmRNA的表达。其中PPARα是β-氧化的重要调节剂[36],表达提高可以促进脂质氧化[37]。有研究发现,PPARα缺失会导致小鼠的肥胖和脂肪肝加重[38],而PPARαmRNA表达水平升高,能减少肝脏中甘油三酯含量[39]。且激活PPARα能降低高脂饲养的大鼠肌肉脂肪含量[40]。PPARγ能诱导间充质干细胞分化为前脂肪细胞,参与脂质代谢相关基因的表达调控,促进脂肪酸合成。使用PPARγ激活剂后,能上调猪皮下和肌肉脂肪细胞中有关脂肪细胞分化的标志基因的表达[41]。Cui等[42]研究表明,PPARγmRNA表达量与莱芜猪、鲁莱黑猪以及大白猪肌内脂肪沉积均呈显著正相关。活化的AMPK有抑制p38丝裂原活化蛋白激酶(MAPK)磷酸化的作用,p38 MAPK是细胞外信号转导的枢纽,磷酸化的p38 MAPK在信号转导通路中可以调控PPARγ的表达[43]。AMPK还能通过调节下游的乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)和肉毒碱棕榈酰转移酶-1(carnitine palmitoyl transterase-1,CPT-1)来调控脂肪的代谢[35]。Merrill等[44]对SD大鼠的研究显示,AMPK的表达增加会导致大鼠肌肉ACC活性减少,促进脂质氧化以及葡萄糖的摄取[44]。ACC是长链脂肪酸从头合成的限速酶,催化脂肪酸合成的第一步反应,可以通过磷酸化和去磷酸化发挥调节脂肪酸合成的作用[45]。AMPK在Ser 79处直接磷酸化ACC,这种磷酸化会抑制ACC的活性[46],进而降低细胞内丙二酰辅酶A的含量,后者是CPT-1的生理抑制剂,因此解除了CPT-1的抑制作用[47]。CPT-1本身还受PPARα调节,PPARα可以直接作用于CPT-1启动子,在转录水平上影响CPT-1的表达[48],使CPT-1表达水平提高,促进脂肪酸的β-氧化[49]。CPT-1是脂肪酸β-氧化的关键限速酶,对脂肪氧化的整个过程都有重要的调控作用。CPT-1主要负责催化肉毒碱和乙酰辅酶A合成乙酰肉碱[50],将脂肪酸转运到线粒体中进行氧化[51]。AMPK还可以抑制胆固醇调节元件结合蛋白-1c(sterol-regulatory element binding protein-1c,SREBP-1c)的表达。SREBP-1c是固醇原件结合蛋白家族的成员,能调节脂肪酸合成所需的基因的表达,促进细胞生成脂肪[52]。敲除C57BL/6J小鼠SREBP-1c基因,或SREBP-1c基因表达水平下降,都会导致脂肪含量显著降低[53-54]。过表达SREBP-1c可以增加3T3-L1前体脂肪细胞中ACC等脂肪沉积相关基因的表达[55],还能与FAS靶基因的启动子结合[56],FAS与肌肉和脂肪中脂肪酸含量密切相关,FAS表达量升高,体内甘油三酯含量增加,导致脂肪沉积[57]。AMPK还能通过下调CCAAT增强子结合蛋白α(CCAAT/enhancer binding protein α,C/EBPα)和脂肪酸结合蛋白(fatty acid-binding protein,FABP)表达水平,抑制脂肪合成[1,58]。有研究表明,C/EBPα能活化PPARγ,保持分化细胞的表型[59],从而调控脂肪细胞分化和脂肪沉积[9],但只有在PPARγ表达的前提下,过表达C/EBPα才能诱导成纤维细胞向脂肪细胞分化[60]。有研究表明,在3T3-L1脂肪细胞中,能通过下调C/EBPα和PPARγmRNA的表达水平来抑制脂肪生成[61]。存在于脂肪组织中的FABP称为A-FABP或FABP4,能将脂肪酸从刷状膜向光滑内质网位移,在脂类的代谢和运转中起着重要作用,并能在脂肪细胞中沉积甘油三酯,从而改善肉质[62-63]。总而言之,大量研究都证明了AMPK处于脂肪调控通路的中心位置,其表达水平对各类脂肪沉积均有重要影响。图1总结概述了AMPK信号通路在脂肪代谢中的调控作用。
3 营养因素对肌间脂肪的影响
近年来大量研究表明,营养能影响动物的表观遗传,通过改变饲粮能量、蛋白质水平,或者在饲粮中添加营养素来调控脂肪沉积,从而改善猪的胴体品质及肉品质,已成为畜牧学研究的热点之一。
3.1 能量
从饮食中获得的能量水平很大程度影响着机体的脂肪沉积量。猪在不同生长阶段所需能量水平不同,通过调控饲粮能量水平可有效改善猪的胴体品质及肉品质。饲粮中消化能(DE)水平能通过调控以PPAR为中心的脂肪代谢通路来提高脂肪沉积量[64]。饲粮DE为16 MJ/kg时可以显著降低猪PPARαmRNA在肌肉中的表达[65]。DE为13.85 MJ/kg相比于DE为12.75 MJ/kg,有提高60 kg“杜长大”三元杂交猪FABP基因表达量的趋势,并且能显著提高背脂厚度与肌内脂肪含量[66]。
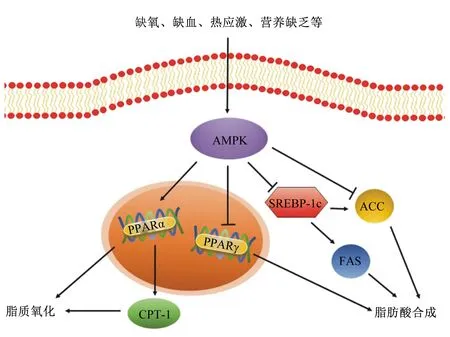
AMPK:腺苷酸活化蛋白激酶 AMP-activated protein kinase;PPAR:过氧化物酶体增殖物激活受体 peroxisome proliferators-activated receptor;CPT-1:肉毒碱棕榈酰转移酶-1 carnitine palmitoyl transterase-1;SREBP-1c:胆固醇调节元件结合蛋白-1c sterol-regulatory element binding protein-1c;ACC:乙酰辅酶A羧化酶 acetyl CoA carboxylase;FAS:脂肪酸合酶 fatty acid synthase;↓:促进 promote;⊥:抑制 inhibit。
3.2 蛋白质
蛋白质能调节猪的肌肉发育和脂肪沉积,因此饲粮的蛋白质水平对改善肉品质有重要作用[67]。降低饲粮蛋白质水平可以促进脂肪沉积。相比于粗蛋白质水平为18%的“杜长大”三元杂交猪,当饲粮粗蛋白质水平降低3个百分点时,其肌肉内ACCmRNA水平显著提高,肌内脂肪含量也显著增加[68]。低蛋白质组(16%粗蛋白质)的杜洛克猪和塔姆沃思猪肌间脂肪含量显著大于对照组(20%粗蛋白质)[69],并且随着理想蛋白质水平的提高,大白×长白杂交猪的大理石纹评分显著下降,瘦肉率趋于增加等[70],这可能也与肌间脂肪的沉积存在关联。还有研究表明,母猪在哺乳期限饲蛋白质,可以显著降低后代肌纤维面积,从而影响肉品质[71]。鉴于当饲粮中蛋白质水平低于NRC(1998)标准不超过4个百分点时,其对猪的生长性能不会产生显著影响[72],且有助于肌间脂肪沉积,提高猪肉品质,因此在生产过程中可以适当降低饲粮蛋白质水平。
3.3 氨基酸
氨基酸不仅能在机体内合成蛋白质,还可以作为信号分子调控脂肪沉积,改善猪肉风味和品质[73]。不同种类氨基酸对脂肪沉积的调控作用不同,大量研究表明赖氨酸、精氨酸、亮氨酸等氨基酸能通过调节脂肪代谢关键基因例如AMPK及其下游PPAR等基因的表达来影响脂肪沉积。当降低饲粮中赖氨酸与可消化能比值后,可以提高猪肌肉组织中PPARγ基因的表达水平[74],促进肌肉脂肪的沉积。虽然有研究报道补充精氨酸导致体脂降低8%[75],但在“杜长大”三元杂交猪的饲粮中添加1%的精氨酸能上调骨骼肌中PPARγmRNA表达水平[76],背最长肌脂肪含量也显著提高[77],这证明精氨酸能在降低总脂肪的同时提高肌肉脂肪,对于提高肉品质有重要作用。饲粮中添加1%亮氨酸可以显著提高“杜长大”三元杂交猪背最长肌脂肪含量[78]。但在高脂C57BL/6J小鼠中添加亮氨酸会显著降低ACC在脂肪组织中的表达,而AMPK表达水平显著升高,从而降低脂肪的沉积[79],这可能是由于亮氨酸在正常情况下能促进脂肪沉积,但在高脂情况下反而会促进脂肪的氧化分解代谢。
3.4 共轭亚油酸(conjugated linoleic acid,CLA)
CLA参与机体脂肪代谢,且对猪体况以及肉品质有积极影响,近年来开始被广泛研究和报道。CLA的生物学作用之一是与脂肪沉积和养分代谢有关[80]。饲粮中额外添加CLA可以改善机体生长性能,提高肌间脂肪含量[81],减少皮下脂肪含量[82]。4%CLA可以提高长白×杜洛克杂交猪背最长肌肌间脂肪的PPARγ表达水平,促进肌间脂肪的沉积,有利于提高猪肉品质[83],这与Cordero等[84]和Zhong等[85]研究结果一致。
3.5 微量元素
在饮食中添加微量元素是改善猪肉品质的饮食干预之一,当在猪饲粮中添加有机硒后,能明显降低脂肪氧化,提高猪肉品质[28]。高铜对于猪有显著的促生长作用,但当饲粮中添加250 mg/kg铜之后,会降低背膘厚4.7%,对肉品质产生负面影响[86]。虽然有关微量元素调控猪脂肪沉积机理的报道较少,但大量研究表明微量元素对猪肉品质有重要调控作用,而猪的脂肪沉积也能影响肉品质,因此饲粮添加微量元素与机体脂肪沉积之间也必定存在着密不可分的关系。
3.6 植物提取物
除了几大营养素对脂肪沉积有重要影响,大量研究还表明一些植物提取物具有降脂作用[87]。植物提取物中的生物活性成分能影响表观遗传,起到修饰基因的作用,从而改变DNA表达并调控脂肪沉积,例如紫檀芪能逆转肥胖饮食引起的大鼠FAS基因DNA甲基化升高[88],缓解饮食引起的肥胖症状;姜黄素能显著逆转高脂大鼠PPARαDNA甲基化水平的升高[89],降低脂肪沉积;白藜芦醇能显著降低脂肪细胞中PPARγ表达水平,抑制脂肪的沉积[90]。植物提取物在降低总脂肪沉积量的同时,是否能提高肌间脂肪含量以及品质有待进一步研究。
4 小 结
肌间脂肪是肉品质的重要评判标准,如何降低皮下和腹部脂肪,同时提高肌间和肌内脂肪比例是改善胴体品质和肉品质的重点和难点所在,因此阐明脂肪沉积的分子机理显得尤为关键。近年来研究表明,AMPK及其下游PPAR等相关基因的表达与脂肪沉积有着密切的关联,而营养因素可以通过甲基化和去甲基化等途径调控基因的表达水平,但具体的调控机制仍然不明确。从调控脂肪代谢的信号通路入手,明确不同组织中脂肪形成的分子机理,筛选获得脂肪沉积的关键调控位点,对精准调控脂肪沉积改善肉品质至关重要。
