基于胰岛素样生长因子-Ⅰ信号通路体外研究丁酸钠促进羔羊瘤胃上皮细胞增殖的机理
2021-04-13张雅丽刘理想孙大明刘军花
张雅丽 刘理想 孙大明 刘军花
(国家动物消化道营养国际联合研究中心,江苏省消化道营养与动物健康重点实验室,南京农业大学动物科技学院消化道微生物研究室,南京210095)
瘤胃作为反刍动物特有的消化吸收器官,其发育状态直接影响反刍动物生产性能和健康。而新生反刍动物瘤胃功能发育尚不完善,不能够充分地消化和吸收固体饲料[1],所以在生产中通过营养手段促进幼龄反刍动物瘤胃的发育和成熟对提高动物生产性能和维持动物健康具有重要意义。瘤胃的发育成熟包括瘤胃微生物区系的建立健全及瘤胃上皮形态和功能的完善;瘤胃微生物区系的建立健全主要是保证高效消化植物性固体饲料产生挥发性脂肪酸(VFA)及菌体蛋白;瘤胃上皮功能的完善主要是保证高效吸收和代谢VFA,维持瘤胃稳态并为机体供能[2]。瘤胃上皮发育与细胞周期的变化密切相关。细胞周期包括静止期(G0期)、分裂间期(G1期、S期和G2期)和分裂期(M期)。其中,G1期调节细胞周期蛋白(Cyclin)DⅠ和细胞周期蛋白依赖性激酶(CDK)4的mRNA的大量表达,推动细胞周期快速进入S期[3-4],在S期急速合成与DNA复制相关的酶类[5-6]。
近期研究表明,口腔灌服0.36 g/kg BW的丁酸钠可促进哺乳期羔羊瘤胃乳头的生长,并且该过程与瘤胃上皮细胞增殖的加速和细胞凋亡的抑制相关[7-8],表明灌服适宜剂量丁酸钠对瘤胃上皮的发育有促进作用[9],但是灌服不同剂量丁酸钠对瘤胃上皮细胞的促进作用及机制需进一步探明。研究证实,瘤胃发酵产物丁酸在体内条件下能够促进瘤胃上皮发育,但单独在体外试验中却没有发挥作用[8],上述研究提示,丁酸促进瘤胃上皮发育并非直接作用,可能与某些激素调节作用密切相关[9]。同时,相关研究发现,在培养基中添加适量的胎牛血清有利于细胞的生长,这可能是胎牛血清中的胰岛素样生长因子-Ⅰ(IGF-Ⅰ)诱导细胞周期停滞的成纤维细胞CyclinDⅠ表达和Cyclin-CDK4复合物合成,进而加快细胞增殖,于是采用无血清的培养基培养细胞,单独添加适量的IGF-Ⅰ后,2 d内细胞增殖明显加快,合成的DNA量也明显增多[10]。
在单胃哺乳动物中,IGF-Ⅰ可以通过自分泌或旁分泌方式调节多种组织的细胞增殖和凋亡,IGF-Ⅰ和胰岛素样生长因子-Ⅰ受体(IGF-ⅠR)结合后可以激活下游多条信号转导通路,将相关细胞信号从细胞外转导至细胞内,激活转录因子,发挥其促进细胞增殖、抑制细胞凋亡的生物学效应[11-13]。而在新生反刍动物上尚未有相关报道。现有研究表明,灌服丁酸钠促进反刍动物瘤胃上皮细胞增殖与IGF-Ⅰ、IGF-ⅠR和瘤胃上皮增殖因子密切相关[14-17]。因此,本文通过体外细胞试验,研究不同浓度丁酸钠对瘤胃上皮细胞周期进程和细胞凋亡的影响,再进一步探究丁酸钠通过IGF-Ⅰ信号通路调控瘤胃上皮细胞增殖的作用机制,为生产中通过营养手段促进幼龄反刍动物瘤胃的发育和成熟、提高动物生产性能和维持动物健康提供依据。
1 材料与方法
1.1 瘤胃上皮细胞的分离与培养
试验选择4只49日龄,性别一致,体重分别为11.3、12.9、11.2和11.0 kg的湖羊公羔羊用于细胞试验。羔羊瘤胃上皮细胞的分离及培养参照Stumpff等[18]和卢劲晔[19]的方法进行了改进。具体操作步骤如下:
1)羔羊屠宰后立即分离瘤胃,用6倍的青链霉素的D-Hanks溶液多次冲洗,去除瘤胃内容物,然后再漂洗2~3次,能有效地去除残留的细菌和真菌。
2)在D-Hanks溶液中小心地用分离工具如剪刀、镊子、手术刀等钝性分离黏附的浆膜和肌肉,收集瘤胃腹囊部上皮组织块,然后再用D-Hanks溶液冲洗3次。
3)将瘤胃组织剪成小块平铺在锥形瓶底部,加入含0.25%的胰蛋白酶液(Gibco公司,美国)在37 ℃水浴中消化30 min,消化液没过组织即可,每隔5 min轻轻摇晃,使其消化均匀。
4)重复上述胰蛋白酶消化步骤3次;若中途胰蛋白酶溶液出现浑浊,可进行更换;等到瘤胃上皮组织出现黏稠且乳头发白,一般羊的瘤胃上皮组织的消化时间为2~3 h。
5)进入超净台操作,将上述处理后的上皮组织置于无菌烧杯中,用D-Hanks液清洗3次,更换烧杯再洗3次。
6)清洗后用含0.25%胰蛋白酶继续消化,直到看到有细碎细胞脱落(大部分是椭圆形细胞时开始收集),间隔5 min收集1次细胞消化液。
7)收集的细胞消化液用70 μm的滤膜进行过滤(事先在收集的离心管中加入2 mL的血清)后,在1 500 r/min下离心8 min收集细胞。
8)用磷酸盐缓冲溶液(PBS)将收集到的细胞沉淀清洗2次,用完全培养基重悬细胞后离心,然后调节细胞密度至1×106个/mL,接种到培养瓶中(除培养基外还要加入10%的胎牛血清、100 U/mL青霉素和100 μg/mL链霉素),置于5% CO2,37 ℃培养箱中培养。
9)培养1 h后,轻轻吸取上层悬液于另一培养瓶中继续培养,换瓶培养重复2次可有效去除成纤维细胞;换瓶培养48 h后,更换新的完全培养液继续培养(瓶底铺满明胶的培养瓶),5 d后细胞大量贴壁,形态均一,呈鳞片状,即绵羊羔羊瘤胃上皮细胞(图1)。细胞贴壁后可进行试验处理。

图1 羔羊瘤胃上皮细胞消化分离后120 h生长情况
10)将细胞冻存,在铺层至80%~90%时,PBS清洗2次,用不含乙二胺四乙酸(EDTA)的质量分数为0.25%的胰蛋白酶消化4 min,终止消化后离心处理,重悬于冻存液[胎牛血清∶杜尔贝科改良伊格尔培养基(DMEM)=9∶1],按照冻存步骤储存于液氮中。
1.2 丁酸钠和IGF-ⅠR抑制剂溶液配制
丁酸钠溶液的配制:取1 g丁酸钠(Sigma公司,美国)溶解于11.35 mL的DMEM中,配制成浓度为800 mmol/L的母液,试验时再稀释成所需要的浓度。
IGF-ⅠR抑制剂[鬼臼苦素(picropodophyllin,PPP)]溶液配制:将100 mg的IGF-ⅠR抑制剂(Merck Millipore公司,美国)溶解在100 μL的二甲基亚砜(Sigma公司,美国)中,然后加入9.5 mL的DMEM配制成浓度为2.5×10-4mol/L的母液。参照Duan等[20]研究,试验时IGF-ⅠR抑制剂需要配制成浓度为2.5 μmol/L的溶液。
1.3 体外细胞试验设计
待细胞贴壁大约80%后,更换培养基,将胎牛血清的浓度降至0.5%,饥饿12 h,使细胞同步化。然后将细胞分为4组,分别添加0、2、4、8 mmol/L丁酸钠。为了进一步研究IGF-Ⅰ信号通路在添加丁酸钠促进瘤胃上皮细胞增殖中的作用,将细胞分为3组,丁酸钠组添加4 mmol/L丁酸钠,抑制剂组添加4 mmol/L丁酸钠+2.5 μmol/L IGF-ⅠR抑制剂(在添加丁酸钠前1 h加入IGF-ⅠR抑制剂),对照组加入相同体积的DMEM。所有细胞试验重复4次。细胞处理24 h后收集细胞液用于测定IGF-Ⅰ浓度,收集细胞检测细胞周期以及增殖和凋亡相关基因的表达。
1.4 细胞样品采集
瘤胃上皮细胞培养24 h后,吸取1 mL的细胞培养液置于-80 ℃保存,用于IGF-Ⅰ浓度测定。剩余细胞培养液在1 500 r/min下离心10 min,获得细胞沉淀,同时在细胞培养瓶中加入胰蛋白酶将贴壁细胞消化下来,2种细胞沉淀混合后,用PBS(pH 7.4)洗涤2次。一部分细胞用75%的乙醇固定,4 ℃避光过夜用于细胞周期的检测;一部分细胞用TRIzol试剂重悬,置于-80 ℃保存用于RNA的提取。
1.5 细胞培养液中IGF-Ⅰ浓度测定和细胞周期检测
使用细胞培养液IGF-Ⅰ测定试剂盒(南京建成生物工程研究所)检测细胞培养液中IGF-Ⅰ浓度。使用细胞周期检测试剂盒(南京诺唯赞生物科技股份有限公司)检测细胞周期,采用FlowJo 7.6软件进行分析处理。
1.6 总RNA提取和cDNA合成
使用RNAiso Plus(TaKaRa公司,日本)从匀浆的瘤胃上皮组织中提取总RNA。使用NanoDrop ND-1000分光光度计(Thermo Fisher Scientific公司,美国)测定提取的总RNA的浓度和纯度。所有样品的260/280 nm吸光度(OD)值介于1.80~2.10,表明RNA纯度高。用1.4%琼脂糖-甲醛凝胶评估RNA完整性。使用含RNA酶的TaKaRa反转录试剂盒将总RNA(1 μg)反转录成cDNA。
1.7 引物的合成和实时荧光定量PCR(qRT-PCR)
使用Primer Premier 6.0软件设计目的基因和内参基因甘油醛-3-磷酸脱氢酶(GAPDH)的引物,并进行BLAST比对。本研究中使用的所有引物均由上海捷瑞生物工程有限公司合成,引物序列参见Liu等[7]。使用Q5 Real-time PCR仪(Applied Biosystems公司,美国)对目的基因和GAPDH进行定量。qRT-PCR在20 μL反应体系中进行,含有2 μL cDNA,0.8 μL引物(反应中最终引物浓度为0.4 μmol/L)和SYBR Green PCR Master Mix(TaKaRa公司,日本)作为荧光染料。反应条件如下:95 ℃ 30 s预变性;95 ℃ 5 s,60 ℃ 30 s,40个循环,95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s。所有样品设3个重复。目的基因的mRNA相对表达量计算参照Niwińska等[21]的2-△△Ct方法。
1.8 数据分析
使用SPSS 25.0软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行多重比较。P<0.05为差异显著,P>0.05为差异不显著。使用GraphPad Prism 6进行绘图。
2 结 果
2.1 不同浓度的丁酸钠对瘤胃上皮细胞周期的影响
如图2所示,随着丁酸钠浓度的升高,G0/G1期和S期细胞比例呈二次变化(P<0.05)。0和8 mmol/L丁酸钠组G0/G1期细胞比例显著高于2和4 mmol/L丁酸钠组(P<0.05),且8 mmol/L丁酸钠组显著高于0 mmol/L丁酸钠组(P<0.05),而2 mmol/L丁酸钠组显著高于4 mmol/L丁酸钠组(P<0.05)。4 mmol/L丁酸钠组S期细胞比例显著高于0、2和8 mmol/L丁酸钠组(P<0.05),且8 mmol/L丁酸钠组显著低于2 mmol/L丁酸钠组(P<0.05)。随着丁酸钠浓度的升高,G2/M期细胞比例呈线性降低(P<0.05),8 mmol/L丁酸钠组显著降低于0、2和4 mmol/L丁酸钠组(P<0.05)。
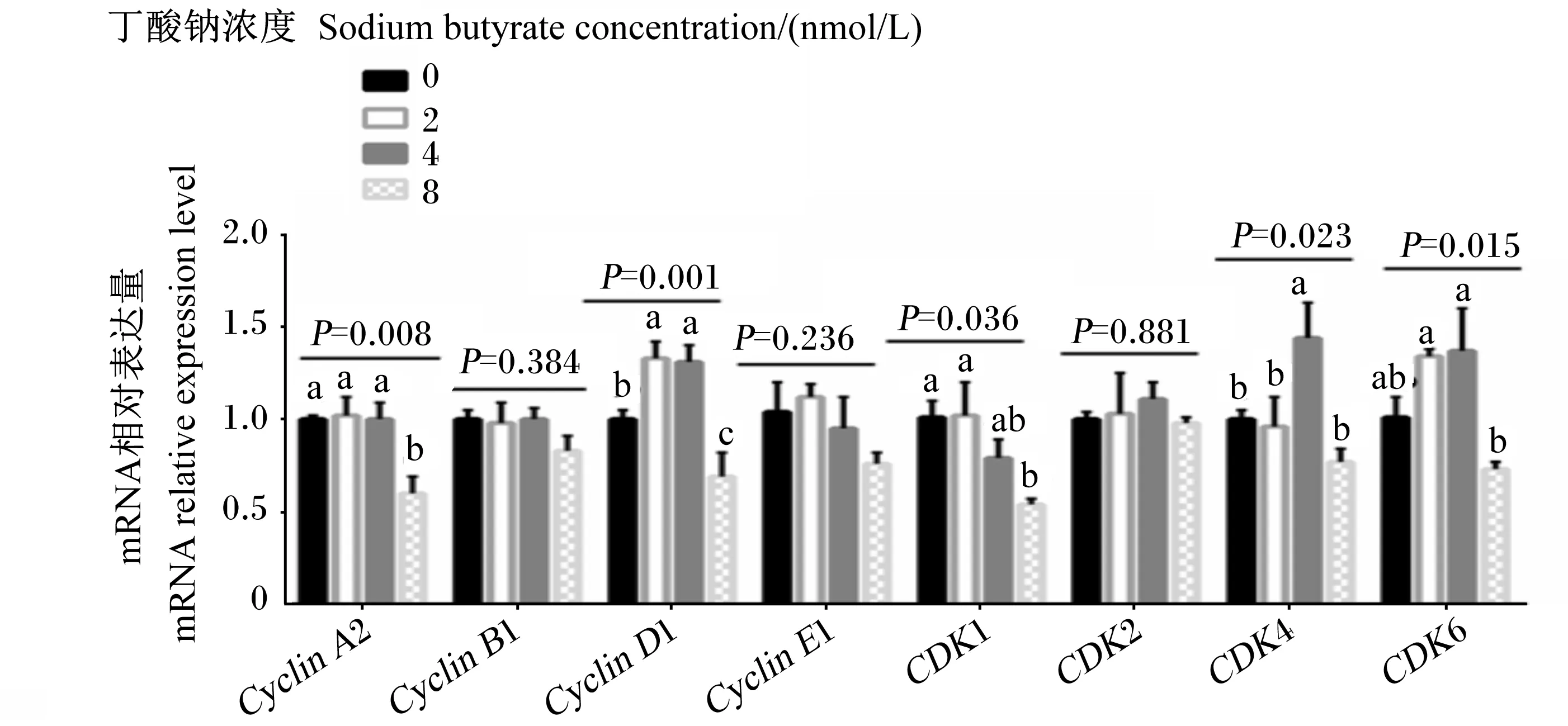
2.2 不同浓度的丁酸钠对瘤胃上皮细胞Cyclin和CDK mRNA相对表达量的影响
如图3所示,随着丁酸钠浓度的升高,羔羊瘤胃上皮细胞CyclinA2和CDKⅠ的mRNA相对表达量呈线性降低(P<0.05)。8 mmol/L丁酸钠组的CyclinA2 mRNA相对表达量显著低于0、2和4 mmol/L丁酸钠组(P<0.05),8 mmol/L丁酸钠组的CDKⅠ mRNA相对表达量显著低于0和2 mmol/L丁酸钠组(P<0.05)。随着丁酸钠浓度的升高,羔羊瘤胃上皮细胞CyclinDⅠ、CDK4和CDK6 mRNA相对表达量呈二次变化(P<0.05)。2和4 mmol/L丁酸钠组的CyclinDⅠ mRNA相对表达量显著高于0和8 mmol/L丁酸钠组(P<0.05),且8 mmol/L丁酸钠组显著低于0 mmol/L丁酸钠组(P<0.05);4 mmol/L丁酸钠组的CDK4 mRNA相对表达量显著高于0、2和8 mmol/L丁酸钠组(P<0.05);2和4 mmol/L丁酸钠组的CDK6 mRNA相对表达量显著高于8 mmol/L丁酸钠组(P<0.05)。不同浓度的丁酸钠对羔羊瘤胃上皮细胞CyclinBⅠ、CyclinEⅠ和CDK2 mRNA相对表达量无显著影响(P>0.05)。

数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。
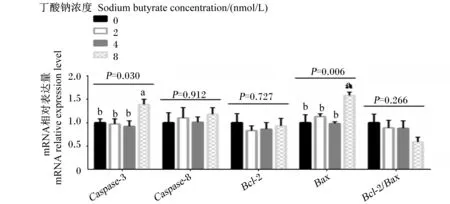
2.3 不同浓度的丁酸钠对瘤胃上皮细胞凋亡相关基因mRNA相对表达量的影响
如图4所示,随着丁酸钠浓度的升高,羔羊瘤胃上皮细胞含半胱氨酸的天冬氨酸蛋白水解酶-3(Caspase-3)和B淋巴细胞瘤-2相关的X蛋白(Bax)mRNA相对表达量呈线性升高(P<0.05)。8 mmol/L丁酸钠组的Caspase-3和BaxmRNA相对表达量显著高于0、2和4 mmol/L丁酸钠组(P<0.05)。不同浓度的丁酸钠对羔羊瘤胃上皮细胞含半胱氨酸的天冬氨酸蛋白水解酶-8(Caspase-8)、B淋巴细胞瘤-2(Bcl-2)和Bcl-2/BaxmRNA相对表达量无显著影响(P>0.05)。
Cyclin A2:细胞周期蛋白 cyclin protein A2;Cyclin B1:细胞周期蛋白 cyclin protein B1;Cyclin D1:细胞周期蛋白 cyclin protein D1;Cyclin E1:细胞周期蛋白 cyclin protein E1;CDK1:细胞周期蛋白依赖性激酶1 cyclin dependent protein kinases 1;CDK2:细胞周期蛋白依赖性激酶2 cyclin dependent protein kinases 2;CDK4:细胞周期蛋白依赖性激酶4 cyclin dependent protein kinases 4;CDK6:细胞周期蛋白依赖性激酶6 cyclin dependent protein kinases 6。图6同 The same as Fig.6.
Caspase-3:含半胱氨酸的天冬氨酸蛋白水解酶-3 cysteinyl aspartate specific proteinase-3;Caspase-8:含半胱氨酸的天冬氨酸蛋白水解酶-8 cysteinyl aspartate specific proteinase-8;Bcl-2:B淋巴细胞瘤-2 B-cell lymphoma-2;Bax:B淋巴细胞瘤-2相关的X蛋白 B-cell lymphoma-2-associated X protein;Bcl-2/Bax:B淋巴细胞瘤-2/B淋巴细胞瘤-2相关的X蛋白 B-cell lymphoma-2/B-cell lymphoma-2-associated X protein。图7同 The same as Fig.7.
2.4 丁酸钠对IGF-ⅠR抑制剂处理的瘤胃上皮细胞IGF-Ⅰ、IGF-ⅠR mRNA相对表达量和细胞培养液中IGF-Ⅰ浓度的影响
如图5所示,丁酸钠组的瘤胃上皮细胞IGF-ⅠRmRNA相对表达量和细胞培养液中IGF-Ⅰ浓度显著高于对照组和抑制剂组(P<0.05),但是对照组和抑制剂组之间IGF-ⅠRmRNA相对表达量和细胞培养液中IGF-Ⅰ浓度无显著差异(P>0.05)。各组瘤胃上皮细胞IGF-Ⅰ mRNA相对表达量无显著差异(P>0.05)。
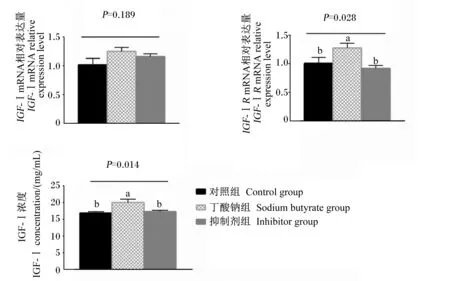
图5 丁酸钠对IGF-ⅠR抑制剂处理的瘤胃上皮细胞IGF-Ⅰ、IGF-ⅠR mRNA
2.5 丁酸钠对IGF-ⅠR抑制剂处理的瘤胃上皮细胞Cyclin和CDK mRNA相对表达量的影响
如图6所示,丁酸钠组瘤胃上皮细胞CyclinDⅠ和CDK4 mRNA相对表达量显著高于对照组和抑制剂组(P<0.05)。各组瘤胃上皮细胞CyclinA2、CyclinBⅠ、CyclinEⅠ、CDKⅠ、CDK2和CDK6 mRNA相对表达量无显著差异(P>0.05)。

图6 丁酸钠对IGF-ⅠR抑制剂处理的瘤胃上皮细胞凋亡相关基因mRNA相对表达量的影响
2.6 丁酸钠对IGF-ⅠR抑制剂处理的瘤胃上皮细胞细胞凋亡相关基因mRNA相对表达量的影响
如图7所示,各组瘤胃上皮细胞Caspase-3、Caspase-8、Bcl-2、Bax和Bcl-2/BaxmRNA相对表达量无显著差异(P>0.05)。
3 讨 论
反刍动物瘤胃上皮细胞的生长发育与细胞周期的变化密切相关。细胞周期的1个或多个阶段的变化最终影响细胞的产生速率和最终的转化时间[22]。细胞周期的每个阶段(G0期、G1期、S期、G2期和M期)由Cyclin和CDK的活性控制[23]。Cyclin A2参与S期DNA复制的起始和完成[24]。从G1期进入S期,Cyclin EⅠ替代Cyclin A2和CDK2起作用[25]。Cyclin A2-CDK2复合物通过磷酸化驱动染色质浓缩对DNA复制具有重要作用[26]。Cyclin结合并激活其伴侣CDK,然后活性激酶使细胞内的大量蛋白质底物磷酸化以改变蛋白质的活性,调节mRNA的转录和翻译[8],使细胞周期能够顺利进行;如果有细胞周期蛋白依赖性激酶抑制因子(CKI)降低活性激酶的活性,那么Cyclin-CDK复合物的形成受到阻碍,阻止细胞周期的正常变化。Cyclin DⅠ、Cyclin D2、Cyclin D3及Cyclin E在G1期达到其合成和活性的高峰,调节细胞从G1期过渡到S期,保证细胞的增殖过程,而抑制Cyclin的表达会延长细胞停留在G1期的时间,从而减少细胞的增殖[27]。同时,瘤胃上皮的发育也与细胞凋亡的变化密切相关,也是瘤胃上皮发育的重要组成部分,细胞凋亡进程主要受Bcl-2和含半胱氨酸的天冬氨酸蛋白水解酶(Caspases)家族调控[28-30]。据报道,通过灌服丁酸钠可以调控IGF-Ⅰ浓度来调控上皮细胞增殖的基因表达[7]。有研究表明,IGF-Ⅰ通过改变Cyclin DⅠ蛋白的表达来调节Cyclin DⅠ-CDK4复合物的合成,推动细胞周期运转[31];在缺乏血清的情况下,添加IGF-Ⅰ可诱导细胞周期停滞的成纤维细胞Cyclin DⅠ蛋白表达,细胞周期恢复正常运转[19]。所以羔羊灌服一定量的丁酸钠可能通过IGF-Ⅰ信号通路间接地调控瘤胃上皮细胞增殖。

图7 丁酸钠对IGF-ⅠR抑制剂处理的瘤胃上皮细胞凋亡相关基因mRNA相对表达量的影响
本文体外细胞试验结果发现,8 mmol/L的丁酸钠处理羔羊瘤胃上皮细胞24 h,增加了细胞周期G0/G1期的细胞比例,降低了细胞周期S期和G2/M期的细胞比例,同时下调了瘤胃上皮细胞CyclinA2、CyclinDⅠ和CDK6的表达,上调了凋亡基因Caspase-3和Bax的表达。以上结果说明高浓度的丁酸钠有抑制细胞增殖的作用。同时,Gabel等[32]研究表明,当灌服丁酸钠浓度较高时,瘤胃上皮细胞的增殖在某一时刻停止,而细胞的分化程度增加。Baldwin等[33]研究表明,在持续灌服丁酸钠168 h后,上调了与细胞分化相关的基因表达,同时下调了与瘤胃上皮细胞增殖相关的基因表达。与使用8 mmol/L丁酸钠相比,使用2和4 mmol/L丁酸钠处理羔羊瘤胃上皮细胞24 h,上调了瘤胃上皮细胞CyclinDⅠ、CDK4和CDK6的表达,且4 mmol/L丁酸钠的作用优于2 mmol/L丁酸钠。CyclinDⅠ、CDK4和CDK6是G1期重要的Cyclin和相关依赖性激酶,推动细胞周期G1期到S期的过渡[8]。同时,本研究发现使用2和4 mmol/L丁酸钠处理羔羊瘤胃上皮细胞24 h,降低了细胞周期G0/G1期的细胞比例,增加了S期的细胞比例,此结果与上调瘤胃上皮细胞CyclinDⅠ、CDK4和CDK6表达的结果相一致。上述结果说明较低浓度的丁酸钠具有加速细胞周期G1期到S期的过渡、推动细胞周期进程、促进瘤胃上皮细胞增殖的作用。彭志鹏等[34]研究也表明,低浓度丁酸可以促进体外培养瘤胃上皮细胞的生长,而高浓度的丁酸作用则相反。Gabel等[32]研究表明,高浓度丁酸可能会造成细胞分化和抑制上皮细胞增殖。Liu等[35]研究表明,5 mmol/L丁酸钠处理瘤胃上皮细胞对细胞周期阶段没有显著影响,而8、10和20 mmol/L丁酸钠处理增加了细胞周期G0/G1期的细胞比例,降低了S期和G2/M期的细胞比例,随着丁酸钠浓度的增加,这种作用越来越明显。上述体外细胞试验研究表明,不同浓度的丁酸钠对瘤胃上皮细胞增殖和凋亡的作用不同,为了更具体研究丁酸钠的促生长作用机制,试验中筛选4 mmol/L丁酸钠继续培养瘤胃上皮细胞。但是加入丁酸钠和IGF-ⅠR抑制剂明显下调了CyclinDⅠ和CDK4 mRNA相对表达量,说明IGF-ⅠR抑制剂可能阻断了IGF-Ⅰ信号通路,IGF-Ⅰ不能与受体结合激活相应酶类,进一步说明IGF-Ⅰ信号通路对羔羊瘤胃上皮细胞增殖和凋亡的影响。
目前体内研究发现,羔羊瘤胃乳头大小和表面积的增加证实了IGF-Ⅰ对瘤胃生长发育的促进作用[36-38]。在丁酸钠灌服促进羔羊瘤胃发育的同时,羔羊血浆IGF-Ⅰ浓度显著提高,也上调了瘤胃上皮IGF-ⅠR和胰岛素样生长因子结合蛋白-5(IGFBP-5)的表达[7]。再次证实丁酸钠可能是通过调控内源IGF-Ⅰ的分泌,进而通过IGF-Ⅰ信号通路来调控羔羊瘤胃上皮细胞增殖和凋亡。在正常情况下,当IGF-Ⅰ和IGF-ⅠR结合后,其酪氨酸和丝氨酸残基发生自身磷酸化反应,IGF-ⅠR的活化可以激活胰岛素受体底物-Ⅰ(IRS-Ⅰ)、胰岛素受体底物-2(IRS-2)、同源性和胶原蛋白(SHC)和磷脂酰肌醇-3-激酶(PI3K)等多种底物,这些底物的活化启动了不同的细胞信号转导通路,分别介导有丝分裂、细胞的增殖分化和抑制细胞凋亡等生物学功能[39-42]。本试验中通过PPP来抑制IGF-ⅠR的活性,PPP是一种常用的IGF-ⅠR抑制剂,可以与IGF-Ⅰ竞争性结合IGF-ⅠR达到抑制其活性的作用[38]。为了具体验证IGF-Ⅰ信号通路在丁酸钠调控瘤胃上皮细胞增殖和凋亡过程中的作用,在加入4 mmol/L丁酸钠前1 h,通过加入IGF-ⅠR抑制剂来抑制IGF-Ⅰ信号通路,进而观察丁酸钠对瘤胃上皮细胞增殖的作用。本研究发现,虽然4 mmol/L丁酸钠处理对IGF-Ⅰ的mRNA相对表达量无显著影响,但4 mmol/L丁酸钠处理升高了细胞液中IGF-Ⅰ浓度,上调了瘤胃上皮细胞IGF-ⅠR的mRNA相对表达量,而添加PPP抑制了瘤胃上皮细胞IGF-ⅠR、CyclinDⅠ和CDK4的mRNA相对表达量,并且降低了细胞培养液中IGF-Ⅰ浓度。这说明添加一定浓度的丁酸钠增加了IGF-Ⅰ的合成,并且推动瘤胃上皮细胞周期进程,促进瘤胃上皮细胞增殖[43];而4 mmol/L丁酸钠处理的瘤胃上皮细胞IGF-Ⅰ的mRNA相对表达量无显著差异,说明本试验的样品收集时间点可能存在缺陷,在今后的试验中需要增加样品收集的时间点。一定浓度的IGF-Ⅰ可诱导细胞周期停滞的成纤维细胞Cyclin DⅠ蛋白表达和Cyclin-CDK4复合物合成,促进其与CDK4异二聚体化,加快细胞周期从G1期到S期的转变,并增加瘤胃上皮细胞的DNA合成量[44]。所以细胞液中较高浓度的IGF-Ⅰ是促进瘤胃上皮细胞发育的重要因素[18]。本试验研究表明,抑制IGF-ⅠR能够有效阻断丁酸钠对瘤胃上皮细胞CyclinDⅠ和CDK4的mRNA表达及对细胞增殖的促进作用。所以IGF-Ⅰ必须与IGF-ⅠR结合以后才能上调瘤胃上皮细胞CyclinDⅠ的表达,促进其与相应的CDK4形成复合物,从而加速细胞周期进程,促进细胞增殖[37]。Sell等[45]研究发现,当小鼠IGF-ⅠR基因敲除后,体外培养的成纤维细胞即使在培养基中添加再多的胎牛血清,其增殖速度仍远低于正常细胞水平,延长了细胞周期的运转时间;血清饥饿法能使成纤维细胞的细胞周期停滞在G0/G1期,而添加IGF-Ⅰ后,细胞能够重新进入S期,恢复细胞周期正常运转,但对缺失IGF-ⅠR基因的小鼠则没有这种影响。总之,IGF-ⅠR是IGF-Ⅰ发挥促进细胞增殖作用的关键,只有两者结合才能发挥促进作用。
在本试验条件下,添加IGF-ⅠR抑制剂抑制了丁酸钠对羔羊瘤胃上皮细胞的增殖作用。而IGF-Ⅰ信号通路只有把细胞外的信号传导至细胞内才能对其靶细胞发挥一系列调控功能[39-42,46]。目前公认的IGF-Ⅰ信号转导途径有3条:Ras/Raf/丝裂原激活蛋白激酶(MEK)/胞外信号调节激酶(ERK)信号转导途径、PI3K/蛋白激酶B(AKT)信号转导途径和14-3-3蛋白/Raf信号转导途径。其中,Ras/Raf/MEK/ERK和PI3K/AKT信号转导途径与细胞增殖有关,然而14-3-3蛋白/Raf信号转导途径主要通过钝化凋亡蛋白(BAD)来抑制细胞凋亡,而IGF-Ⅰ激活细胞膜上的IGF-ⅠR就是通过经典的Ras/Raf/MEK/ERK信号传导途径来调节细胞增殖[14]。据Arunee等[47]报道,体外添加IGF-Ⅰ促进小鼠视网膜色素上皮细胞受体辅助因子(c-Raf)和ERK磷酸化,激活Ras/Raf/MEK/ERK信号传导途径,加快细胞周期G1期进程;相反,不论是否添加IGF-Ⅰ,只要Ras/Raf/MEK/ERK信号传导途径被阻断则导致细胞周期停滞。卢劲晔[19]研究表明,体外添加IGF-Ⅰ提高ERK磷酸化水平,而当ERK抑制剂抑制ERK磷酸化,则添加IGF-Ⅰ对瘤胃上皮细胞CyclinDⅠ表达的促进作用也被抑制。但是IGF-Ⅰ通过结合IGF-ⅠR激活Ras/Raf/MEK/ERK信号传导途径来提高羔羊瘤胃上皮细胞周期G1期CyclinDⅠ和CDK4的mRNA相对表达量,同时降低Caspase-3的mRNA相对表达量的具体机理还有待进一步研究。
4 结 论
① 体外培养细胞中添加2和4 mmol/L的丁酸钠可促进羔羊瘤胃上皮细胞增殖,而添加8 mmol/L的丁酸钠具有抑制细胞增殖、加快细胞凋亡的作用,说明较低浓度的丁酸钠可促进体外培养瘤胃上皮细胞的生长,而高浓度的丁酸钠作用则相反。
② IGF-Ⅰ信号通路在丁酸钠促进瘤胃上皮细胞发育的过程中具有重要作用,一定浓度的丁酸钠可以促进IGF-Ⅰ的分泌,IGF-Ⅰ与IGF-ⅠR结合后,推动细胞从G1期过渡到S期,进而促进瘤胃上皮细胞增殖。
