冰岛刺参缩醛磷脂和醚磷脂对神经生长因子诱导PC12细胞的促神经分化作用
2021-03-31李艺洋王晓旭王昕岑丛培旭薛长湖
李艺洋,丁 一,王晓旭,王昕岑,王 睿,丛培旭,徐 杰,,薛长湖,2
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.青岛海洋科学与技术试点国家实验室,山东 青岛 266235)
磷脂是一类广泛存在于动物血液、大脑、心脏、骨骼肌和肾脏的含磷脂类,是生物细胞膜的重要组成部分[1]。根据结构中头部基团的差异,磷脂可分为磷脂酰胆碱(phosphatidylcholine,PC)和磷脂酰乙醇胺(phosphatidylethanolamine,PE)等[2]。1924年Feulgen和Voigt发现了两类特殊磷脂[3]:其中,在甘油骨架sn-1位上仅存在醚键的磷脂被称为醚磷脂;除醚键外还含有一个双键的磷脂被称为缩醛磷脂;前者主要为烷氧型磷脂酰胆碱(plasmanylcholine,aPC),而后者主要为缩醛型磷脂酰乙醇胺(plasmenylethonoamine,pPE)。越来越多的研究表明,缩醛磷脂和醚磷脂都具有独特的生物活性,如神经保护、抗氧化应激、信息转导、抗肿瘤等[4-6]。
冰岛刺参(Cucumaria frondosa)属于光参类、瓜参科,其体壁内含有皂苷等多种活性成分及海参磷脂、脑苷脂和神经节苷脂等功能性脂质[7],是海参中品质上乘的参种。本课题组前期实验已发现冰岛刺参是缩醛磷脂和醚磷脂的原料来源,并建立了缩醛磷脂及醚磷脂的分离纯化方法[8]。研究表明,海参体内提取的活性脂质对阿尔茨海默症等神经退行性疾病有良好的预防和治疗作用,如海参中的脑苷脂可预防SAMP8小鼠和肾上腺嗜铬细胞瘤(pheochromocytoma,PC12)细胞的氧化应激[9],但其在神经分化和营养方面的研究还较少。
神经系统是由神经元延伸形成神经突起(包括树突和轴突)组成复杂的神经网,对于维持机体正常生理活动至关重要[10]。如果由于某些原因造成神经元和神经突起数量减少,则会导致阿尔茨海默症等神经退行性疾病[11],这类疾病被证实与脂质调控密切相关[12]。因此,寻找具有神经营养作用的活性物质具有重要意义。
目前,大量的小分子天然海洋化合物(如二十二碳六烯酸、皂苷、海洋生物活性碱等)显示出缓解和治疗神经系统疾病的潜力[13-14],但鲜见海洋源磷脂对神经营养作用的报道。大鼠PC12细胞不仅具备神经干细胞和成熟神经细胞的双重特性,且被广泛应用于神经系统疾病发病机制和药物作用机制方面的研究[15]。因此,本实验选取冰岛刺参为原料,提取、分离纯化pPE和aPC,以PC12为体外细胞模型,研究不同结构磷脂在促进细胞分化、突触生长方面的神经营养作用及构效关系,以期为海洋食品的加工利用、海洋活性脂质的功效探索以及相关功能性食品的开发提供新的理论依据。
1 材料与方法
1.1 材料与试剂
冰岛刺参 青岛市南山水产市场。
冷丙酮、氯仿、甲醇(分析纯) 国药集团化学试剂有限公司;Silica Gel 60(300~400 目) 加拿大Silicycle公司;氯仿、甲醇试剂(色谱纯) 美国Muskegon 公司;Nucleosil 100-5 OH色谱柱(4.6 mm×250 mm,5 μm)德国Macherey-Nagel公司;PE(14∶0/14∶0)、PC(14∶0/14∶0)标准品美国Avanti Polar Lipids公司;PC12细胞(未分化)中国科学院上海生化与细胞研究所;RPMI-1640干粉培养基、胎牛血清、神经生长因子(nerve growth factor,NGF)(2.5S-NGF)美国Gibco公司;SYBR Green Master Mix美国Fermentas公司;β-actin抗体美国Sigma公司;突触素(synaptophysin,SYN)抗体 英国Abcam公司。牛脑pPE为实验室前期制备,纯度为88.4%[8]。
1.2 仪器与设备
超高效液相色谱-四极杆/静电场轨道阱高分辨质谱仪美国Thermo Fisher公司;HF90/HF240 CO2培养箱、HFsafe1200LC系列安全柜、Neufuge 13R台式高速冷冻离心机上海力申科学仪器有限公司;iCycler iQ5系统实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,qPCR)扩增仪美国Bio-Rad公司;12V DC 30W倒置生物显微镜 蔡司科技(苏州)有限公司。
1.3 方法
1.3.1 pPE和aPC的分离、纯化及纯度鉴定
按照前期课题组研究方法[8]制备pPE和aPC。提取总脂,然后用2 倍体积冷丙酮沉淀并结合硅胶柱层析纯化磷脂,得到的粗磷脂继续通过硅胶柱(280 mm×800 mm)层析分离缩醛磷脂和醚磷脂。参考González-Domínguez等[16]的方法,采取液相色谱-质谱联用法对分离得到的缩醛磷脂和醚磷脂进行鉴定。参考Zhou Li等[17]的方法,根据精确分子质量、保留时间及二级质谱裂解规律进行结构鉴定,利用PE(14∶0/14∶0)、PC(14∶0/14∶0)标准品与峰面积归一化方法相结合计算纯度。
1.3.2 PC12细胞培养和细胞存活率的测定
按照Wang Xiaoxu等[18]的方法稍加改动。未分化的PC12细胞在含5%胎牛血清、10%马血清及1×105μg/L青霉素及链霉素的RPMI-1640培养基中于37 ℃、5% CO2饱和湿度培养箱中培养。常规培养细胞至对数生长期,用完全培养基配成密度为1×105个/mL的细胞悬液并接种于96 孔板,孵育24 h待细胞贴壁后更换为含不同质量浓度(10、20、40 μg/mL)磷脂的2%胎牛血清-RPMI-1640培养基,每孔200 μL,每个质量浓度6 个复孔;以不添加磷脂的2%胎牛血清-RPMI-1640培养基为空白对照。继续培养48、96 h和144 h后,吸去培养基,加入终质量浓度为0.5 mg/mL的噻唑蓝(3-(4,5-dimethyl-2-thiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromide,MTT)溶液。培养4 h后加入酸化异丙醇吹打至蓝紫色结晶完全溶解,用酶标仪于570 nm波长处检测样品和空白对照吸光度。细胞存活率按式(1)计算。

1.3.3 细胞分组
以二甲基亚砜为溶剂配制质量浓度40 mg/mL的pPE和aPC母液,使用前用DMEM培养基进行梯度稀释。未分化的PC12细胞按照如下形式进行分组:常规培养的对照组;添加10 ng/mL NGF培养的分化模型组;添加10 ng/mL NGF和5、20 μg/mL或40 μg/mL pPE和aPC溶液培养的处理组。
1.3.4 pPE和aPC对NGF诱导PC12细胞分化的影响
常规培养的PC12细胞添加10 ng/mL NGF和40 μg/mL牛脑pPE、冰岛刺参pPE或aPC持续孵育6 d,每组3 个复孔,每隔2 d换液。轴突长度大于等于胞体长度的细胞认为是分化细胞。孵育第6天进行拍照,每孔随机选择5 个区域,每个区域平均约有20 个PC12细胞,对每个区域的PC12细胞进行细胞分化率、轴突长度及数目统计,结果取平均值。细胞分化率按式(2)计算。

轴突长度为从一个细胞体伸出的最长轴突与胞体长度的比值;轴突数目为从一个胞体伸出的轴突个数[19]。
1.3.5 免疫荧光测定SYN的分布与表达
细胞布板后在含有40 μg/mL不同磷脂的10 ng/mL NGF-2%胎牛血清-RPMI培养基中孵育24 h后,冷磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤3 遍,加入4 g/100 mL多聚甲醛溶液,室温固定40 min。PBS洗涤3 次后加入质量分数0.4% Triton X-100溶液固定30 min以破坏细胞膜。用2 g/100 mL牛血清白蛋白溶液(PBS配制)37 ℃培养箱中封闭1 h。PBS洗涤3 次后分别加入对应的一抗溶液(SYN按1∶1 000稀释)4 ℃过夜[18]。清洗后添加荧光标记的二抗室温避光孵育40 min。2 μg/mL 4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole dihydrochloride,DAPI)染色液复染20 min,封片剂封片,避光4 ℃保存,待激光扫描共聚焦显微镜观察。
1.3.6 qPCR测定syn和GAP-43mRNA的表达
PC12细胞经冷PBS漂洗3 次,进行总RNA的提取并计算纯度和含量。采用SYBR Green I Master Mix通过qPCR检测各目的基因mRNA的表达量。25 μL反应体系:样品cDNA 2.5 μL、SYBR Green 12.5 μL、上游和下游引物各0.75 μL、DEPC水8.5 μL。PCR扩增程序:95 ℃预变性10 min;95 ℃变性15 s,57 ℃退火20 s,72 ℃延伸30 s,共45 个循环[20]。各基因mRNA表达量以β-actinmRNA表达量作为内参校正,并将对照组表达量设为1。相关基因引物序列均由生工生物工程(上海)有限公司合成,具体序列如表1所示。
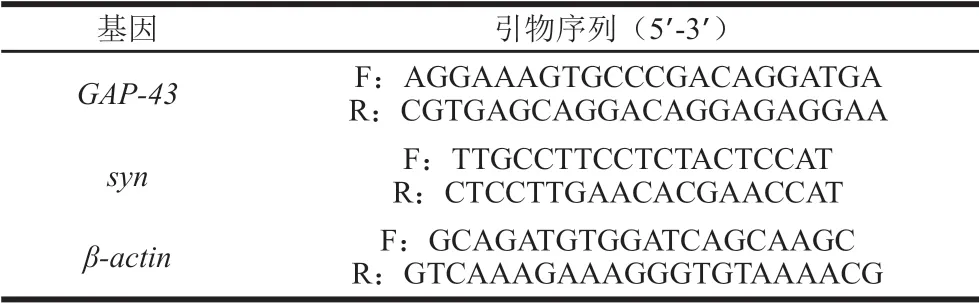
表 1 qPCR引物序列Table 1 Primer sequences used for qPCR
1.4 数据统计学分析
使用SPSS 17.0软件进行数据分析,每组实验重复3 次,结果表示为平均值±标准差;空白对照组之间采用Student’st-test比较分析,多组之间比较采用单因素方差分析,P<0.05被认为差异显著,具有统计学意义。
2 结果与分析
2.1 冰岛刺参中缩醛磷脂和醚磷脂的纯度鉴定
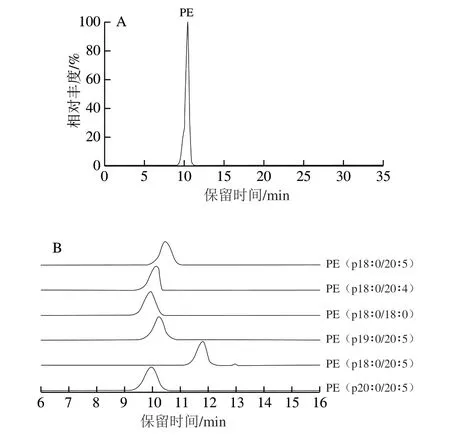
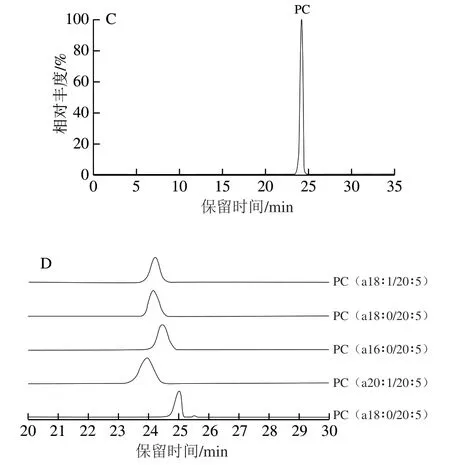
图 1 冰岛刺参中缩醛磷脂和醚磷脂的纯度鉴定Fig. 1 Purification and identification of pPE and aPC from Cucumaria frondosa
图1 A、C 分别为纯化后冰岛刺参P E 和P C 的总离子流图;图1B、D分别为pPE和aPC主要分子种类的提取离子流图。在负离子模式下,根据aPC产生的[M-CH3]-特征碎片与pPE产生的140.009 3[C2H7O4P]-和196.036 2[C5H11O5NP]-二级特征碎片离子,可以对其结构进行定性分析。计算得到纯化后冰岛刺参pPE和aPC纯度分别为91.0%和89.1%,其中,PE(p18∶0/20∶5)和PC(a18∶1/20∶5)分别为冰岛刺参提取PE和PC的主要分子种类,将其用于后续实验。
2.2 冰岛刺参pPE和aPC对PC12细胞存活率和分化率的作用
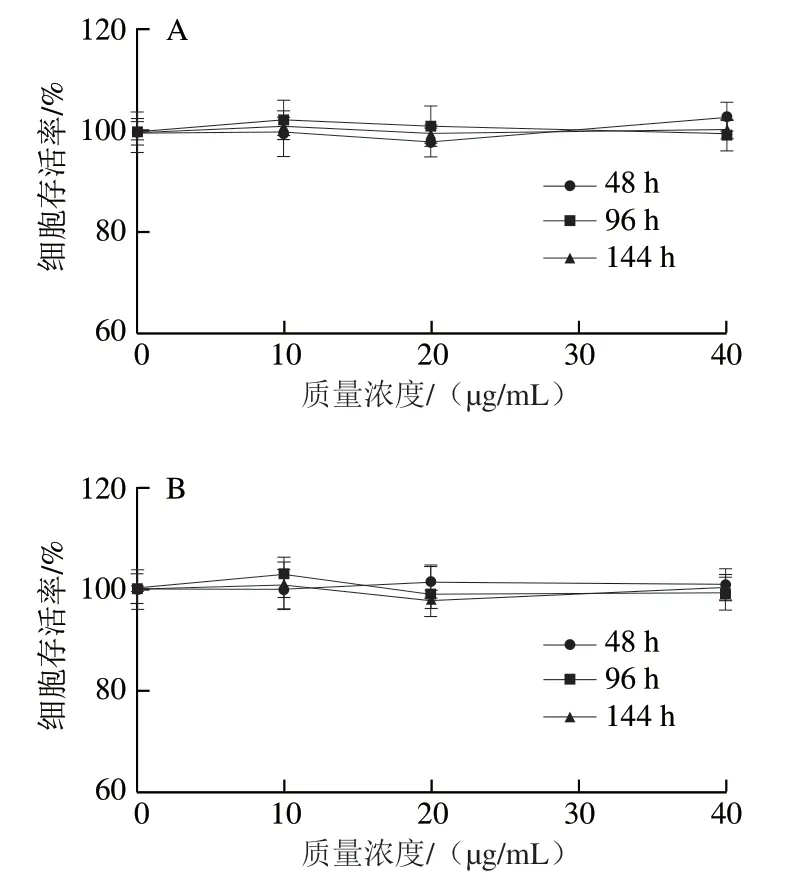
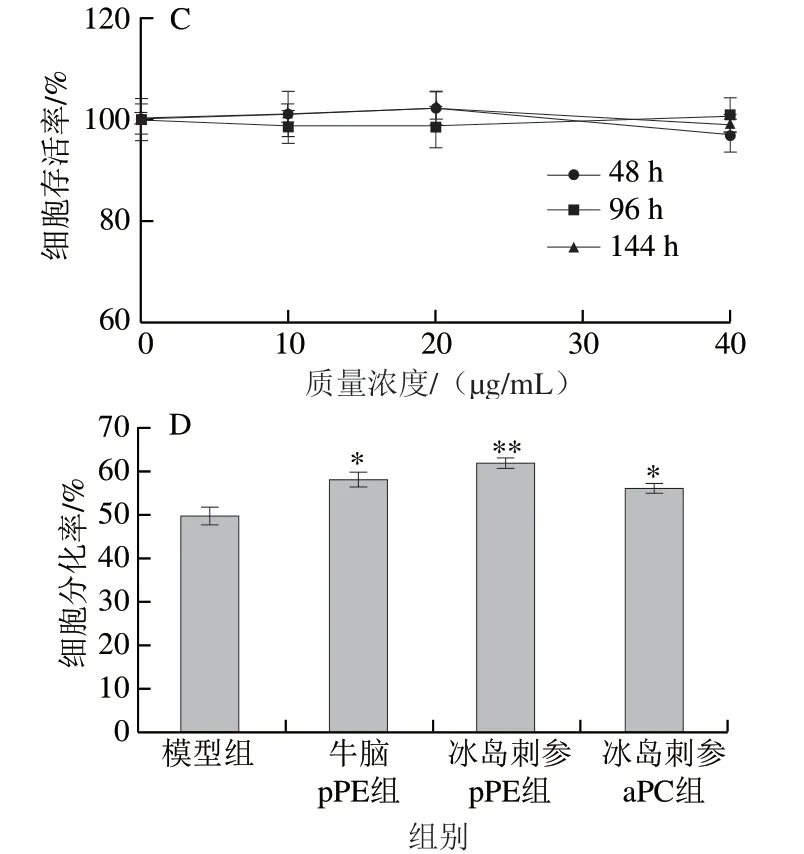
图 2 冰岛刺参pPE和aPC对PC12细胞活力和NGF诱导的细胞分化的影响Fig. 2 Effects of pPE and aPC on cell viability and NGF-induced differentiation of PC12 cells
为评价海洋源磷脂对PC12细胞的神经营养作用,首先应考察其对细胞的增殖或毒性效应,以确保后续实验过程不是由于磷脂本身的细胞毒性而引起细胞变化。MTT实验测定细胞存活率可用于评价细胞活性[21]。pPE在大脑和肾脏中特别丰富[22],牛脑可以作为提取pPE的良好来源,为对比海洋生物源缩醛磷脂与陆地动物源缩醛磷脂的效果差异,同时设置牛脑pPE组进行对照实验,结果如图2A~C所示。在质量浓度0~40 μg/mL下,牛脑pPE、冰岛刺参pPE和aPC对细胞存活率没有显著影响,说明这3 种磷脂在此质量浓度范围内对PC12细胞无明显细胞毒性,不影响细胞增殖,因此可用于后续实验。通过PC12细胞的分化率研究不同结构磷脂的神经营养作用,结果如图2D所示。3 种磷脂均具有促进细胞分化的作用;牛脑pPE、冰岛刺参pPE和冰岛刺参aPC组细胞分化率较模型组分别提高了10%、13%和8%,与模型组差异显著(P<0.05或P<0.01)。这表明相比于醚磷脂,缩醛磷脂提高PC12细胞分化率的效果可能更佳,并且冰岛刺参pPE较牛脑pPE对细胞分化的促进作用也更为明显。以上结果表明,海洋源缩醛磷脂促神经细胞分化的效果可能优于陆地源,但具体原因和差异机制尚不明确,需要进一步实验研究。
2.3 冰岛刺参pPE和aPC对PC12细胞轴突长度和数目的影响
通过向NGF诱导PC12细胞模型中添加外源性不同结构磷脂,观察磷脂对该神经样细胞轴突生长和分支形成作用,结果如图3所示。相比于模型组,冰岛刺参pPE组细胞轴突长度大于4的细胞比例极显著增多(P<0.01),且冰岛刺参pPE组具有更长轴突长度(4 倍胞体长度)的细胞比例相较于冰岛刺参aPC组更高(图3A)。此外,就轴突数目(图3B)而言,所有磷脂处理组中轴突数目为2的细胞比例均较模型组极显著提高(P<0.01);与模型组细胞相比,冰岛刺参pPE组轴突数目为3的细胞比例提高了8%(P<0.01),相比于牛脑pPE组与模型组的差异更为显著,而冰岛刺参aPC组轴突数目为3的细胞比例与模型组相比没有显著差异(P>0.05),说明冰岛刺参pPE比牛脑pPE能够更有效地促进突触的伸出,这与图2D中促细胞分化作用的结果一致,进一步佐证了冰岛刺参pPE在促神经分化方面的作用。
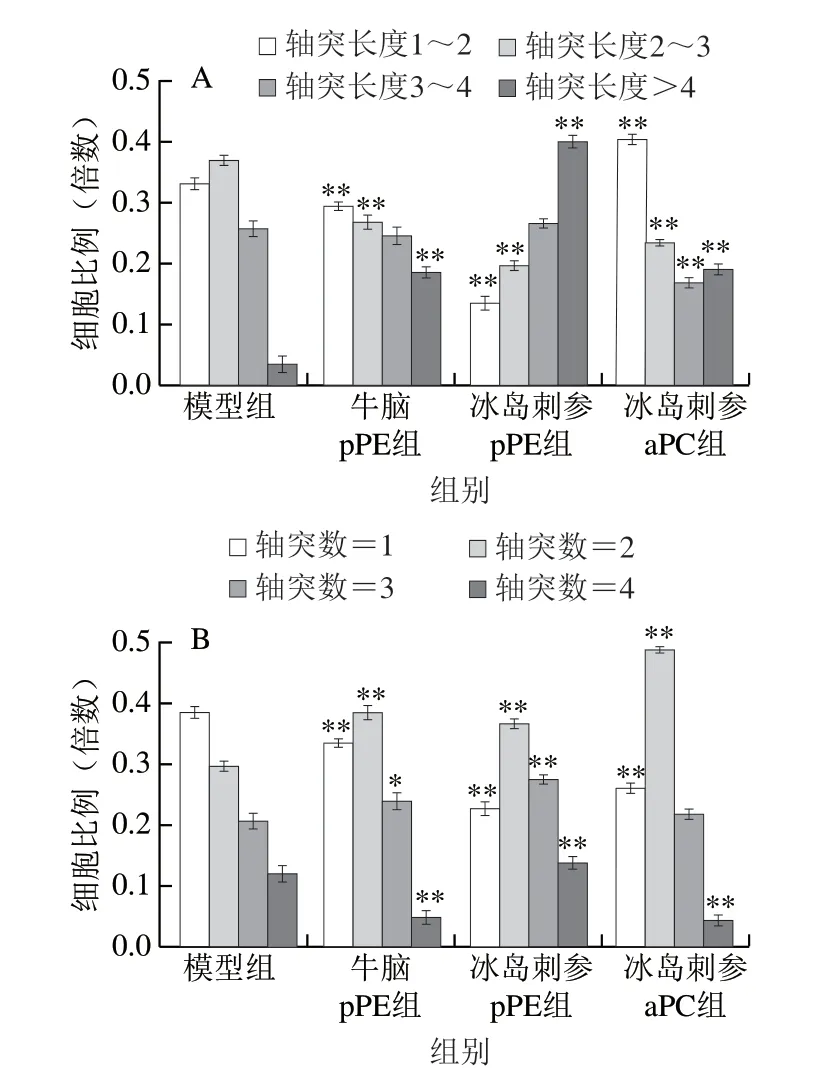
图 3 冰岛刺参pPE和aPC(40 μg/mL)对NGF诱导PC12细胞的轴突长度(A)和数目(B)的影响Fig. 3 Effects of pPE and aPC (40 μg/mL) on neurite length (A) and neurite number (B) in NGF-induced PC12 cells
2.4 免疫荧光法测定冰岛刺参pPE和aPC对SYN的影响
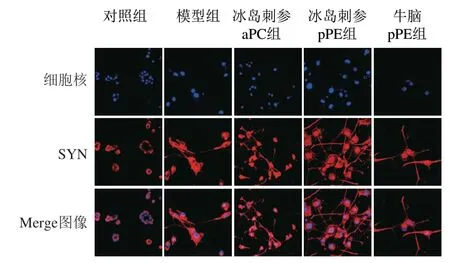
图 4 冰岛刺参pPE和aPC(40 μg/mL)孵育24 h后PC12细胞SYN免疫荧光染色Merge图(×40)Fig. 4 Effect of pPE and aPC (40 μg/mL) on synaptophysin in PC12 cells evaluated by immunofluorescence staining (× 40)
图4为添加不同海洋源磷脂处理孵育24 h后PC12细胞的分化情况,细胞核被DAPI染为蓝色,SYN被标记为红色,二者重叠后为Merge图。在40 倍物镜下观察到,常规培养对照组PC12细胞呈圆形且无轴突,SYN仅在胞体表达。经NGF诱导后模型组细胞长出轴突,而在40 μg/mL的牛脑pPE和冰岛刺参pPE作用下,不仅分化细胞数目变多,且SYN在胞体和轴突的表达更加显著,与模型组差异明显,冰岛刺参aPC的作用效果没有2 种pPE强。因此,SYN的免疫荧光染色结果进一步表明,冰岛刺参pPE促PC12细胞轴突生长的效果更佳,能更有效刺激神经的生长。
2.5 冰岛刺参pPE和aPC对syn和GAP-43表达的影响
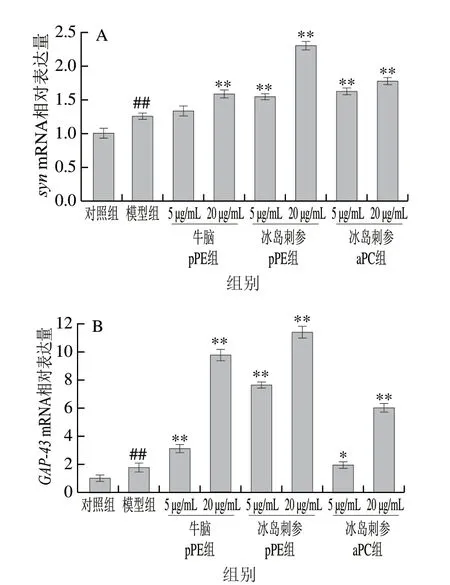
图 5 冰岛刺参pPE和aPC对NGF诱导PC12细胞syn(A)和GAP-43 mRNA相对表达量(B)的影响Fig. 5 Effect of pPE and aPC on mRNA expression of syn (A) and GAP-43 (B) in NGF-induced PC12 cells
SYN是突触囊泡的组成成分,GAP-43位于突触前膜上,二者均与突触的生长相关,在神经元生长延伸、突触囊泡形成等方面具有表征作用[23]。利用qPCR技术分析冰岛刺参pPE和aPC处理对PC12细胞中syn、GAP-43mRNA相对表达量的影响,结果如图5所示。在NGF诱导的PC12细胞分化模型组中,syn和GAP-43的mRNA相对表达量较对照组分别升高了25%和74%,差异极显著(P<0.01)。与模型组相比,除5 μg/mL冰岛刺参aPC组外,其余磷脂处理组均极显著提高了NGF诱导PC12细胞中syn和GAP-43的mRNA相对表达量(P<0.01),并呈现一定的剂量-效应关系;并且,pPE效果优于aPC,冰岛刺参pPE效果明显优于牛脑pPE,在质量浓度为20 μg/mL时尤为突出,此质量浓度下牛脑pPE和冰岛刺参pPE组GAP-43mRNA表达量较对照组分别提高了4.6 倍和5.5 倍。
3 讨 论
缩醛磷脂水平变化与阿尔茨海默症密切相关,患者脑内的缩醛磷脂水平显著降低,是阿尔茨海默症早期变化之一[24-26],但具体机制尚不清楚。外源性缩醛磷脂的神经活性对于减轻阿尔茨海默症病症已有报道[27],临床实验也证明口服缩醛磷脂能缓解轻度阿尔茨海默症患者的认知障碍[28]。
近几年,海洋活性脂质的作用逐渐受到关注。海参脑苷脂和海胆神经节苷脂具有抗氧化[9]和神经营养作用[20],富含二十碳五烯酸的磷脂可改善Aβ42、Aβ1-40诱导的认知缺陷[29-30]和1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导的帕金森症症状[31]。这些研究结果表明海洋活性脂质具有作为神经营养膳食补充剂的潜力。目前,关于外源性磷脂神经方面的活性研究主要集中在其对神经损伤的保护作用上,对海洋源磷脂在促神经分化方面的确切作用或功能鲜见报道,探究海洋源不同结构磷脂的促分化效果十分必要。
鉴于此,本实验通过柱层析法制备获得冰岛刺参pPE和aPC,并与牛脑pPE对比,研究冰岛刺参pPE和aPC对PC12细胞神经生长的活性。采用NGF诱导建立PC12细胞分化模型,结果表明,牛脑pPE、冰岛刺参pPE和冰岛刺参aPC在一定质量浓度下均可显著提高PC12细胞的分化率,显著延长轴突长度、增加轴突数目。通过免疫荧光分析直接观察pPE促神经分化效果,进一步从分子水平上测定syn和GAP-43的mRNA表达量,结果表明,pPE与aPC均能增加syn和GAP-43基因表达,且呈剂量-效应关系。pPE和aPC表现出显著促进神经生长效果时所需剂量较海参脑苷脂更低[18]。总体分析,一方面,缩醛磷脂效果优于醚磷脂,这种效果差异可能依赖于结构的差异,推测可能与缩醛磷脂具有不同于醚磷脂的烯醚键结构有关[32],pPE的烯醚键具有更强的自由基清除能力,从而更好地保护细胞[33];另一方面,冰岛刺参pPE具有较牛脑pPE更好的促神经分化作用,推测海洋源缩醛磷脂在促神经分化方面比陆地源缩醛磷脂有更大的潜力。
综上所述,冰岛刺参缩醛磷脂具有显著促进PC12细胞分化的作用,有望成为促进神经生长的功能性食品原料。但其具体促生长机制和通路尚不明确,需要后续实验进一步研究。
