胎牛血清与矢车菊素-3-葡萄糖苷非共价相互作用机制及对其抗氧化活性的影响
2021-03-31麦绮莹范亚苇邓泽元
麦绮莹,范亚苇,邓泽元,张 兵
(1.南昌大学食品学院,江西 南昌 330047;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
花青素又称花色素,是一类广泛存在于植物中的水溶性天然色素,属于类黄酮化合物,多以糖苷的形式存在。矢车菊素-3-葡萄糖苷(cyanidin-3-glucoside,C3G)是食品中分布最广泛的花青素。C3G能够表现出自由基清除活性[1],具有抗炎[2]、抗癌[3]、预防肥胖[4]、改善高血糖症[5]和预防心血管疾病[6]等功效。C3G的生物活性取决于其生物利用度,且与其稳定性和存在环境息息相关。关于花青素生物活性和生物利用度的研究通常采用体外细胞实验和动物实验。体外细胞培养中,花青素单体或富含花青素的提取物通常在各种细胞模型中孵育几个小时或者长达几天。然而,花青素稳定性差,易受温度、光照、pH值等环境因素影响而降解[7],从而影响实验结果的准确性。但目前为止,大多数采用细胞模型研究花青素生物活性的报道常会忽略这些影响;此外,已有研究发现单个化合物可能会在细胞中进行局部代谢,或者在细胞培养条件下,化学稳定性可能会有所变化[8]。因此,研究细胞培养基中的主要成分——胎牛血清(fetal bovine serum,FBS)对花青素稳定性的影响有重要的意义。
FBS是细胞和组织培养基的通用生长补充剂。血清是一种天然复合物,含有1 800多种蛋白质和4 000多种代谢产物[9],其中牛血清白蛋白是FBS中的主要蛋白质。目前大部分的研究表明,多酚类化合物与各种蛋白质(如牛血清白蛋白[10]、大豆分离蛋白[11]、β-乳球蛋白[12]等)存在相互作用,从而影响蛋白质的构象;此外,它们的相互作用还会提高多酚类化合物的稳定性,保持其抗氧化性,起到保护作用。已有研究表明,FBS能与21 种白藜芦醇类似物相互作用,且其相互作用与白藜芦醇类似物和牛血清白蛋白之间的亲和力存在正相关关系,FBS还会掩盖白藜芦醇类似物的抗氧化活性[13]。因此,本实验研究C3G在不同细胞培养条件下的稳定性,同时探究FBS与C3G在细胞培养条件下的相互作用机制及对其抗氧化活性的影响。
1 材料与方法
1.1 材料与试剂
C3G和原儿茶酸(protocatechuic acid,PCA)(纯度均大于98%)北京索莱宝科技有限公司;间苯三酚醛(phloroglucinaldehyde,PGA)(纯度大于95%)山东西亚化学工业有限公司;2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ehylbenzthiazoline-6-solfonic acid) diammonium salt,ABTS)、2,4,6-三吡啶基三嗪(tripyridyltriazine,TPTZ)上海阿拉丁生化科技股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)成都西亚化工股份有限公司;RPMI 1640培养基、FBS以色列Biological Industries公司;磷酸盐缓冲液(phosphate buffered saline,PBS)北京中杉金桥生物技术有限公司;乙腈(色谱级)德国默克色谱试剂公司;甲酸(色谱级)美国Acros公司;甲醇、乙醇、盐酸、冰醋酸、三水醋酸钠、二甲基亚砜(dimethyl sulfoxide,DMSO)和FeCl3·6H2O西陇科学股份有限公司。
1.2 仪器与设备
GPST200型CO2恒温培养箱长沙长锦科技有限公司;JY-86-2-50型-80 ℃冰箱香港力康发展有限公司;LG J-15D冷冻干燥机北京四环仪器有限公司;AL104型电子天平瑞士梅特勒-托利多仪器公司;BioTek酶标仪美国伯腾仪器有限公司;1260型超高效液相色谱仪美国Agilent公司;F-7000型荧光分光光度计日本日立公司;Nicolet iS50傅里叶变换红外光谱仪美国赛默飞世尔科技有限公司;MOS 450圆二色光谱仪法国Bio Logic公司。
1.3 方法
1.3.1 C3G在细胞培养基中的稳定性和降解模型构建
C3G在细胞培养基中稳定性测定:将C3G溶解在DMSO溶液中,以获得0.2 mol/L的C3G标准储备液。用RPMI 1640培养基和含体积分数10% FBS的RPMI 1640培养基(RPMI+10% FBS)分别将C3G的标准储备液稀释至1×10-4mol/L,置于37 ℃、5% CO2的培养箱中孵育。分别在0、0.5、1、2、4、6、8、10 h和12 h时取出1 mL样品,并立即用色谱级甲酸调pH值至2.0,置于-80 ℃冰箱备用。
C3G相对含量和PGA浓度的测定:采用超高压高效液相色谱法,使用ZORBAX Eclipse Plus C18色谱柱(3.0 mm×100 mm,1.8 μm),流动相为0.1%甲酸-水溶液(A)和0.1%甲酸-乙腈溶液(B),梯度洗脱程序为:0~4 min,10%~17% B;4~7 min,17%~35% B;7~8 min,35%~100% B;8~10 min,100%~10% B。进样量1 0 μ L、柱温3 0 ℃、流速0.3 m L/m i n、检测波长为280 nm和520 nm。
C3G降解动力学模型的构建:参照龚辉等[14]的方法,釆用试错法构建降解动力学模型,具体原理是:假设动力学级数为零、一、二、三级,则反应物质量浓度ρ、反应物质量浓度的对数lnρ、反应物质量浓度的倒数1/ρ和反应物质量浓度的倒数平方1/ρ2与时间t呈线性关系,其中相应线性回归系数最高的模型为C3G降解动力学模型。
1.3.2 荧光光谱测定
使用荧光猝灭法测定C3G与蛋白质的非共价结合能力。用0.1 mol/L PBS制备体积分数0.25% FBS工作溶液,准确移取2.0 mL工作溶液于石英荧光池中,在不同温度(298、304、310 K)条件下测定连续添加2 μL C3G溶液(5×10-3mol/L)后,该样品在波长300~500 nm区间内的荧光发射光谱,并测定样品在298 K温度下在波长250~350 nm区间内Δλ=15、60 nm的同步荧光光谱。其中,激发波长280 nm、激发狭缝2.5 nm、发射狭缝2.5 nm。
1.3.3 傅里叶变换红外光谱测定
将FBS和含有5×10-5mol/L C3G的混合溶液分别于冷冻干燥机中冻干。然后将冻干的粉末与KBr以1∶150的质量比混合,压制成片剂后进行傅里叶变换红外光谱测定。扫描波长范围4 000~400 cm-1,扫描次数32,分辨率8 cm-1。
1.3.4 圆二色光谱测定
使用分光旋光仪在远紫外线区域(190~240 nm)测定样品的圆二色光谱。用PBS(pH 7.4)配制体积分数0.25% FBS工作溶液,其蛋白质量浓度为0.103 mg/mL,用此工作溶液配制C3G浓度为5×10-5mol/L的样品液,将样品液和体积分数0.25% FBS工作溶液在光程为0.1 cm的石英比色皿中进行测定。扫描速率60 nm/min、光谱分辨率0.2 nm、响应间隔0.25 s、带宽1.0 nm。
1.3.5 抗氧化性测定
1.3.5.1 ABTS阳离子自由基清除率测定
参照Peng Han等[15]的方法测定ABTS阳离子自由基清除能力。将5 mL ABTS储备液(7.0×10-3mol/L)与88 μL K2S2O8(0.14 mol/L)混匀,室温黑暗条件下静置12~16 h,得到实验用ABTS储备液。使用时,用体积分数80%乙醇溶液将吸光度调至0.70±0.05,然后于96 孔板中分别加入20 μL样品溶液和200 μL ABTS溶液,振荡混匀6 min,在734 nm波长处测定吸光度。ABTS阳离子自由基清除率按公式(1)计算。
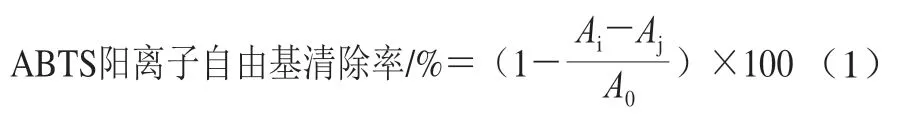
式中:A0为样品溶剂和ABTS溶液混合液的吸光度;Ai为样品溶液和ABTS溶液混合液的吸光度;Aj为样品溶液和体积分数80%乙醇混合液的吸光度。
1.3.5.2 DPPH自由基清除率测定
参照Li Hongyan等[16]的方法测定DPPH自由基清除能力。称取一定量的DPPH溶解于甲醇溶液中,避光静置30 min配制成1.0×10-4mol/L DPPH储备液,用无水甲醇将吸光度调至0.70±0.05,然后于96 孔板中分别加入20 μL样品溶液和100 μL DPPH溶液,室温下避光振荡混匀30 min,在517 nm波长处测定吸光度。DPPH自由基清除率按公式(2)计算。
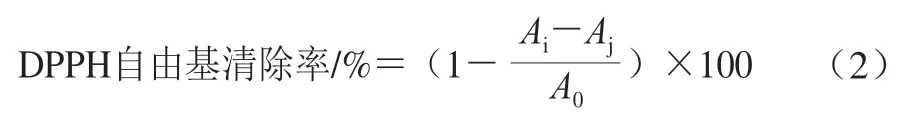
式中:A0为样品溶剂和DPPH溶液混合液的吸光度;Ai为样品溶液和DPPH溶液混合液的吸光度;Aj为样品溶液和无水甲醇混合液的吸光度。
1.3.5.3 总还原能力测定
参照铁离子还原能力(ferric reducing ability of plasma,FRAP)试剂盒法测定总还原能力:0.3 mol/L醋酸钠缓冲溶液、2.0×10-2mol/L三氯化铁溶液和1.0×10-2mol/L TPTZ溶液按10∶1∶1的体积比进行混合,配制成FRAP工作液。将10 μL样品与300 μL FRAP工作液混合,室温下反应4 min,并在593 nm波长处测定吸光度。
1.4 数据处理与分析
采用Origin 8软件和GraphPad Prism 6软件绘制图表。实验数据采用SPSS统计软件的单因素方差分析法和Duncan多重比较法进行统计学分析,P<0.05表示差异显著。
2 结果与分析
2.1 C3G在细胞培养基中的稳定性
经过对比标准品的保留时间,可知图1A、B中的峰1为PCA,峰2为C3G,峰3为PGA。随着培养时间的延长,C3G的峰高和峰面积都有所下降,且有新的峰(峰1、3)产生,表明C3G的含量随培养时间的延长而降低,且C3G会降解成PCA和PGA,这与de Ferrars等[17]的研究结果相一致。图2A、B分别为C3G相对含量和其降解产物PGA浓度在0~12 h中的变化情况。C3G在RPMI+10% FBS中孵育12 h后,相对含量仅为0 h时的73.78%,而其降解产物PGA的浓度为2.50×10-6mol/L,在RPMI中孵育12 h后,C3G的相对含量为0 h时的54.97%,PGA的浓度为3.14×10-6mol/L。结果显示,C3G在含有体积分数10% FBS的RPMI培养基中比RPMI培养基中稳定,表明FBS使C3G更加稳定,其原因可能是C3G与FBS中的蛋白大分子相互作用,形成非共价化合物,从而提高了C3G的稳定性。Xiao Jianbo等[8]的研究也发现多酚在细胞培养基中的稳定性不同于在有机溶剂中的稳定性,多酚在细胞培养基中稳定性因素包括初始浓度、温度、蛋白质浓度以及pH值,而其在有机溶剂中的稳定性主要取决于初始浓度和温度。He Zhiyong等[12]研究发现锦葵素-3-葡萄糖苷能与β-乳球蛋白非共价结合,Tang Lin等[18]研究发现C3G能与血清白蛋白、血红蛋白和肌红蛋白非共价结合。这些研究结果都表明C3G能通过与蛋白质相互作用影响自身的稳定性。
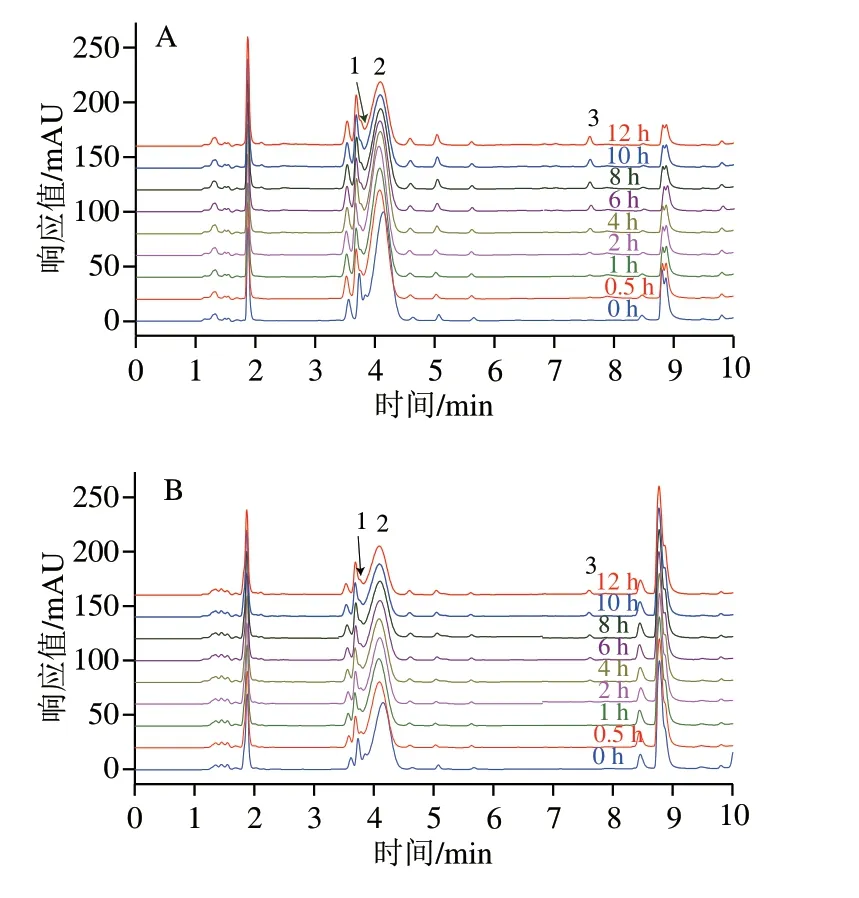
图 1 280 nm波长处C3G在不同细胞培养条件下孵育不同时间的超高效液相色谱图Fig. 1 UPLC of C3G at 280 nm at different incubation times under different cell culture conditions
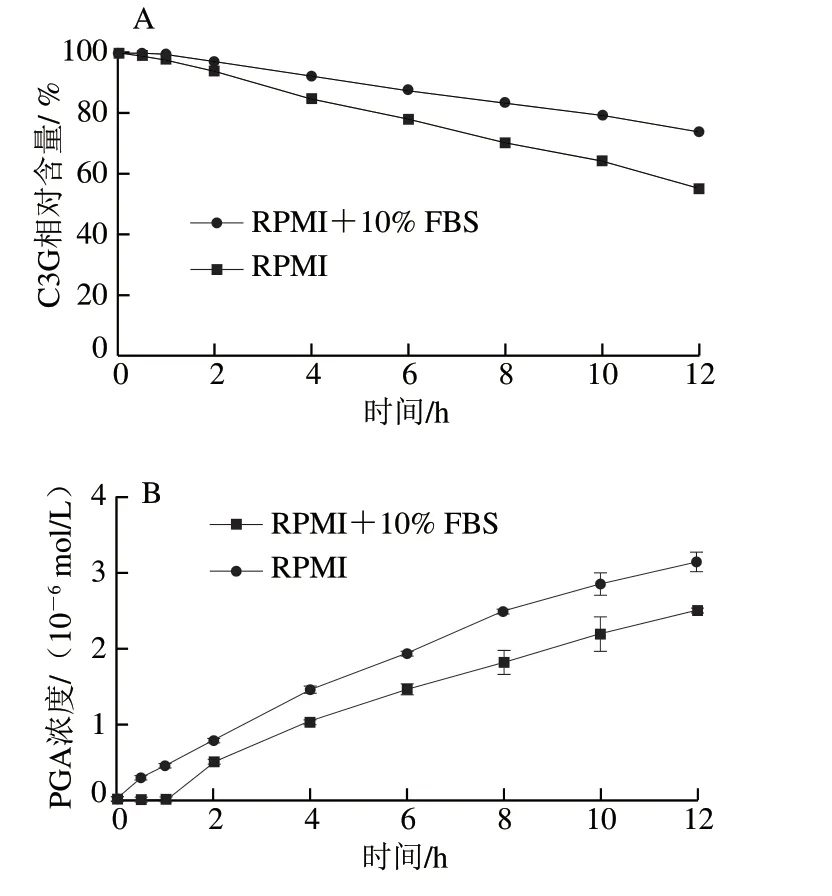
图 2 不同细胞培养条件下C3G相对含量(A)及其主要代谢物PGA浓度(B)的变化Fig. 2 Changes in concentrations of C3G (A) and its major metabolite PGA (B) under different cell culture conditions
2.2 C3G降解动力学分析结果
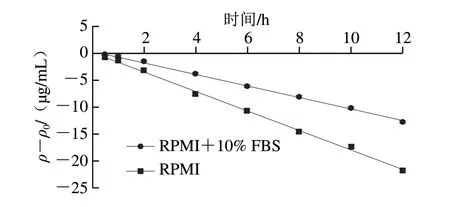
图 3 C3G降解动力学分析Fig. 3 Kinetic analysis of C3G degradation

表 1 C3G降解动力学拟合方程的线性回归系数Table 1 Fitting equations of C3G degradation kinetics with correlation coefficients

表 2 C3G零级模型降解动力学参数Table 2 Zero-order kinetic parameters of C3G degradation
图3为C3G在不同培养条件下的降解动力学模型,根据试错法计算出C3G质量浓度ρ、lnρ、1/ρ、1/ρ2与时间t的相关系数,线性相关系数最大对应的模型为其降解动力学模型。由表1可知,C3G在RPMI+10% FBS和RPMI中的降解模型均符合零级动力学模型。目前研究表明,花青素在不同条件下的降解动力学模型主要可分为零、一、二级和复杂反应动力学[19]。龚辉等[14]研究发现飞燕草素-3-葡萄糖苷、C3G、天竺葵素-3-葡萄糖苷、锦葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷的超声降解均符合零级动力学模型。黑果枸杞[20]和石榴汁[21]的花青素热降解及紫甘薯[22]中的花青素在不同储存溶液中的降解均符合一级反应动力学模型。Contreras-Lopez等[23]研究发现黑莓花青素的光降解符合二级反应动力学模型。以上研究表明,花青素的降解动力学模型与所处条件有关,而本实验发现C3G在细胞培养条件下的降解符合零级动力学模型,这可能与RPMI培养基的复杂成分有关。由表2可知,在零级动力学模型下,C3G在RPMI+10% FBS和RPMI中的反应速率常数k分别为1.089 2 μg/(mL·h)和1.830 7 μg/(mL·h),其早期降解时间和半期降解时间分别为4.97 h和22.85 h,而在RPMI中分别为2.84 h和13.43 h,以上结果表明,FBS能够提高C3G在细胞培养中的稳定性。
2.3 C3G对FBS的荧光猝灭作用及机理
FBS中含有多种蛋白质,其中牛血清白蛋白的含量最为丰富,而牛血清白蛋白因含有色氨酸、酪氨酸和苯丙氨酸等氨基酸残基而具有较强的内源荧光。图4为298 K下不同浓度C3G对FBS的荧光猝灭光谱,结果显示,随C3G浓度的增加,FBS在344 nm波长处的最大荧光发射峰强度有规律地降低,表明C3G与FBS的相互作用使内源荧光猝灭,并且该猝灭作用具有浓度依赖性。但是C3G对FBS的最大荧光发射波长没有影响,说明C3G并未改变色氨酸残基微环境的极性。
荧光猝灭可以是动态猝灭,也可以是静态猝灭。其中,动态猝灭由荧光团和猝灭剂的碰撞引起,静态猝灭由荧光团和猝灭剂之间形成基态不发光的复合物引起,两者都遵循Stern-Volmer方程,即F0/F=1+Kqτ0[Q]=1+KSV[Q],式中:F0和F分别为C3G不存在与存在时的荧光强度;Kq为生物大分子的猝灭速率常数/(L/(mol·s));τ0为不存在C3G时的荧光寿命,生物大分子的荧光寿命约为10-8s;KSV为Stern-Volmer方程的猝灭常数/(L/mol);[Q]为C3G的浓度/(mol/L)。图5为不同温度下F0/F-[Q]关系图,可以看出FBS在不同温度下的Stern-Volmer曲线都具有良好的线性相关性。由表3可知,FBS在不同温度下的Kq数量级均为1012,远大于各类猝灭剂对生物大分子的最大扩散碰撞猝灭速率常数2×1010L/(mol·s),表明对FBS的荧光猝灭过程是以静态猝灭为主。静态猝灭过程随温度升高可能会引起配合物的稳定性下降,导致猝灭常数随之减小[24],由本实验结果可知,猝灭常数KSV随温度的升高而逐渐减小,进一步说明其猝灭过程是以静态猝灭为主。Tang Lin等[25]研究发现C3G对牛血清白蛋白的荧光猝灭是静态猝灭,与本实验结果相一致。
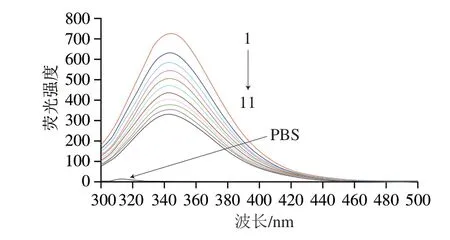
图 4 不同浓度C3G对FBS荧光光谱的影响Fig. 4 Effect of C3G concentrations on fluorescence spectrum of fetal bovine serum
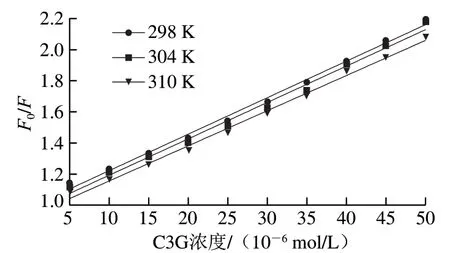
图 5 不同温度下C3G对FBS荧光猝灭的Stern-Volmer图Fig. 5 Stern-Volmer plots for fluorescence quenching of fetal bovineserum by C3G at different temperatures
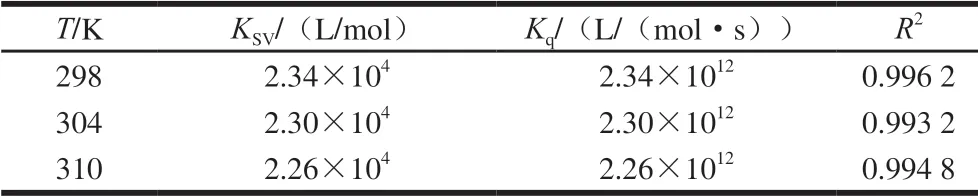
表 3 C3G和FBS相互作用的Stern-Volmer常数Table 3 Stern-Volmer constants for interaction between C3G and fetal bovine serum
2.4 C3G与FBS结合反应的结合常数、结合位点和热力学参数
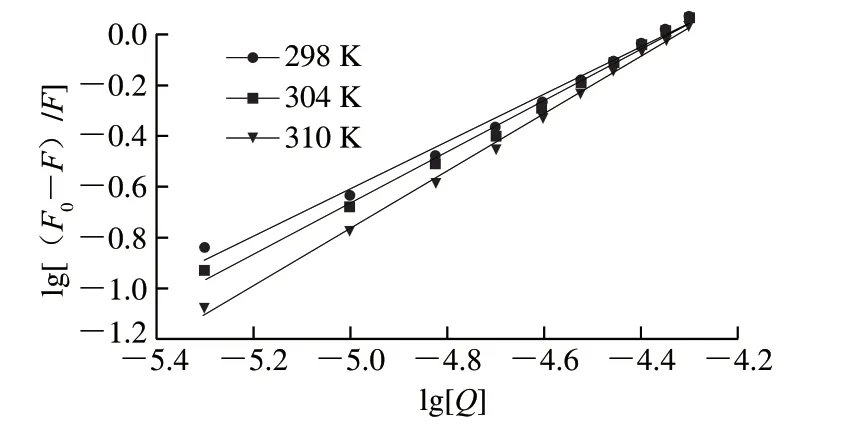
图 6 不同温度下C3G对FBS荧光猝灭的双对数曲线Fig. 6 Plots of lg[(F0-F)/F] against lg[Q] derived from the quenching of fetal bovine serum by C3G at different temperatures
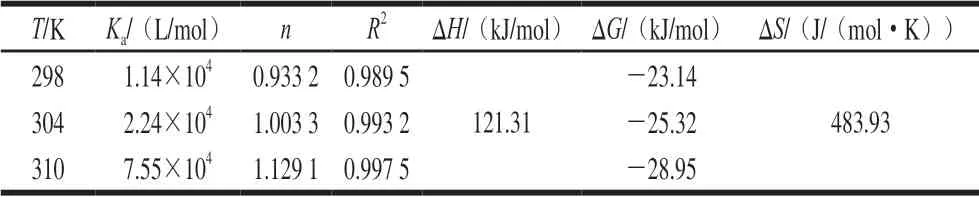
表 4 C3G和FBS的结合常数、结合位点及其热力学参数Table 4 Biding constant, binding site number and thermodynamic parameters for interaction between C3G and fetal bovine serum
对于静态猝灭,可由双对数公式求出其结合反应的表观结合常数Ka与结合位点数n:lg[(F0-F)/F]=lgKa+nlg[Q],式中:Ka为C3G与FBS相互作用的结合常数,n为每个蛋白质的结合位点数。图6为lg[(F0-F)/F]-lg[Q]关系图,可根据其直线斜率算出C3G和FBS的结合位点数n,根据截距算出lgKa。由表4可知,C3G和FBS的结合常数Ka随温度的升高而增大,表明其结合能力随温度的升高而加强,并且该结合过程是吸热过程,而在不同温度下,其结合位点数均接近1,表明C3G在FBS上仅存在一个结合位点,形成1∶1的结合物,且两者间存在较强的结合力。
药物等小分子与蛋白等生物大分子之间的相互作用力主要有氢键、范德华力、疏水作用力和静电引力4 种,可通过热力学方程lnKa=-ΔH/RT+ΔS/R、ΔG=ΔHTΔS=-RTlnKa算出C3G和FBS相互作用的热力学参数,式中:Ka为C3G与FBS相互作用的结合常数;ΔH为焓变;ΔS为熵变;ΔG为吉布斯自由能变;R为气体常数,R=8.314(J/(mol·K));T为温度。Ross等[26]总结得出:如果ΔH>0、ΔS<0,则静电引力和疏水作用力是主要力;如果ΔH>0、ΔS>0,则疏水作用力是主要的结合力;如果ΔH<0、ΔS<0,则范德华力或氢键可能在结合过程中起主要作用;如果ΔH<0、ΔS>0,则主要作用力是静电引力。由表4可知,ΔG<0,表明该反应是一个自由能降低的自发进行的过程,而ΔH和ΔS均大于0,说明C3G和FBS相互作用时,是熵驱动的吸热反应,且疏水作用力是该反应的主要驱动力。
2.5 C3G对FBS构象的影响
同步荧光法与常用荧光测定方法最大的区别是激发和发射两个单色器波长是同时扫描的,由测得的荧光强度信号与对应的激发波长(或发射波长)构成光谱图,称为同步荧光光谱。同步荧光法具有简化光谱、窄化谱带和减小光谱重叠等优点,且可以反映蛋白质中发光基团所处微环境的极性和疏水性变化情况,故被常用来探讨小分子药物对大分子蛋白质构象的影响[27]。Δλ在15 nm和60 nm波长处,荧光光谱分别提供了酪氨酸和色氨酸残基的特征信息。由图7可知,随着C3G浓度的增加,Δλ在15 nm和60 nm波长处的最大荧光发射峰强度不断降低,但是波长没有发生明显的变化,表明C3G与FBS的相互作用并没有明显改变酪氨酸和色氨酸残基的微环境及其构象,与吸收光谱的结论一致。
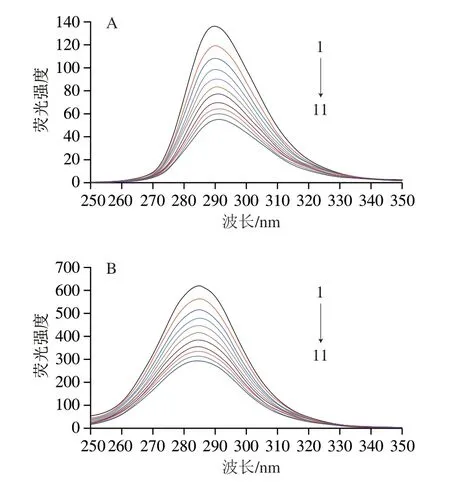
图 7 FBS在Δλ为15(A)、60 nm(B)波长处的同步荧光光谱Fig. 7 Synchronous fluorescence spectra of fetal bovine serum at Δλ of 15 (A) and 60 nm (B)
2.6 C3G对FBS二级结构的影响
傅里叶变换红外光谱具有检测氢键变化的功能,且十分灵敏,因而经常被用来检测小分子作用对蛋白质二级结构的影响。酰氨吸收带因蛋白质在不同波数范围内的吸收峰及出峰原因主要分为I、II带和III带。其中,酰氨I带(1 700~1 600 cm-1)是氨基酸残基的C=O伸缩振动引起;酰氨II带(1 600~1 500 cm-1)是由C—N伸缩振动和N—H面内变形振动共同造成的;酰氨III带(1 240~1 230 cm-1)的吸收强度最弱,主要源于C—N伸缩振动和N—H面内变形振动[28]。这3 个酰氨吸收带对蛋白质结构变化的敏感程度依次递减。血清白蛋白的二级结构主要依赖于肽链中的C=O和酰氨上N—H之间形成的氢键,且酰氨I带对其结构变化最灵敏,因此,酰胺I带常被作为衡量血清白蛋白二级结构变化的标尺。由图8可知,与游离的FBS相比,加入C3G后酰氨I带峰位从1 653.32 cm-1移至1 652.12 cm-1,表明C3G可能结合到FBS亚域的C=O基团上,使多肽链氢键发生了重排,最终引起二级结构的变化。
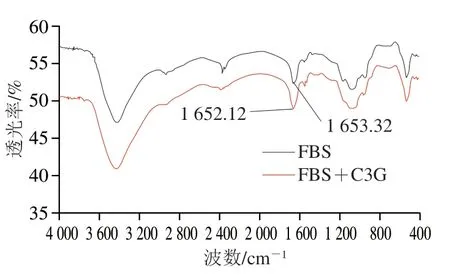
图 8 FBS的傅里叶变换红外光谱Fig. 8 FTIR spectra of fetal bovine serum
圆二色光谱是检测蛋白质二级结构变化的一种非常灵敏的方法。圆二色光谱一般可分为远紫外区光谱(178~250 nm)和近紫外区光谱(250~320 nm)。不同蛋白质具有不同的二级结构,其光学活性对左右圆偏振光的吸收不同,因此,产生谱带的位置、吸收的强弱都不相同,利用此性质可对物质的结构进行解析[29]。由表5可知,C3G会使FBS中蛋白质的α-螺旋、β-转角和无规卷曲相对含量减少,而β-折叠相对含量增加,这可能是α-螺旋、β-转角和无规卷曲结构部分变为β-折叠结构,表明C3G与FBS的相互作用会降低FBS中α-螺旋相对含量,使蛋白质结构变得更加疏松,与张冬[30]的研究结果一致。总地来说,C3G会减少FBS的α-螺旋相对含量,使其肽链舒张,从而改变其二级结构。

表 5 FBS的二级结构分析Table 5 CD spectroscopic analysis of secondary structures in fetal bovine serum
2.7 FBS对C3G抗氧化活性的影响
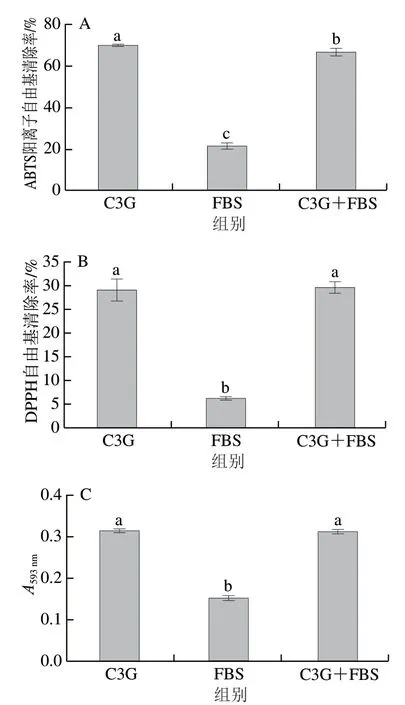
图 9 C3G的抗氧化活性Fig. 9 Antioxidant activity of C3G
由图9可知,FBS会使C3G的ABTS阳离子自由基清除率显著降低(P<0.05),而FBS对DPPH自由基清除率和FRAP结果均无显著性影响,表明其与C3G的相互作用会屏蔽其ABTS阳离子自由基清除能力。Kanakis等[31]研究发现β-乳球蛋白与茶多酚形成的复合物能降低溶液中羟基的数目,影响茶多酚的供电子能力和抗氧化活性。周瑞等[32]研究也发现花青素与牛血清白蛋白发生相互作用时,花青素中的羟基参与了氢键的形成,从而屏蔽了花青素的羟基,降低了其清除自由基的能力。说明C3G和FBS的相互作用会影响其羟基的数目和功能,从而影响抗氧化活性。
3 结 论
细胞培养条件下,C3G在含10% FBS的RPMI培养基中比在RPMI培养基中更稳定,其降解产物都为PCA和PGA,且在这两种溶液中的降解动力学模型都为零级动力学。此外,本实验发现C3G会使FBS的内源荧光发生猝灭,且具有浓度依赖性,证实了这两者之间存在相互作用,且该相互作用增强了C3G的稳定性。两者的作用机理为静态猝灭,作用力类型主要为疏水作用力。C3G和FBS的相互作用对色氨酸和酪氨酸残基微环境构象的影响不大,但是会降低α-螺旋的相对含量,增加β-折叠的相对含量,从而改变FBS中蛋白的二级结构,使其肽链舒张,结构变松散。而FBS对C3G的DPPH自由基清除能力和FRAP没有明显影响,但会显著降低其ABTS阳离子自由基清除能力。
