乙酰柠檬酸三丁酯合成反应的热力学分析
2021-03-29钱文珍刘宝勇李洪光
王 伟,钱文珍,刘宝勇,李洪光
(1.兰州交通大学 化学与生物工程学院,甘肃 兰州730070;2.山东大学 化学与化工学院,胶体与界面化学教育部重点实验室,山东 济南 250100)
0 引言
塑料加工过程中需要加入各种添加剂来提升其工艺性能和加工效率,改进制品性能、价值及寿命[1]。其中增塑剂是必不可少的一种添加剂,用来增加聚合物的可塑性,同时不影响其本质特性。目前,塑料工业中使用的增塑剂主要是邻苯二甲酸酯类[2],综合性能良好,挥发性小。但是,邻苯二甲酸酯类化合物具有雌激素效应,长期接触可对人类和动物的行为和生殖能力产生不良影响,部分种类甚至具有潜在的致癌、致畸和致突变效应[3]。而柠檬酸酯类是一类新型环保增塑剂,无毒无味,可替代邻苯二甲酸酯类传统增塑剂,如柠檬酸三丁酯(TBC)、乙酰柠檬酸三丁酯(ATBC)、柠檬酸三辛酯(TOC)等[4]。其中,TBC具有无毒、无气味、抗霉、塑化效果好等优点[5],ATBC是将TBC乙酰化后衍生出的新型无毒环保增塑剂,在继承了TBC的一系列优良性能的同时由于封闭了羟基而引入支链,与用线性增塑剂增塑的体系相比,使用支化聚合物增塑剂将增加体系的流动性,同时与低摩尔质量增塑剂相比,支化聚合物的高摩尔质量和蓬松度显著降低了其挥发性和扩散性[6]。而且,ATBC比TBC毒性更小[7]。因此,TBC和ATBC都是邻苯类增塑剂的最佳替代品。
热力学数据是化学反应过程分析、工艺放大优化和工程设计的必需基础数据。基团贡献法是估算化合物物理化学性质的一种准确性高、适用范围广、计算过程简便、通用性强的经典热力学方法。张继龙等[8]采用基团贡献法对酯交换反应制备油酸甲酯进行了热力学数据估算并进行了反应热力学分析;王琳琳等[9]利用基团贡献法对枞酸与甲醇直接酯化反应进行了热力学数据估算并进行了反应热力学分析;付丽丽等[10]通过基团贡献法对油酸甲酯合成反应进行了热力学数据估算并进行了反应热力学分析。但是,利用基团贡献法对TBC和ATBC合成反应的热力学数据估算和分析相关报道较少,杨浩等[11]基于反应体系为气相对CA与NBA合成TBC进行了热力学数据估算和分析;林金清[12]等人对TBC合成以分水和不分水两种情况分别进行了热力学数据估算和分析。针对实际液相反应过程,本文进行了常压下液相反应直接酯化合成TBC和乙酰化合成ATBC的热力学数据估算和分析,为TBC和ATBC合成过程开发提供基础数据。
1 计算内容与过程分析
1.1 反应方程式
NBA和CA直接酯化反应生成TBC,化学反应方程式如
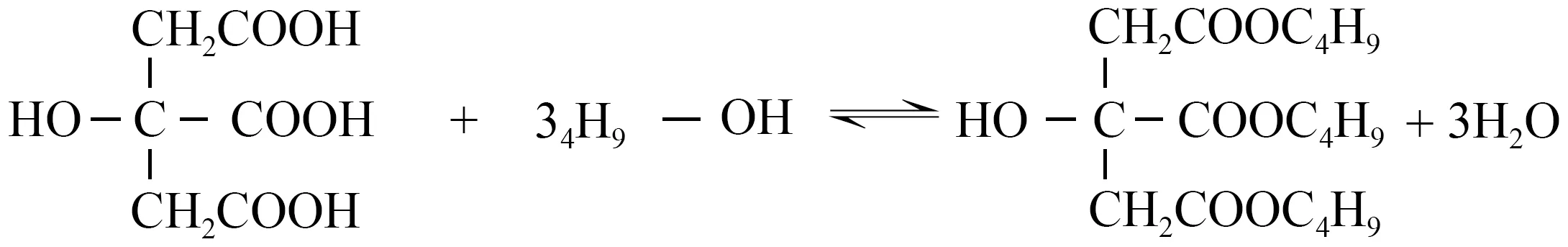
。
TBC与AR乙酰化反应生成ATBC,化学反应方程式如
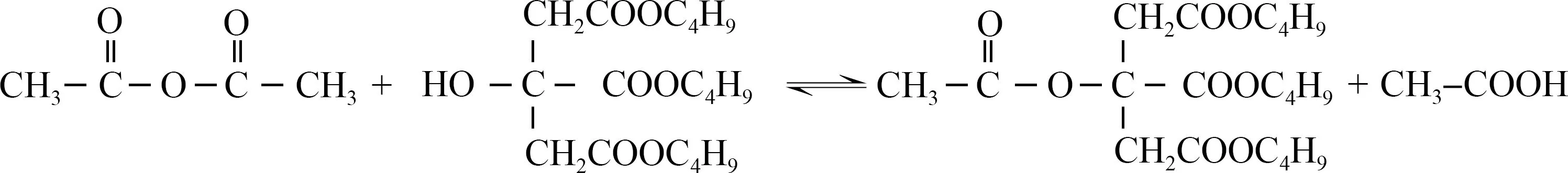
。
1.2 计算路径设计
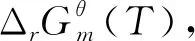
(1)
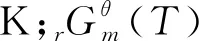
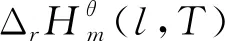
(2)
(3)
(4)
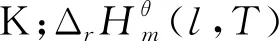

图1 计算路径设计图
标准态下在383-433 K[2,14,15]范围内,NBA与CA直接酯化合成TBC的过程是一个液相过程[12];标准态下在333-363 K[16,17]范围内,TBC乙酰化反应体系中的各物质(除水外,水已与夹带剂以气相形式除去)都是液态,所以乙酰化反应也是在液相中完成的。液相反应体系的热力学分析需要反应体系中各物质液态时不同温度下的热力学性质,而这些热力学数据往往无法查到。而298.15 K下气态物质的热力学性质可根据Benson基团贡献法计算得到。焓、熵、吉布斯自由能都是状态函数,根据状态函数变化值只与系统始态和终态有关而与具体路径无关的特征设计了计算路径,以便于求出所需液态物质的热力学性质。具体计算路径如图1所示,其中M表示状态函数;l表示物质为液态;g表示物质为气态;ΔM为物质终态变化所导致对应状态函数的增量。
1.3 计算过程分析
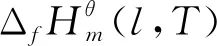
(5)
(6)
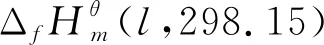
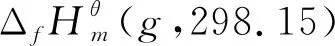
(7)
(8)
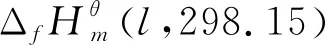
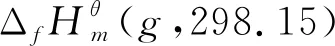
(9)
(10)
式中Nk为基团数;Nts为总的对称数;Noi为分子的光学异构体数目。
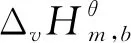
(11)
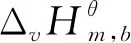
再根据Watson[18]方程计算出其他温度的蒸发焓即
(12)
式中ΔHv2为在状态2下的蒸发焓,J/mol;ΔHv1为状态1下的蒸发焓,J/mol;Tr2为状态2下的对比温度,量纲为1;Tr1为状态1下的对比温度,量纲为1;n为指数。
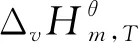
(13)
(14)
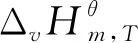
采用Constantinou-Gani基团贡献法[18]估算Tc和Tb,即
(15)
式中Nk为一级基团数目,tc1k为一级基团对临界温度的贡献值;Mj为二级基团的数目,tc2j为二级基团对临界温度的贡献值,一级基团计算时W值设为0,二级计算时设为1。
(16)
式中Nk为一级基团数目,tb1k为一级基团对沸点的贡献值,Mj为二级基团的数目,tb2j为二级基团对沸点的贡献值,一级基团计算时W值设为0,二级计算时设为1。
(3)Cpl的计算 采用RD基团贡献法[18]计算各物质从熔点到沸点的液态摩尔恒压热容的表达式。此法可以表示为
(17)
式中R为气体摩尔常数,8.314 J/(mol·K);T为温度,K。参数A、B和D由下式计算求得。
(18)
式中ni为i类基团的个数;k为不同种类的基团的总数;参数ai、bi、di为液态摩尔恒压热容相应常数的贡献值。
综上所述,基于图1中的设计路径再根据上述的逆分析过程,通过以上各种计算方法估算出所需热力学数据,最终可利用计算结果对反应体系进行热力学分析。
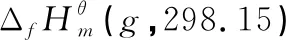
表1 298.15 K下各物质气态时的和计算值和误差分析
2 计算结果
2.1 298.15 K下各物质气态时的和
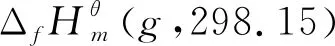
2.2 相变数据及物质液相热力学数据
(1)Tb和Tc直接酯化反应体系和乙酰化反应体系中各物质Tb和Tc估算值和误差分析如表2所示。
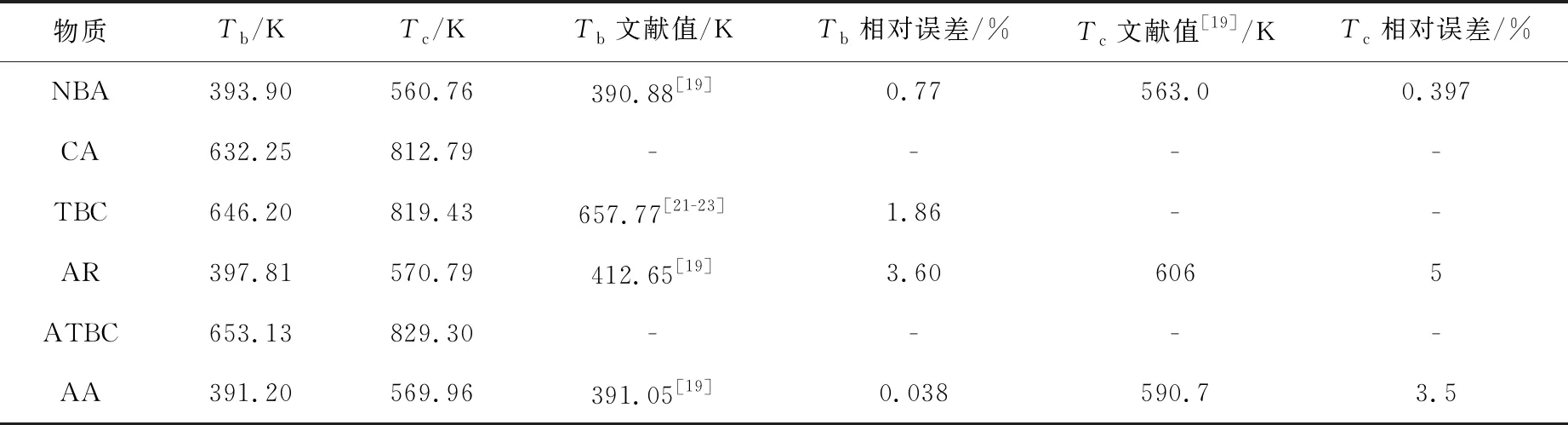
表2 各物质的沸点Tb和临界温度Tc计算值和相对误差分析

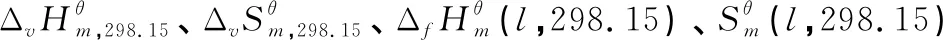
表3 各物质在298.15 K下的计算值及误差分析
(3)Cpl计算结果 采用RD基团贡献法对各物质液态摩尔恒压热容Cpl的计算结果和误差分析如表4所示。
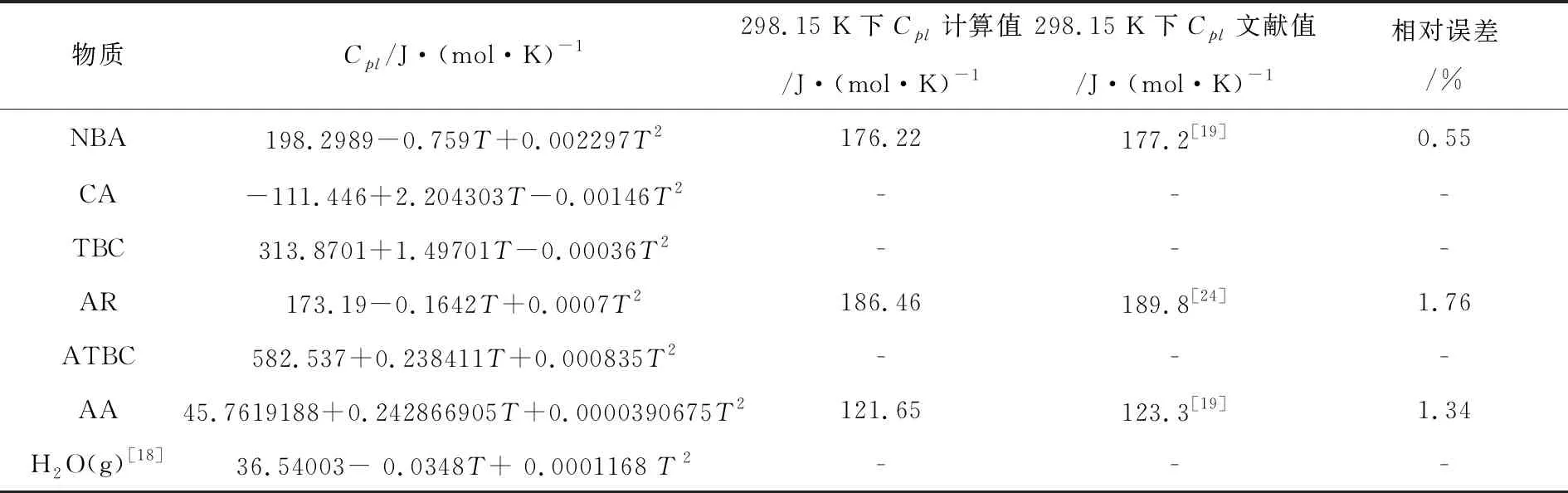
表4 各物质的液态摩尔恒压热容Cpl计算结果和误差分析
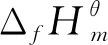
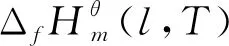
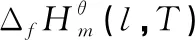
表5 直接酯化反应体系各物质在不同温度下的和
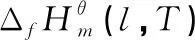
表6 乙酰化反应体系各物质在不同温度下的和
3 反应体系的热力学分析
3.1 直接酯化反应过程

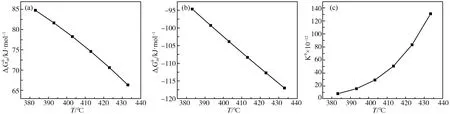
图2 直接酯化反应体系中随T的变化
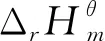
3.2 乙酰化反应过程

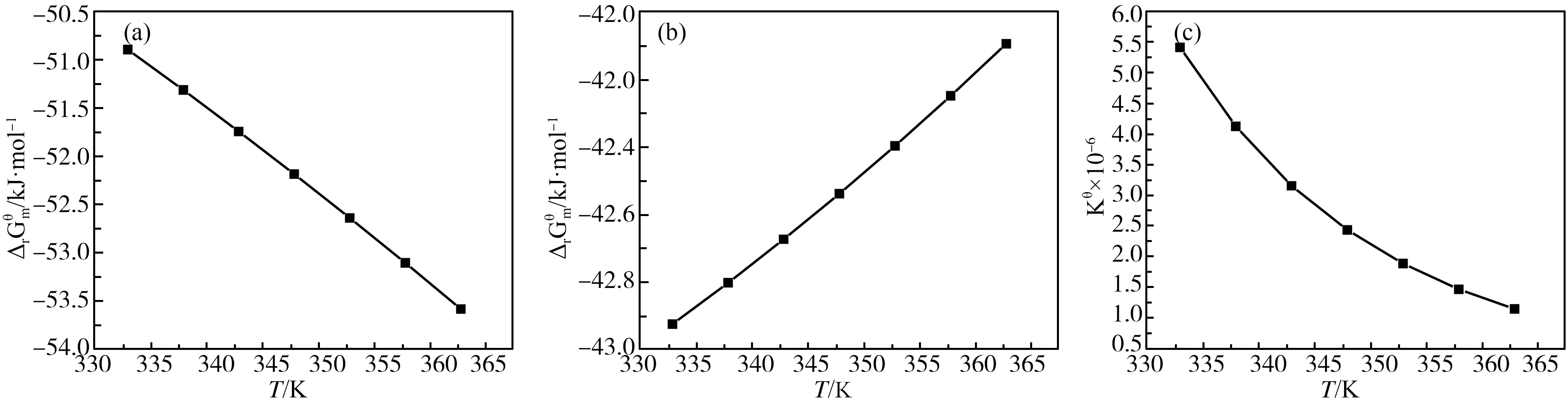
图3 乙酰化反应体系中随T的变化
4 结论
ATBC的合成需要经过两步反应,首先CA与NBA直接酯化反应得到TBC,然后AR与TBC乙酰化反应得到ATBC。采用基团贡献法得到两反应体系中各物质的热力学基础数据,并利用所得数据进行不同温度下各反应体系的标准摩尔反应焓变、标准摩尔反应吉布斯自由能变和化学反应平衡常数的计算,通过计算结果进一步分别对两反应体系进行了热力学分析。分析结果表明:CA与NBA直接酯化反应在383-433 K范围内是一个能自发进行的吸热反应,升高温度有利于该反应向正反应方向进行;TBC乙酰化反应在333-363 K范围内是自发进行的放热反应,升高温度不利于该反应向正反应方向进行。此外,两反应的化学反应平衡常数都很大(K>105)。
