短短芽胞杆菌多态性分析及产挥发性物质生防菌株筛选
2021-03-28车建美刘国红陈倩倩刘丹莹刘波
车建美 刘国红 陈倩倩 刘丹莹 刘波

摘 要:为研究不同地区分离的短短芽胞杆菌菌株的多样性特征,并筛选产挥发性物质生防菌株,采用REPPCR、BOXPCR和ERICPCR对短短芽胞杆菌进行遗传多样性分析;同时,采用二分隔平板进行产挥发性物质生防菌株的筛选。结果表明:采用BOX、ERIC和REP引物可以扩增出11~15条较亮、较稳定的条带,多态性比率分别达到85.71%、93.33%和90.91%,表明不同地区分离的菌株基因组存在丰富的遗传多样性。系统聚类分析结果表明,当λ=4.02时,可将20株短短芽胞杆菌菌株分为3个类群,其中来源青海的75%菌株都聚集在类群Ⅱ;来源西藏的75%菌株都聚集在类群Ⅲ中的第1个亚群;来源福建漳州的菌株都聚集在类群Ⅲ中的第2个亚群。采用二分隔平板筛选到5株短短芽胞杆菌,其产生的挥发性物质对龙眼焦腐病菌FJAT3586具有显著的抑制作用,其中菌株FJAT18569和FJAT18570的抑菌率分别为62.80%和59.85%。本试验为研究短短芽胞杆菌多态性提供一定的依据,并为扩充采后水果病害生物防治微生物资源奠定基础。
关键词:短短芽胞杆菌;REPPCR;挥发性物质;遗传多样性
中图分类号:S 476.1 文献标志码:A 文章编号:0253-2301(2021)01-0001-08
DOI:10.13651/j.cnki.fjnykj.2021.01.001
Abstract:In order to study the diversity characteristics of Brevibacillus brevis strains isolated from different areas and to screen the biocontrol strains which produce volatile substances, the genetic diversity of Brevibacillus brevis strains was analyzed by using REPPCR, BOXPCR and ERICPCR, and the biocontrol strains which produced volatile substances were screened by using two-compartment plates. The results showed that 11-15 bright and stable bands could be amplified with BOX, ERIC and REP primers, and the polymorphism rates reached 85.71%, 93.33% and 90.91%, respectively, indicating that there were rich genetic diversity in the genomes of Brevibacillus brevis strains isolated from different regions. The hierarchical cluster analysis results showed that:20 strains of Brevibacillus brevis could be divided into three groups when λ=4.02. Of these clusters, 75% of the strains which were collected from Qinghai were gathered in group Ⅱ, 75% of the strains which were collected from Tibet were gathered in the first subgroup of group Ⅲ, and all the strains which were collected from Zhangzhou in Fujian were gathered in the second subgroup of group Ⅲ. By using two-compartment plates, 5 strains of Brevibacillus brevis were screened, by which the volatile substances produced had significant inhibiting effect on Lasiodiplodia theobromae FJAT3586, and the bacteriostasis rates of FJAT18569 and FJAT18570 were 62.80% and 59.85%, respectively. This study provided some basis for studying the polymorphism of Brevibacillus brevis and laid a foundation for expanding the microbial resources for biological control of postharvest fruit diseases.
Key words:Brevibacillus brevis; REP-PCR; Volatile substance; Genetic diversity
短短芽胞桿菌Brevibacillus brevis属于短芽胞杆菌属,能够形成芽孢,具有很强的环境适应力及与土著微生物的竞争力等[1],广泛分布于植物根际土壤、海水、湿地和淤泥等生态环境中[2]。近年来,不同生境的短短芽胞杆菌被分离出来应用于环保、生防、化工、食品等方面[3-5]。从大庆油田采油厂含油污水中分离筛选得到的短短芽胞杆菌可降解高碳链饱和烷烃,提高油田采收率[6]。分离自贵州烟田根际土壤的短短芽胞杆菌DZQ3对烟草青枯菌病原菌具有强烈的拮抗作用,能够诱导系统抗性,增强烟草的抗病能力[7]。从云南昆明滇池一水生植物中分离得到1株内生短短芽胞杆菌,对杨桃炭疽菌Colletotrichum gloeosporioides、香石竹疫霉Phytophthora nicotianae和腐皮镰刀菌Fusadum solani等多种植物病原真菌有着较强的拮抗作用[8]。
不同地理区域的生态环境、气候条件等差异明显,研究不同生境分离得到的短短芽胞杆菌群体的遗传多样性对于促进短短芽胞杆菌的广泛应用具有重要的理论意义。微生物基因组中广泛分布着短重复序列,根据这些序列设计引物,选择性地扩增重复序列之间的不同基因区域,以得到大小不等的DNA扩增片段的方法日渐增多[9]。在微生物多样性分析中,基因外重复回文因子(repetitive extragenic palindromic,REP)、肠杆菌基因间重复一致序列(enterobacterial repetitive inter-genic consensus,ERIC)和BOX插入因子等细菌重复序列(repetitive sequence,Rep)的PCR扩增操作简单快捷,易获得较为丰富的条带,能够完成大量菌株的DNA多态性分析[10-12]。采用ERICPCR进行新疆牛源大肠杆菌O157∶H7的指纹图谱分析表明,不同来源的菌株之间,存在着某些相似的ERIC特性,并聚集在同一个簇群中[13]。以BOX引物对烤烟叶片内生固氮菌基因组进行PCR扩增,结果表明,62株固氮菌可被划分为16种不同的遗传图谱类型[14]。采用REPPCR和ERICPCR可将140株苏云金芽胞杆菌Bacillus thuringiensis划分为4个主要类群[15]。但目前未見采用该方法进行短短芽胞杆菌遗传多样性分析的相关文献报道。
与非挥发性抗菌物质相比,芽孢杆菌产生的挥发性物质更容易在空气中扩散,能更有效地抑制病原菌生长,因此近年来广泛应用于采后保鲜研究[16-17]。甲基营养芽孢杆菌Bacillus methylotrophicus BCN2和苏云金芽胞杆菌B.Thuringiensis(BCN10)产生的挥发性物质可以抑制尖孢镰刀菌Fusarium oxysporum、灰霉病菌Botrytis cinerea、胶孢炭疽菌等5种采后病原菌[18]。贝莱斯芽孢杆菌Bacillus velezensis(BUZ14)产生的挥发性物质对褐腐病菌Monilinia fructicola和柑橘青霉菌Penicillium italicum生长的抑制率分别为72%和80%。贝莱斯芽孢杆菌Bacillus velezensis(BUZ13)和BUZ15对灰霉病菌B.cinerea生长的抑制率为100%[19]。短短芽胞杆菌FJAT8672挥发性抑菌代谢物对尖孢镰刀菌的抑制率为36.10%,GCMS检测表明,该菌株可以产生21种高匹配度挥发性抑菌代谢物[20]。但目前关于短短芽胞杆菌产生挥发性物质抑制果实采后病原菌的研究报道较少。本研究通过REPPCR、BOXPCR和ERICPCR对短短芽胞杆菌进行遗传多样性分析,以期揭示不同地区分离的短短芽胞杆菌菌株的多样性特征,同时,采用二分隔平板进行产挥发性物质生防短短芽胞杆菌菌株的筛选,为丰富采后水果病害防治微生物菌种资源开发和利用提供基础理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株 供试短短芽胞杆菌菌株均为本实验室分离并保存,供试菌株及来源列于表1。龙眼焦腐病病原菌FJAT3586为本实验室分离并保存。
1.1.2 供试培养基 短短芽胞杆菌培养采用牛肉浸膏(NA)培养基,龙眼焦腐病病菌培养采用PDA培养基。
1.1.3 主要试剂和仪器 PCR仪、电泳仪为BioRad公司生产;凝胶成像仪为Gel DocItTM UVP凝胶成像系统。细菌基因组DNA提取试剂盒购自BioTeke公司;Taq酶、dNTPs购自北京天根生物有限公司;3000 bp Marker购自Ferments生物有限公司。
1.2 试验方法
1.2.1 菌株培养 用灭菌牙签挑取活化的不同菌株单菌落于25 mL液体培养基中,30℃、170 r·min-1培养24 h。
1.2.2 菌株基因组DNA提取 参照细菌基因组DNA提取试剂盒说明书提取各菌株的基因组DNA。
1.2.3 菌株多态性分析 (1)BOXPCR:25 μL PCR反应体系包括19.7 μL ddH2O;10×Buffer 2.5 μL、10 μmol BOXA1R引物1 μL、2 mmol·L-1 dNTPs 0.5 μL、2.5 U Taq酶0.3 μL和25 ng模板DNA 1 μL。PCR循环参数为:95℃预变性7 min;然后进入94℃ 1 min,52℃ 1 min,72℃ 8 min,共30个循环,最后72℃延伸15 min。采用2%的琼脂糖凝胶进行电泳并拍照。(2)REPPCR:25 μL PCR反应体系中含有15.7 μL ddH2O;10×Buffer 2.5 μL、2 mmol·L-1 dNTPs 0.5 μL、10 μmol REP引物5 μL、2.5 U Taq酶0.3 μL和25 ng模板DNA 1 μL。PCR循环参数为:95℃预变性 7 min;然后进入94℃ 1 min,44℃ 1 min,72℃ 8 min,共30个循环;最后72℃延伸15 min。采用2%的琼脂糖凝胶进行电泳并拍照。(3)ERICPCR:25 μL PCR反应体系中含有ddH2O 15.7 μL ;10×Buffer 2.5 μL、2 mmol·L-1 dNTPs 0.5 μL、10 μmol REP引物5 μL、2.5 U Taq酶0.3 μL和25 ng模板DNA 1 μL。PCR循环体系为94℃预变性 4 min;然后进入94℃ 1 min,52℃ 1 min,65℃ 6 min,共30个循环;最后65℃延伸16 min。采用2%的琼脂糖凝胶进行电泳,并拍照。
1.2.4 产挥发性物质生防菌株的筛选 在二分隔培养皿的一边倒入PDA固体培养基,待凝。随后取350 μL供试细菌悬浮液(1×107 cfu·mL-1)于7 mL NA半固体培养基中,混匀,倒入培养皿的另一边,30℃培养2 d。取龙眼焦腐病病原菌FJAT3586菌饼5.55 mm,置于二分隔培养皿PDA的另一边,以无菌水为对照。28℃培养5 d后,测量病原菌菌落直径,参照以下公式计算抑菌率。
抑菌率=(对照组病原菌菌落直径-处理组病原菌菌落直径)/(对照组病原菌菌落直径-菌饼直径)×100%。
1.2.5 数据统计 参照PCR扩增结果的琼脂糖凝胶电泳图谱,根据各扩增条带的迁移率及其有无统计所得位点的二源数据:无带计为“0”,强带和弱带均计为“1”。 多态性比率参照以下公式计算:
多态性比率=(总扩增条带数-公共条带数)/总扩增条带数×100%
不同菌株间聚类采用欧式距离法,小类之间的距离计算方法采用最远距离法(Furthest neighbor),即在类中最远的两个样品之间的聚类为这两个类的距离。
2 结果与分析
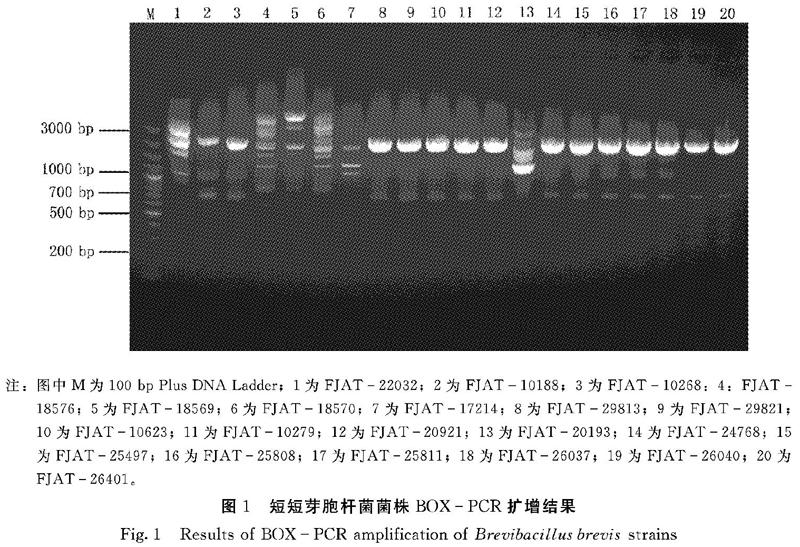
2.1 短短芽胞杆菌BOXPCR多态性分析
不同来源的短短芽胞杆菌BOXPCR扩增结果如图1所示。采用BOX引物共扩增出14条较亮、较稳定的条带,其中1000 bp和2000 bp的2条条带是共有条带,其余为特异性条带,多态性比率达到85.71%。
2.2 短短芽胞杆菌ERICPCR多态性分析
不同来源的短短芽胞杆菌ERICPCR扩增结果如图2所示。采用ERIC引物共扩增出15条较亮、较稳定的条带,其中1200 bp的1条条带为所有菌株的共有条带,其余为特异性条带,多态性比率达到93.33%。
2.3 短短芽胞杆菌REPPCR多态性分析
不同来源的短短芽胞杆菌REPPCR扩增结果如图3所示。采用REP引物共扩增出11条较亮、较稳定的条带,其中700 bp的1条条带为所有菌株的共有条带,其余为特异性条带,多态性比率为90.91%。
2.4 短短芽胞杆菌的分子多态性分析
利用BOXPCR、REPPCR和ERICPCR在不同短短芽胞杆菌分布的扩增条带进行系统聚类分析,结果(图4)表明,当λ=4.02时,可将20株短短芽胞杆菌菌株分为3个类群,类群Ⅰ仅为1个菌株,类群Ⅱ包含4个菌株,其中来源青海的75%菌株都聚集在该类群;类群Ⅲ共包含15个菌株,该类群可以划分为3个亚群,在第1个亚群中,来源哈尔滨的菌株都聚集在该亚群,来源福建顺昌的75%菌株都聚集在该亚群,来源西藏的75%菌株也聚集在该亚群;在第2个亚群中,来源于福建漳州的菌株都聚集在该亚群;青海可可西里样品分离的菌株单独在第3个亚群。
2.5 产挥发性物质生防菌株的筛选
不同短短芽胞杆菌产生挥发性物质的抑菌试验结果表明,所测试的20株短短芽胞杆菌中,有5株短短芽胞杆菌产生的挥发性物质对龙眼焦腐病病原菌FJAT3586具有显著的抑制作用(图5),其中抑菌率最高的为菌株FJAT18569,其抑菌率为62.80%;其次为菌株FJAT18570,其抑菌率为59.85%;菌株FJAT17214和菌株FJAT10623抑菌率相对较低,分别为50.52%和49.75%(图6)。
3 讨论
BOXPCR、ERICPCR和REPPCR指纹分析技术可以反映出菌株间基因组存在的差异,具有快速性、灵敏性、可重复性和可靠性等优点,在微生物分类鉴定、菌株分型和生态学研究中应用广泛,为植物病害生防菌筛选技术的深入研究奠定了基础[21-22]。本研究首次通过BOXPCR、ERICPCR和REPPCR对不同短短芽胞杆菌进行基因组扩增,结果表明,采用BOX引物共扩增出14条较亮、较稳定的条带,多态性比率达到85.71%;采用ERIC引物共扩增出15条较亮、较稳定的条带,多态性比率达到93.33%;采用REP引物共扩增出11条条带,多态性比率达到90.91%,表明不同地区分离的菌株基因组存在丰富的遗传多样性。该结果与不同地区采集的苏云金芽胞杆菌遗传多样性分析结果相似,采用REPPCR和ERICPCR对27株标准苏云金芽胞杆菌和113株分离的苏云金芽胞杆菌进行扩增,结果表明,其电泳条带分别为2~7条和3~10条,具有丰富的遗传多样性。
利用BOXPCR、REPPCR和ERICPCR在不同短短芽胞杆菌菌株分布的扩增条带进行系统聚类分析,结果表明,当λ=4.02时,可将20株短短芽胞杆菌菌株分为3个类群,其中来源青海的75%菌株都聚集在类群Ⅱ;来源西藏的75%菌株聚集在类群Ⅲ中的第1个亚群;来源福建漳州的菌株都聚集在类群Ⅲ中的第2个亚群。说明,BOXPCR、REPPCR和ERICPCR可用于短短芽胞杆菌地理区域多样性的分析。该结果与采用BOXPCR、REPPCR和ERICPCR分析不同病原菌、芽胞杆菌及其他属菌株的地域多样性结果类似。对84株来自福建地区不同寄主的青枯雷尔氏菌多样性分析表明,青枯雷尔氏菌的地域性差异主要由BOXPCR提供[23]。采用BOXPCR和ERICPCR分析采自云南省不同地区溶杆菌也具有明显的地域差异,采自昆明、石林、临沧等地区的溶杆菌被划分为不同的类群[24]。由于本研究所用菌株数量有限,其代表程度存在一定的局限性,在今后的研究中,将进一步收集分离更多不同地域的短短芽胞杆菌菌株进行遗传多样性分析。
短短芽胞杆菌在农业领域应用广泛,可抑制多种植物病原菌生长[7-8]以及抑制水果采后病原菌的生长等[25]。芽孢杆菌产生的挥发性物质因不与水果直接接触,且能更有效地抑制病原菌生长,因此近年来成为采后保鲜研究的热点之一[17]。短短芽胞杆菌也会产生挥发性物质[20],但关于其对采后病原菌的抑制作用研究并不多。因此,本研究还对20株短短芽胞杆菌产生的挥发性物质的抑菌效果进行研究。结果表明,有5株短短芽胞杆菌产生的挥发性物质对龙眼焦腐病病原菌FJAT3586具有显著的抑制作用,其中抑菌率最高的为菌株FJAT18569,其抑菌率为62.80%。該结果与郑香香等[26]研究的芽孢杆菌HB2、B1和X发酵液产生的挥发性气体对极早熟桃采后链格孢菌的抑菌率(50%以上)较一致。橡胶树内生枯草芽孢杆菌菌株Czk1挥发性物质对橡胶树5种根病菌和橡胶树炭疽病菌的抑菌活性均表现出良好的抑制作用,利用HSSPMEGCMS对Czk1所产挥发性物质组分进行分析,共分离鉴定获得包括碳氢化合物、胺类、醇类、烯类、酚类、酯类、吡嗪类、醛类、酮类及其他类等33种挥发性物质[27]。陈峥等[20]采用GCMS检测短短芽胞杆菌FJAT8672挥发性抑菌代谢物,结果发现其产生的高匹配度挥发性抑菌代谢物为21种。因此,推测本研究筛选得到的5株短短芽胞杆菌也可能产生不同种类的挥发性抑菌代谢物,然而这些挥发性代谢物具体包括哪些种类目前还不清楚,后续研究将对其挥发性物质进行检测,并研究其主要挥发性物质的抑菌效果和作用机理,为提升这5株短短芽胞杆菌在采后保鲜上的应用奠定基础。
参考文献:
[1]SEDDON B,MCHUGH R C,SCHMITT A.Brevibacillus brevis-a novel candidate biocontrol agent with broad-spectrum antifungal activity[C]//Proceedings of an international conference held at the Brighton Hilton Metropole Hotel.Brighton:United Kingdom,2000:563-70.
[2]王忠忠.短短芽孢桿菌YNP1的分离及其抗菌物质的初步鉴定[D].西安:陕西科技大学,2018.
[3]黄学,伍晓林,侯兆伟.短短芽孢杆菌和蜡状芽孢杆菌降解原油烃机制研究[J].石油学报,2006(5):96-99.
[4]葛慈斌,刘波,蓝江林,等.生防菌JK2对尖孢镰刀菌抑制特性的研究[J].福建农业学报,2009,24(1):29-34.
[5]CHE J M,LIU B,LIU G H,et al.Induced mutation breeding of Brevibacillus brevis FJAT0809GLX for improving ethylparaben production and its application in the biocontrol of Lasiodiplodia theobromae[J].Postharvest Biology and Technology,2018,146:60-67.
[6]郭万奎,侯兆伟,石梅,等.短短芽孢杆菌和蜡状芽孢杆菌采油机理及其在大庆特低渗透油藏的应用[J].石油勘探与开发,2007,34(1):73-78.
[7]朱忠彬,吴秉奇,丁延芹,等.短短芽孢杆菌DZQ3对烟草的促生及系统抗性诱导作用[J].中国烟草科学,2012(3):92-96.
[8]邱孙全,杨红,赵春安,等.一株内生短短芽孢杆菌的鉴定及其抗菌活性研究[J].天然产物研究与开发,2009,21(B05):30-33.
[9]杨凤环,李正楠,姬惜珠,等.BOXPCR技术在微生物多样性研究中的应用[J].微生物学通报,2008,35(8):1282-1286.
[10]MARTA T,ARTUR A,MARIA J S,et al.BOXPCR is an adequate tool for typing Aeromonas spp.[J].Antonia Van Leeuwenhoek,2005,88(2):173-179.
[11]高小宁,郑州,赵志博,等.陕西省猕猴桃细菌性溃疡病菌(Pseudomonas syringae pv.actinidiae)REPPCR的遗传多样性分析[J].果树学报,2016,33(3):340-349.
[12]DAMNJANOVIC D,XABIER VZQUEZ-CAMPOS,WINTER D L,et al.Bacteriophage genotyping using BOXA repetitive-PCR[J].BMC Microbiology,2020,20(1):154-167.
[13]苏战强,张凌,刘璐瑶,等.新疆牛源大肠杆菌O157∶H7的分离鉴定及ERIC-PCR基因分型研究[J].中国畜牧兽医,2020,47(1):182-189.
[14]陈静,李斌,曾庆宾,等.攀枝花地区烤烟可培养内生固氮菌的多样性[J].微生物学通报,2017,44(2):428-437.
[15]JAWAHAR K,RUPESH D,NAGENDRA K S,et al.Molecular typing of native Bacillus thuringiensis isolates from diverse habitats in india using REP-PCR and ERIC-PCR analysis[J].The Journal of General and Applied Microbiology,2012,58:83-94.
[16]DI FRANCESCO A,MARI M.Use of biocontrol agents in combination with physical and chemical treatments:efficacy assessment[J].Stewart Postharvest Review,2014,10(1):1-4.
[17]MARI M,BAUTISTA-BANOS S,SIVAKUMAR D.Decay control in the postharvest system:role of microbial and plant volatile organic compounds[J].Postharvest Biology and Technology,2016,122:70-81.
[18]HE C N,YE W Q,ZHU Y Y,et al.Antifungal activity of volatile organic compounds produced by Bacillus methylotrophicus and Bacillus thuringiensis against five common spoilage fungi on loquats[J].Molecules,2020,25(15):3360.
[19]HCTOR C,MENDIARA I,ARIAS E,et al.Antifungal activity of the volatile organic compounds produced by Bacillus velezensis strains against postharvest fungal pathogens[J].Postharvest Biology and Technology,2020,166:111208.
[20]陈峥,刘波,陈梅春,等.基于顶空固相微萃取气质联用的短短芽胞杆菌挥发性抑菌代谢物的鉴定[J].食品安全质量检测学报,2014(9):2844-2852.
[21]MOHAPATRA B R,MAZUMDER A.Comparative efficacy of five different REP-PCR methods to discriminate Escherichia coli populations in aquatic environments[J].Water ence & Technology,2008,58(3):537-547.
[22]KATARA J,DESHMUKH R K,SINGH N,et al.Molecular typing of native Bacillus thuringiensis isolates from diverse habitats in india using REP-PCR and ERIC-PCR analysis[J].Journal of General & Applied Microbiology,2012,58(2):83-94.
[23]林海云,车建美,刘波,等.基于BOX-PCR和REP-PCR技术青枯雷尔氏菌遗传多样性分析[J].农业生物技术学报,2011,19(6):1099-1109.
[24]FU L N,ZHANG H Y,ZHANG X F,et al.Genetic diversity analysis of rep-PCR genomic fingerprinting of Lysobacter spp.[J].African Journal of Microbiology Research,2016,10(34):1388-1396.
[25]CHE J M,LIU B,RUAN C Q,et al.Biocontrol of Lasiodiplodia theobromae,which causes black spot disease of harvested wax apple fruit,using a strain of Brevibacillus brevis FJAT0809
GLX[J].Crop Protection,2015,67:178-183.
[26]鄭香香,张娜,阎瑞香,等.不同芽孢杆菌对极早熟桃采后链格孢菌的防治效果及其发酵液挥发性物质成分分析[J].食品工业科技,2019(14):144-150,156.
[27]梁艳琼,唐文,董文敏,等.枯草芽孢杆菌菌株Czk1挥发性物质的抑菌活性及其组分分析[J].南方农业学报,2019,50(11):2465-2474.
(责任编辑:林玲娜)
