丹红化瘀口服液含药血清对氯化钴诱导EA.hy926 细胞缺氧损伤的保护作用
2021-03-25陈文培陆紫琪林宝琴桂蜀华
唐 萍,陈文培,陆紫琪,杨 威,林宝琴,桂蜀华*
(1.广州中医药大学中药学院,广东 广州 510006;2.广东莱恩医药研究院有限公司,广东省药物非临床评价研究企业重点实验室,广东 广州 510990)
糖尿病视网膜病变(diabetic retinopathy,DR) 是糖尿病最常见和最严重的微血管并发症之一,是全球成年人致盲的主要原因[1]。在中国,23%糖尿病患者并发DR[2]。随着糖尿病发病率逐年增加,DR 发病形势日益严峻,如果不采取紧急措施,2030 年全球DR 病人将高达191 00 万[3]。高血糖引起血流灌注减少和内皮细胞损伤等血管功能障碍,导致视网膜局部缺血缺氧,继而诱发新生血管形成[4-5]。氧化应激是引起DR 的重要病理机制[6-7]。因此,抑制氧化应激和保护内皮细胞对于防治DR 具有重要意义。
丹红化瘀口服液由丹参、当归、川芎、桃仁、红花、柴胡和枳壳组成,具有活血化瘀、行气通络的功效,可用于气滞血瘀引起的视物模糊和视网膜中央静脉阻塞症的吸收期。本课题组发现丹红化瘀口服液有效防治自发性Ⅱ型糖尿病ZDF 大鼠DR[8]和链脲佐菌素(STZ) 诱导的大鼠DR[9],且减轻高糖诱导的EA.hy926 细胞损伤[10]。本实验采用CoCl2诱导的EA.hy926 细胞缺氧损伤模型,从抗氧化角度研究丹红化瘀口服液含药血清对内皮细胞的保护作用,进一步探讨其防治DR 的作用机制。
1 材料
1.1 动物 雄性SD 大鼠(SPF 级),体质量(220±20) g,购于广州中医药大学实验动物中心,实验动物生产许可证号SCXK (粤) 2013-0020。
1.2 细胞 EA.hy926 细胞购于中国科学院上海生命科学研究院。
1.3 药物和试剂 丹红化瘀口服液(批号B5A002) 购于广州白云山和记黄埔中药有限公司。DMEM 培养基(批号8114125)、胰蛋白酶(批号1369113) 购于美国Gibco 公司;胎牛血清(批号1407738) 购于以色列Biological Industries 公司;青链霉素混合液 (100X,批号20140415)购于北京Solarbio 公司;CoCl2·6H2O (批号G7021)、噻唑蓝(MTT) (批号MKBP4399V) 购于美国Sigma 公司;Annexin V-FITC 凋亡试剂盒,包含Annexin V binding buffer 10X (批号E10075-1634)、Annexin V FITC (批号EOO887-1638)、Propidium Iodide staining soLution (批 号E14525-106),均购于美国eBioscience 公司;硫代巴比妥酸反应物质(Thiobarbituric Acid Reactive Substances,TBARS) (批号0458288)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px) 检测试剂盒(批号0473965) 购于美国Cayman公司;M-MLV 逆转录试剂盒 (货号6210A)、SYBR®Premix Ex TaqTM定量PCR 试剂盒(货号RR420A) 购于日本TaKaRa 公司。
1.4 仪器 MCO-20AIC 型细胞培养箱(日本三洋电机株式会社);L535R 型台式冷冻离心机(湖南湘仪实验室开发有限公司);BDS300 型倒置生物显微镜(重庆奥特光学仪器有限公司);SW-CJ-2FD 型洁净工作台(苏净集团苏州安泰空气技术有限公司);Multiskan FC 型酶标仪(美国赛默飞公司);2300-001M 型荧光酶标仪(PerkineLmer 公司);FACSCantoTM II 型流式细胞仪 (美国BD 公司);7500 型实时荧光定量PCR 仪(美国ABI 公司)。
2 方法
2.1 溶液配制
2.1.1 丹红化瘀口服液含药血清制备 大鼠丹红化瘀口服液的给药剂量为3.2 mL/kg,连续灌胃5 d,于末次给药1 h后颈动脉采血,3 000 r/min离心,分离血清,于56 ℃温育30 min 灭活,经0.22 μm 微孔滤膜过滤除菌,-20 ℃保存备用。试验时用培养基稀释至所需浓度。
2.1.2 CoCl2溶液制备 称取0.237 9 g CoCl2·6H2O,溶于1 L DMEM 培养基中,混匀,0.22 μm 微孔滤膜过滤除菌,配制母液浓度为1 000 μmol/L,4 ℃避光保存。试验时用培养基稀释至所需浓度。
2.2 缺氧模型的建立 EA.hy926 细胞用含10% 胎牛血清和1%青/链霉素的DMEM 培养基,培养于37 ℃、5% CO2培养箱。取对数生长期细胞制备细胞悬液,以5×103/孔接种于96 孔板,待细胞贴壁后,每孔分别加入终浓度10、50、100、200、400、600、800、1 000 μmol/L CoCl2溶液,培养12、24、48、72 h。MTT 法检测细胞活力,筛选最佳造模浓度和时间。
2.3 丹红化瘀口服液含药血清对正常细胞活力的影响 细胞以5×103/孔接种于96 孔板。待细胞贴壁后,分别加入终浓度为1%、5%、10%、20%的空白血清或含药血清,培养24、48、72 h。MTT 法检测细胞活力,筛选最佳给药浓度。
2.4 丹红化瘀口服液含药血清对缺氧诱导损伤细胞的活力的影响 细胞以5×103/孔接种于96 孔板,待细胞贴壁后,给药组每孔加入终浓度为400 μmol/L 的CoCl2溶液,并分别加入终浓度为1%、5%、10% 的含药血清,孵育48 h,MTT 法检测细胞活力。
2.5 丹红化瘀口服液含药血清对缺氧诱导细胞凋亡的影响 按“2.4” 项下的方法进行造模和给药。弃培养基,PBS 洗涤细胞,用连接缓冲液重悬细胞,调整细胞密度为1×106~5×106/mL。取100 μL 细胞悬液,加入5 μL 的Annexin V-FITC,室温孵育10~15 min,连接缓冲液洗涤、重悬细胞,往细胞悬液中加入5 μL 的PI,流式细胞仪检测。
2.6 丹红化瘀口服液含药血清对缺氧诱导损伤细胞超微结构的影响 按“2.4” 项下方法进行造模和给药。弃培养基,PBS 洗涤细胞,2.5% 戊二醛溶液固定,1% 锇酸溶液再次固定,梯度乙醇脱水,再以丙酮、环氧树脂812 处理,超薄切片,饱和醋酸双氧铀溶液染色,水洗,烘干,于透射显微镜下观察细胞超微结构并拍照。
2.7 丹红化瘀口服液含药血清对缺氧诱导损伤细胞上清MDA 水平和GSH-Px 活力的影响 按“2.4” 项下方法进行造模和给药,收集细胞上清液,按TBARS 试剂盒说明书操作,采用硫代巴比妥酸法测细胞上清液MDA 水平,酶标仪设定波长为530~540 nm,检测各孔的OD。按GSH-Px 试剂盒说明书操作,采用二硫对硝基苯甲酸法测定细胞上清液GSH-Px 活力,酶标仪设定波长为340 nm,检测各孔的OD,每分钟1 次,共5 min,计算结果。
2.8 丹红化瘀口服液含药血清对缺氧诱导损伤细胞mRNA表达的影响 按 “2.4” 项下的方法进行造模和给药。TRIzol 法提取RNA,加焦碳酸二乙酯(DEPC) 水溶解沉淀。超微量紫外分光光度计测定RNA 溶液浓度,OD260/OD280值在1.8~2.0 之间说明RNA 纯度满足要求。取总RNA 1.5 μg,按逆转录试剂盒说明书进行逆转录,收集逆转录产物进行PCR 反应。甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase、GAPDH)、低氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管内皮细胞生长因子受体1 (vascular endothelial growth factor receptor 1,VEGFR1)、血管内皮细胞生长因子受体2 (vascular endothelial growth factor receptor 2,VEGFR2)、诱导型一氧化氮合酶(inductible nitric oxide synthase,iNOS) 引物序列见表1,按RT-PCR 仪操作规范进行PCR 试验,反应条件为95 ℃变性30 s,95 ℃退火3 s,60 ℃延伸34 s,共45 个循环。△Ct=Ct目的基因-CtGAPDH,△△Ct=△Ct实验-△Ct对照,实验结果以2-△△Ct表示。

表1 引物序列
2.9 统计学分析 采用SPSS 20.0 软件,计量资料以() 表示,多组间比较用单因素方差分析。P<0.05 为差异具有统计学意义。
3 结果
3.1 缺氧模型的建立 图1 显示,随着培养时间延长,细胞的OD逐渐增加,提示细胞生长状态良好。随着CoCl2作用浓度增加,细胞的OD逐渐降低,当CoCl2浓度为400 μmol/L,培养时间为48 h 时,增殖抑制率约40%。因此,选择CoCl2浓度为400 μmol/L,培养时间为48 h 作为缺氧模型建立的条件。
3.2 丹红化瘀口服液含药血清对细胞活力的影响 图2A显示,20%空白血清和丹红化瘀口服液含药血清处理24、48、72 h 均能提高正常细胞的活力,而1%~10%空白血清和DHK 含药血清对正常细胞的活力均无影响,因此,选择1%、5%、10%丹红化瘀口服液含药血清进行后续实验。图2B 显示,将1%、5%、10%丹红化瘀口服液含药血清分别与400 μmol/L CoCl2共孵育48 h 后,5%、10%含药血清能剂量依赖性地促进缺氧细胞的生长(P<0.01)。
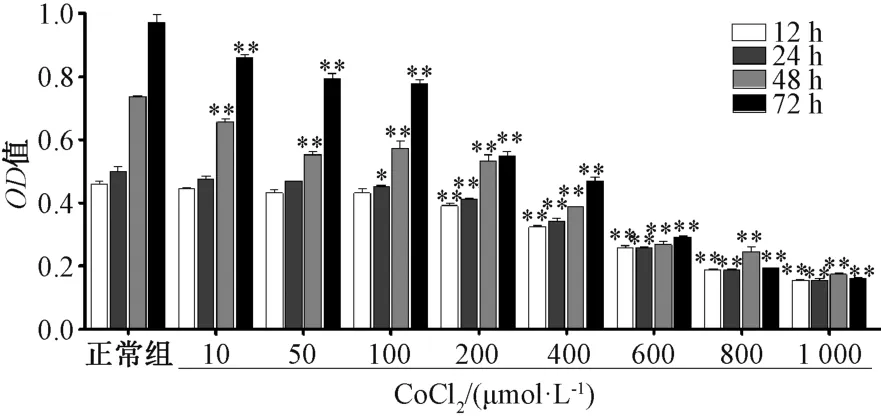
图1 CoCl2 对细胞活力的影响(n=6)
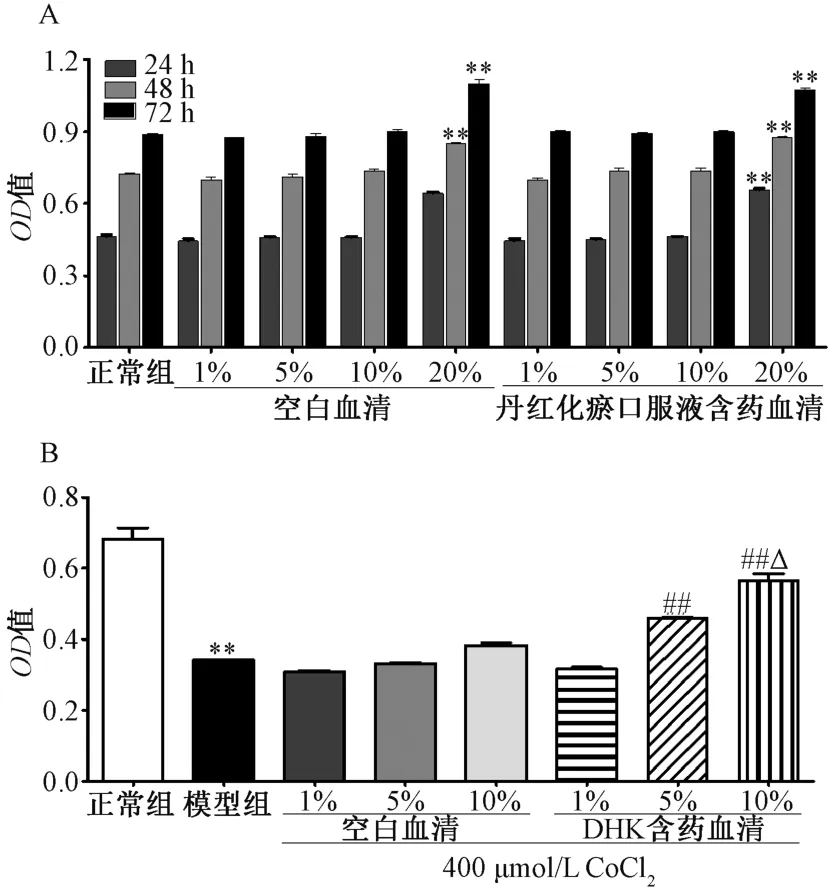
图2 丹红化瘀口服液含药血清对正常细胞(A) 和缺氧细胞(B) 活力的影响(n=4)
3.3 丹红化瘀口服液含药血清对缺氧诱导细胞凋亡的影响图3 显示,与正常组相比,模型组细胞凋亡率增加(P<0.01)。与模型组相比,5%、10% 丹红化瘀口服液含药血清剂量依赖性降低细胞凋亡率(P<0.05,P<0.01)。
3.4 丹红化瘀口服液含药血清对缺氧诱导损伤细胞超微结构的影响 图4 显示,正常组细胞胞质均匀,细胞器结构正常,少见空泡,核仁圆润明显,染色质分布均匀;模型组细胞收缩,形态扭曲,胞质中大量线粒体肿胀甚至空泡样改变,胞核固缩,核仁消失,染色质凝聚;丹红化瘀口服液含药血清组细胞形态呈类圆形,结构完整,胞质中可见少量线粒体肿胀空泡样改变,胞核形态正常,核仁清晰可见,少部分染色质凝聚。
3.5 丹红化瘀口服液含药血清对缺氧诱导损伤细胞上清的MDA 水平和GSH-Px 水平的影响 图5 显示,与正常组相比,模型组细胞上清液MDA 水平升高,而GSH-Px 水平下降(P<0.01);与模型组比较,给予10%丹红化瘀口服液含药血清培养48 h 后,细胞MDA 水平下降约40%,GSHPx 水平升高约95% (P<0.01)。
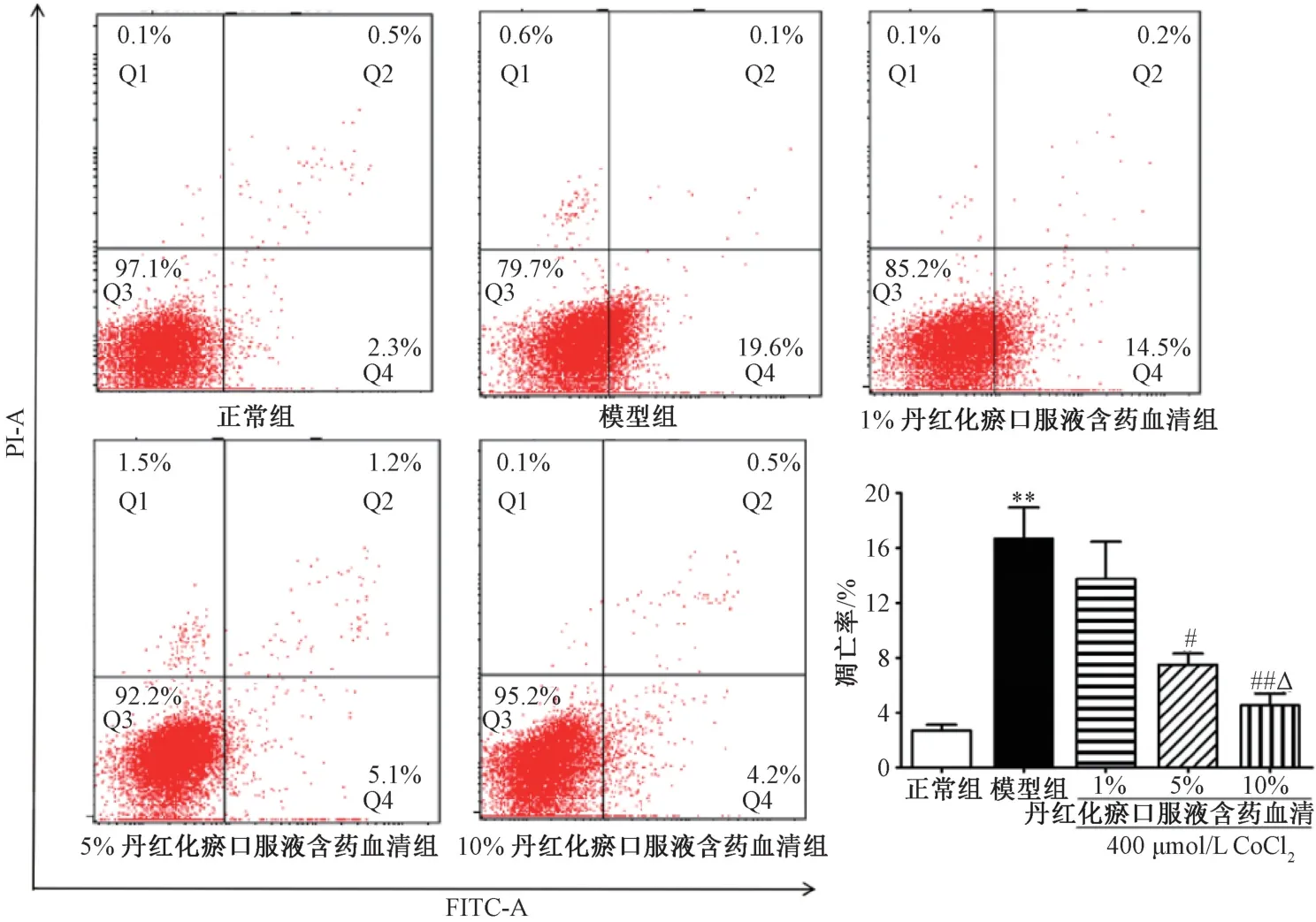
图3 丹红化瘀口服液含药血清对缺氧诱导损伤细胞凋亡的影响(n=6)
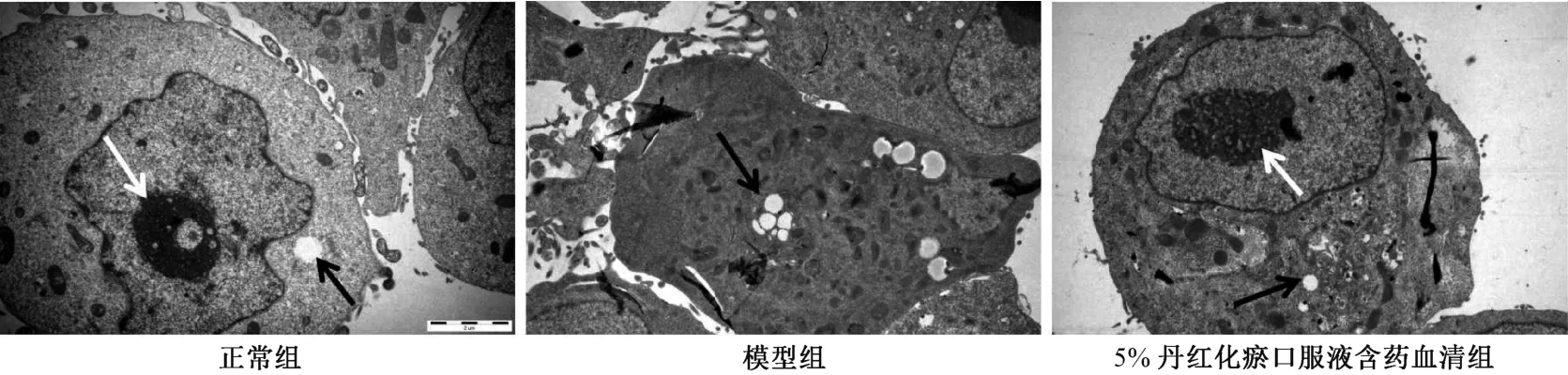
图4 各组细胞超微结构电子显微镜图
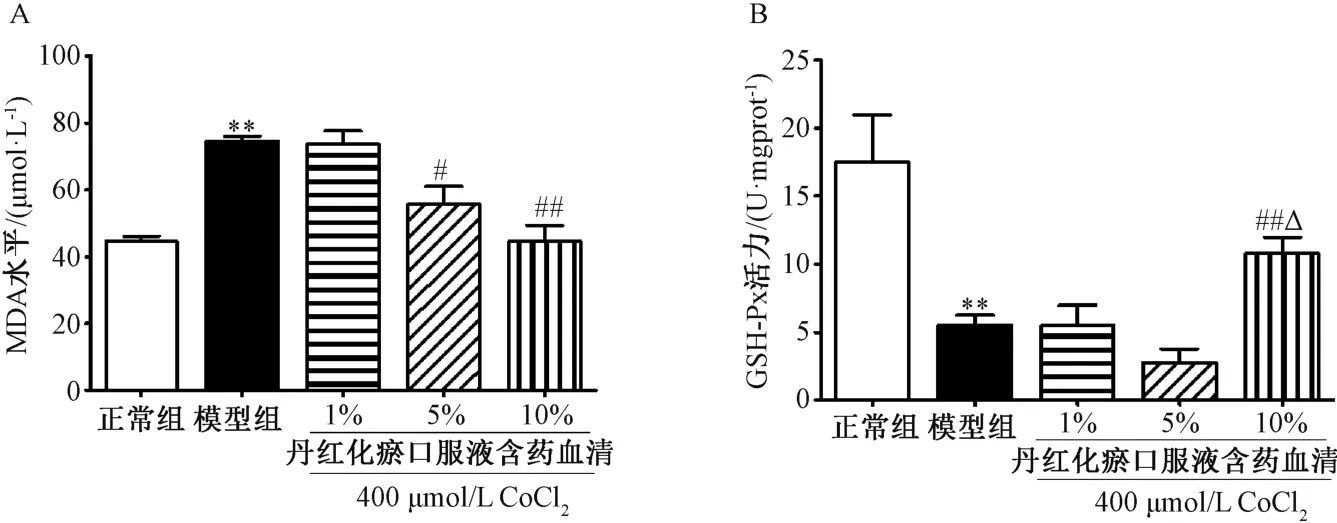
图5 丹红化瘀口服液含药血清对缺氧诱导损伤细胞MDA 水平(A) 和GSH-Px 水平(B) 的影响(n=6)
3.6 丹红化瘀口服液含药血清对缺氧诱导损伤细胞的mRNA 表达的影响 图6 显示,与正常组相比,模型组细胞HIF-1α、VEGF、VEGFR1、VEGFR2、iNOSmRNA 表达均增加(P<0.01)。与模型组相比,5%、10%含药血清呈剂量依赖性降低细胞HIF-1α、VEGF、VEGFR1、VEGFR2 及iNOS的mRNA 表达(P<0.01)。
4 讨论
CoCl2是一种常用于体外细胞缺氧造模的诱导剂,其机制主要与稳定胞内HIF-α 持续表达有关[11]。HIF-α 是缺氧状态下最重要的转录因子,与HIF-β 形成异源二聚体HIF,识别并结合调控基因中的低氧反应元件,激活靶基因如VEGF 等的转录[12]。本实验中用400 μmol/L CoCl2孵育EA.hy926 细胞48 h,使细胞活力明显下降,细胞凋亡,细胞HIF-1α的mRNA 呈现高表达状态,说明该模型成功建立。5%~10%含药血清剂量依赖性地提高缺氧诱导细胞的生长活力,减少凋亡,说明丹红化瘀口服液对缺氧所致损伤的细胞具有一定的保护作用。
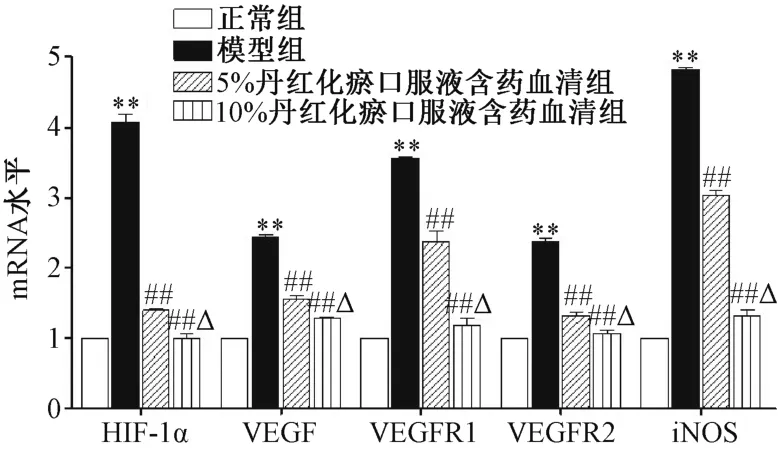
图6 丹红化瘀口服液含药血清对缺氧诱导损伤细胞的mRNA 表达的影响(n=3)
细胞内脂质过氧化被认为在退行性眼病尤其是DR 中扮演着重要的角色[13]。MDA 是细胞脂质过氧化的最终产物,其浓度的高低可用于脂质过氧化损伤程度的评估[14-15]。DR 病人血清中MDA 水平远高于其他没有代谢性疾病的眼病患者[16]。本实验发现在缺氧条件下细胞上清液中MDA 水平显著升高,含药血清可以有效降低细胞的MDA 水平。这提示着丹红化瘀口服液有降低脂质过氧化而减轻缺氧损伤的作用。
抗氧化系统在氧化应激过程中尤为重要。高血糖和缺氧状态下,GSH-Px 等抗氧化酶大量消耗,使得视网膜毛细血管内皮细胞处于氧化应激和硝基化应激状态,诱导细胞凋亡,导致早期DR 血流动力学改变和微血管病变[17-18]。本实验也发现在缺氧条件下,细胞上清液中GSH-Px 水平显著下降,而含药血清可以有效地提高细胞上清液中GSHPx 水平。结果提示,丹红化瘀口服液能增强细胞的抗氧化能力,从而对抗缺氧损伤。
VEGF 是DR 发病机制中的关键因子,与其特异性受体结合后,既可刺激血管内皮细胞增殖及移行来诱导视网膜新生血管形成,又可显著增加视网膜血管的通透性,加速DR 的发展[8,19]。本实验中 缺氧诱导 的细胞中VEGF、VEGFR1 以及VEGFR2 mRNA 均明显上升。含药血清下调VEGF、VEGFR1 以及VEGFR2 mRNA 过表达,提示丹红化瘀口服液可以抑制VEGF、VEGFR1 以及VEGFR2 的高表达,从而保护内皮细胞。
缺氧时,细胞iNOS 表达异常高,诱导NO 大量合成[20]。过量的NO 会与超氧阴离子自由基反应,生成具有强氧化性的过氧化亚硝酸离子,进而分解成有毒物质,加速细胞膜发生脂质过氧化,促使内皮细胞凋亡[21]。含药血清降低缺氧诱导细胞中iNOS的mRNA 高表达,提示丹红化瘀口服液可以抑制iNOS高表达来保护内皮细胞。
综上所述,丹红化瘀口服液含药血清可抑制缺氧所致细胞增殖、凋亡和形态改变,升高细胞GSH-Px 水平,降低MDA 水平,下 调HIF-1α、VEGF、VEGFR1、VEGFR2、iNOSmRNA 过表达,可见其可通过抗氧化作用来减轻缺氧所致的内皮细胞损伤。
