高压制备液相色谱同时制备5 种银杏内酯
2021-03-25冯自立朱志斌赵正栋
冯自立,朱志斌,赵正栋,陈 旺,李 颖
(1.陕西理工大学,陕西 汉中 723001;2.陕西萃程生物医药科技有限公司,陕西 汉中 723007)
银杏内酯为银杏叶重要活性物质,主要包括银杏内酯A、B、C 和白果内酯[1],具有抗炎、抗氧化、抗血小板聚集、神经保护等诸多药理活性[2-7],其中银杏内酯B 是迄今为止在自然界中发现的活性最强的血小板活化因子拮抗剂[8]。由于银杏内酯活性与其纯度具有相关性,故近年来有不少学者对该成分的纯化工艺进行研究,目前主要方法有有机溶剂萃取-结晶法、有机溶剂萃取-柱层析法、模拟移动床色谱法等[9-15],但都存在产品生产周期长、收率和纯度低、不能实现多种内酯化合物同时制备等缺陷。
高压制备液相色谱是快速分离和制备高纯度天然产物活性成分的重要方法之一,因其分离度好、制备效率高、载样量大、制备化合物纯度高,正成为中药化学成分分离纯化的重要手段[16-17],在对照品制备、药理活性研究、中药现代化和质量控制等方面发挥了重要作用。由于银杏内酯紫外吸收弱,采用常规的紫外检测器灵敏度较低,导致其收率和纯度不理想,故本实验采用高压制备液相色谱实现银杏内酯A、B、C、J 和白果内酯同时制备的在线检测,以期为相关系统研究奠定基础。
1 材料
烘干银杏叶于2018 年10 月购自陕西金慧方中药科技有限公司,经陕西理工大学植物系教研室杨培君教授鉴定为银杏科植物银杏Ginkgo bilobaL.的干燥叶(总黄酮醇苷质量分数0.72%总萜内酯质量分数0.46%)。银杏内酯A、B、C、J 和白果内酯对照品(陕西乐博生化科技有限公司)。分析用甲醇、四氢呋喃为色谱纯;制备用甲醇、乙腈、四氢呋喃、乙醇、乙酸乙酯、盐酸、碳酸氢钠、活性炭、酸性氧化铝为分析纯;水为超纯水(实验室自制)。
DYG-200 L 超声波中药提取罐(宁波新芝超声设备有限公司);Agilent 1260 高效液相色谱仪(美国Agilent 公司);HB DAC-50 高效制备液相色谱系统(江苏汉邦科技有限公司);UNIEX 7700 蒸发光散射检测器(上海通微分析技术有限公司);AVANCE 400 核磁共振仪(德国Bruker公司);AL204 电子天平 (瑞士梅特勒-托利多公司);YRE-2050A 旋转蒸发仪(巩义市予华仪器有限责任公司);SCIENTZ-10 N 真空冷冻干燥箱(上海圣科仪器设备有限公司)。
2 方法与结果
2.1 银杏总内酯提取 取干燥银杏叶20 kg,粉碎过80 目筛,加复合酶液(纤维素酶∶果胶酶=1 ∶1) 80 L (复合酶用量67.0 g),盐酸调pH 至5,在50 ℃下酶解4 h,加80 L 工业乙醇搅拌均匀,超声(2 kW) 提取60 min,滤过,滤渣加160 L 50%乙醇超声提取60 min,滤过,合并滤液,减压浓缩至20 L,等体积石油醚(60~90 ℃) 萃取2次,水相用0.5 mol/L 氢氧化钠溶液调pH 至8.0,滤过,滤液用10%盐酸溶液调pH 至7.0,加300 g 氯化钠充分搅拌,等体积乙酸乙酯萃取3 次,合并乙酸乙酯相,无水硫酸钠干燥,滤过,滤液减压浓缩至干,得总银杏内酯粗品228.3 g,纯度36.4% (RSD=1.6%,n=3),回收率90.3% (RSD=1.8%,n=3)。
2.2 银杏内酯结晶 向“2.1” 项下粗品加入500 mL甲醇加热溶解,再加入200 mL 去离子水搅拌均匀,置于4 ℃冰箱中结晶12 h,滤过,母液合并减压浓缩至原体积的1/3,继续于4 ℃冰箱中结晶12 h,抽滤,合并晶体,丙酮重结晶,真空干燥,得总银杏内酯晶体95.0 g,纯度95.8%(RSD=2.1%,n=3),回收率91.3% (RSD=2.3%,n=3)。
2.3 银杏内酯制备 将“2.2” 项下总银杏内酯用70%甲醇配制成50 g/L 溶液,0.45 μm 滤膜过滤,高效制备液相色谱进行制备。
2.3.1 柱填料选择 分别以正向硅胶(200~300 目)、酸性氧化铝 (200~300 目)、Sephadex LH-20 葡聚糖凝胶(27~163 μm)、十八烷基键合硅胶(10 μm) 为填料,对银杏内酯进行制备。结果,正向硅胶、酸性氧化铝对银杏内酯的分离度较差,上样量少,有机溶剂用量多,重复性不理想,产品纯度、收率均较低;LH-20 凝胶分离度差,上样量少,分离速度慢;十八烷基键合硅胶分离度好,上样量多,有机溶剂用量少,重复性好,制备时间短,产品纯度、收率均较高,故选择其作为柱填料。
2.3.2 制备溶剂系统选择 根据HPLC 溶剂系统四面体优化法,对水、甲醇、乙腈、四氢呋喃4 种溶剂体系进行色谱制备。结果,甲醇-水体系可将5 种银杏内酯分离开,但柱效低,上样量少,制备时间长,溶剂用量多;乙腈-水体系较难分离银杏内酯A、B,无法同时制备5 种银杏内酯;甲醇-四氢呋喃-水体系对5 种银杏内酯的选择性较好,制备时间短,分离度好,上样量多,故选择其作为制备溶剂系统。
2.3.3 银杏内酯放大制备 制备色谱条件为NP7010C 高压制备泵(×2);DAC-HB50 动态轴向压缩柱(50 mm×250 mm),Megres C1810 μm 填料;20 mL 定量环;分流式串联 UNIEX-7700 蒸发光散射检测器;Unimicro ChromStation 色谱工作站;流动相甲醇-四氢呋喃-水(30 ∶10 ∶60);体积流量95 mL/min;分流比0.5 ∶94.5;漂移管温度70 ℃;载气体积流量2.5 L/min;进样量12 mL/次。结果,5 种银杏内酯分离度良好,一次上样600 mg 仍能实现基线分离,在25 min 内能完成一次制备;产物经减压浓缩、真空冷冻干燥后,各银杏内酯收率均大于95%,色谱图见图1。
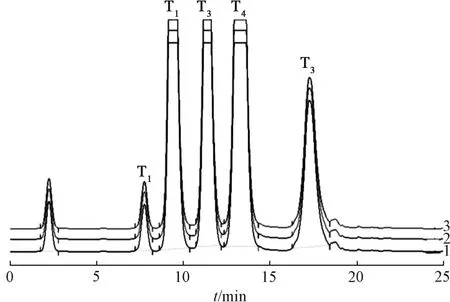
图1 银杏内酯高压制备液相色谱图
2.4 银杏内酯检测
2.4.1 对照品溶液制备 精密称取银杏内酯A、B、C、J及白果内酯对照品各5.0 mg,甲醇定容至5 mL,摇匀,过0.45 μm 微孔滤膜,取续滤液,即得。
2.4.2 供试品溶液制备 取制备的5 种银杏内酯各5.0 mg,甲醇定容至5 mL,摇匀,过0.45 μm 微孔滤膜,取续滤液,即得。
2.4.3 色谱条件 TC-C18色谱柱(4.6 mm × 250 mm,5 μm);UNIEX-7700 蒸发光散射检测器;流动相甲醇-四氢呋喃-水(30 ∶ 10 ∶ 60);体积流量1.0 mL/min;柱 温30 ℃;进样量10 μL。
2.4.4 结果 制得化合物T13.22 g,纯度98.26%;T224.23 g,纯度98.74%;T317.80 g,纯 度98.14%;T428.02 g,纯度98.05%;T510.58 g,纯度98.64%,色谱图见图2。
2.5 结构鉴定
化合物T1:白色粉末(甲醇),mp 349~350 ℃。1H-NMR(400 MHz,DMSO-d6)δ:1.79 (1H,dd,J=15.2,7.8 Hz,H-1),2.72 (1H,dd,J=15.2,7.8 Hz,H-1),4.81 (1H,t,J=7.8 Hz,H-2),6.40 (1H,s,3-OH),4.65 (1H,d,J=4.0 Hz,H-6),4.16 (1H,m,H-7),5.50 (1H,d,J=6.6 Hz,7-OH),1.56 (1H,d,J=12.5 Hz,H-8),4.94 (1H,d,J=5.0 Hz,H-10),6.89 (1H,d,J=5.0 Hz,10-OH),6.05 (1H,s,H-12),2.87 (1H,q,J=7.2 Hz,H-14),1.09 (1H,d,J=7.2 Hz,H-16),1.04 (9H,s,t-Bu);13CNMR (100 MHz,DMSO-d6)δ:36.6 (C-1),87.4 (C-2),85.9 (C-3),100.1 (C-4),63.2 (C-5),85.8 (C-6),72.4(C-7),49.3 (C-8),62.5 (C-9),68.6 (C-10),174.1 (C-11),109.5 (C-12),171.1 (C-13),40.5 (C-14),176.7(C-15),8.3 (C-16),32.4 (C-17),29.0 (C-18),29.0 (C-19),29.0 (C-20)。以上数据与文献[18] 报道一致,故鉴定为银杏内酯J。
化合物 T2:白色针状结晶 (甲醇),mp 353~354 ℃。1H-NMR (400 MHz,DMSO-d6)δ:3.91 (1H,dd,J=7.2,3.6 Hz,H-1),4.93 (1H,d,J=3.6 Hz,1-OH),4.63 (1H,d,J=7.2 Hz,H-2),6.46 (1H,s,3-OH),4.92(1H,d,J=4.0 Hz,H-6),4.03 (1H,m,H-7),5.61 (1H,d,J=6.2 Hz,7-OH),1.53 (1H,d,J=12.4 Hz,H-8),4.96 (1H,d,J=5.6 Hz,H-10),7.54 (1H,d,J=5.6 Hz,10-OH),6.08 (1H,s,H-12),2.80 (1H,q,J=7.0 Hz,H-14),1.12 (3H,d,J=7.0 Hz,H-16),1.09 (9H,s,t-Bu);13C-NMR (100 MHz,DMSO-d6)δ:74.0 (C-1),92.0(C-2),83.1 (C-3),98.7 (C-4),66.6 (C-5),79.5 (C-6),74.2 (C-7),49.4 (C-8),64.2 (C-9),69.2 (C-10),174.3(C-11),109.7 (C-12),170.6 (C-13),41.8 (C-14),176.7(C-15),8.3 (C-16),32.4 (C-17),29.2 (C-18),29.2 (C-19),29.2 (C-20)。以上数据与文献[19] 报道一致,故鉴定为银杏内酯C。
化合物T3:白色针状结晶 (甲醇),mp 316~317℃。1H-NMR (400 MHz,DMSO-d6)δ:2.91 (1H,d,J=18.4 Hz,H-1),2.77 (1H,d,J=18.4 Hz,H-1),4.90(1H,t,J=7.2 Hz,H-6),2.53 (1H,dd,J=13.6,7.2 Hz,H-7),2.06 (1H,dd,J=13.6,7.2 Hz,H-7),5.40 (1H,s,8-OH),5.13 (1H,d,J=5.2 Hz,H-10),7.25 (1H,d,J=5.2 Hz,10-OH),6.26 (1H,s,H-12),1.04 (9H,s,t-Bu);13C-NMR (100 MHz,DMSO-d6)δ:42.1 (C-1),173.2(C-2),174.3 (C-4),58.0 (C-5),68.2 (C-6),36.0 (C-7),86.0 (C-8),65.8 (C-9),83.1 (C-10),177.6 (C-11),99.3 (C-12),37.3 (C-17),26.8 (C-18),26.8 (C-19),26.8 (C-20)。以上数据与文献[19] 报道一致,故鉴定为白果内酯。
化合物 T4:白色针状结晶 (甲醇),mp 350~351 ℃。1H-NMR (400 MHz,DMSO-d6)δ:2.72 (1H,dd,J=12.5,7.7 Hz,H-1),1.76 (1H,dd,J=15.2,7.7 Hz,H-1),4.80 (1H,t,J=7.7 Hz,H-2),6.32 (1H,s,3-OH),4.92 (1H,s,H-6),2.01 (1H,dd,J=10.5,2.9 Hz,H-7),2.01 (1H,dd,J=10.5,2.9 Hz,H-7),1.68 (1H,t,J=10.5 Hz,H-8),4.92 (1H,d,J=5.2 Hz,H-10),6.78(1H,d,J=5.2 Hz,10-OH),6.00 (1H,s,H-12),2.93(1H,q,J=7.2 Hz,H-14),1.12 (1H,d,J=7.2 Hz,H-16),1.02 (9H,s,t-Bu);13C-NMR (100 MHz,DMSO-d6)δ:36.8 (C-1),88.2 (C-2),86.3 (C-3),110.5 (C-4),68.3 (C-5),85.6 (C-6),36.3 (C-7),49.1 (C-8),67.0(C-9),69.0 (C-10),174.7 (C-11),100.1 (C-12),171.2(C-13),40.7 (C-14),176.8 (C-15),8.6 (C-16),32.4(C-17),29.3 (C-18),29.3 (C-19),29.3 (C-20)。以上数据与文献[19] 报道一致,故鉴定为银杏内酯A。
化合物 T5:白色针状结晶 (甲醇),mp 350~351 ℃。1H-NMR (400 MHz,DMSO-d6)δ:4.05 (1H,dd,J=7.4,3.4 Hz,H-1),4.93 (1H,d,J=3.4 Hz,1-OH),4.62 (1H,d,J=7.4 Hz,H-2),6.45 (1H,s,3-OH),5.31(1H,d,J=3.6 Hz,H-6),1.93 (1H,td,J=14.0,4.0 Hz,H-7),2.13 (1H,dd,J=13.6,4.6 Hz,H-7),1.71 (1H,dd,J=14.0,4.6 Hz,H-8),5.02 (1H,d,J=5.4 Hz,H-10),7.46 (1H,d,J=5.4 Hz,10-OH),6.06 (1H,s,H-12),2.84 (1H,q,J=7.0 Hz,H-14),1.11 (3H,d,J=7.0 Hz,H-16),1.03 (9H,s,t-Bu);13C-NMR (100 MHz,DMSO-d6)δ:74.1 (C-1),92.3 (C-2),83.2 (C-3),98.8(C-4),72.2 (C-5),79.0 (C-6),37.1 (C-7),49.0 (C-8),67.7 (C-9),69.3 (C-10),174.3 (C-11),109.9 (C-12),170.6 (C-13),42.1 (C-14),176.8 (C-15),8.3 (C-16),32.2 (C-17),29.3 (C-18),29.3 (C-19),29.3 (C-20)。以上数据与文献[19] 报道一致,故鉴定为银杏内酯B。
3 讨论
由于银杏内酯具有较强且广泛的药理活性,故对该类化合物进行系统的纯化制备具有重要理论意义和实际价值。为了快速制备高纯度的银杏内酯单体化合物,本实验以银杏叶为原料,经酶解预处理、提取、溶剂萃取、结晶、高压制备液相色谱同时获得高纯度的银杏内酯A、B、C、J 和白果内酯。
银杏内酯是银杏叶主要药用成分,对心血管、神经系统均具有较强的药理活性,一直以来受到众多研究者的青睐,但其含量较低,结构相似,导致分离纯化较为困难。本实验对高压制备液相色谱分离银杏内酯过程中的填料种类和溶剂体系进行筛选,最终选择十八烷基键合硅胶作为制备用填料,甲醇-四氢呋喃-水作为流动相,并采用分流式串联蒸发光散射检测器,从而实现该成分的在线检测和制备。与传统的溶剂萃取、结晶、硅胶柱层析等方法比较,高压制备液相色谱可大幅提高银杏内酯单体制备的效率和收率,所得产品纯度高,有机溶剂用量少,生产成本降低,对工业化生产具有重要的指导意义。
