不同产地吴茱萸质量标记物探究
2021-03-25张倩倩徐云辉韩妮娜张志强华茉莉
张倩倩,周 靖,徐云辉,韩妮娜,张志强,华茉莉*
(1.复旦大学药学院,上海 201203;2.中国医药工业研究总院,上海 201203;3.北京康仁堂药业有限公司,北京 101301)
吴茱萸为历代本草记载的常用药味,药材的植物资源在我国分布较为广泛,秦岭以南区域多有野生或栽培。2020 年版《中国药典》 吴茱萸药材的质量检验项,包括吴茱萸碱、吴茱萸次碱的薄层色谱鉴别,以及吴茱萸碱、吴茱萸次碱与柠檬苦素的含量测定[1]。本课题组前期研究表明,不同产地吴茱萸药材中吴茱萸碱、吴茱萸次碱含量差异悬殊,高低相差超过20 倍,且与品种和产地没有呈现明显相关,已有相关报道也有相似研究结论[2-4]。中药材质量受植物品种以及生长环境影响较大,但归根结底是与其所含药效物质组分密切相关。因此,本研究寻找不同产地吴茱萸药材的质量标记物,对于客观评价吴茱萸药材质量,显得尤为必要。
本研究收集的46 批样品,来自不同产地。采用中药材DNA 条形码技术进行分子鉴定,并与《中国药典》 DNA 条形码鉴定系统比对,确认均为正品吴茱萸。然后,建立UPLC 指纹图谱并进行方法学考察,确定不同产地46 批样品的共有组分;采用UPLC-Q-TOF-MSE 技术结合UNIFI 天然产物数据库软件分析,并与部分化学对照品质谱数据比对,对以上共有组分进行指认;在此基础上,结合相似度评价、聚类分析与偏最小二乘判别分析等化学计量方法从共有组分中筛选出可能与产地相关的差异成分。以不同产地吴茱萸药材的共有组分及其差异成分作为质量相关标记物,以期为进一步完善现行吴茱萸药材的质量评价方法提供参考。
1 材料
Waters AcquityTMUPLC 色谱仪串联Xevo G2-XS Q-TO 质谱仪、Waters Acquity H-Class UPLC 色谱仪(美国Waters 公司);Milli-Q 超纯水机(美国Millipore 公司);FSJ-A03D1 型中药粉碎机(广东顺德小熊电器有限公司);KQ-250 超声清洗仪(昆山舒美超声仪器有限公司)。
甲酸 (LC-MS 级,美国Fisher 公司);乙腈(LC-MS 级,上海阿拉丁生化科技股份有限公司);亮氨酸脑啡肽(LC-MS 级,美国Sigma 公司);超纯水,其他试剂均为分析纯。吴茱萸碱 (批号110802-201710)、吴茱萸次 碱 (批 号 110801-201608)、柠檬苦素(批号110800-201707) 对照品均购自中国食品药品检定研究院;新绿原酸(批 号 ST06230120)、隐绿原酸 (批 号ST07850120)、水仙苷(批号ST10940120) 对照品均购自上海诗丹德有限公司;二氢吴茱萸新碱(批号vkq-01575)、金丝桃苷(批号vkq-00309)、去氢吴茱萸碱(批号vkq-01235)、绿原酸(批号vkq-00358) 对照品均购自四川省维克奇生物科技有限公司。
不同产地46 批吴茱萸药材,由北京康仁堂药业有限公司定点采购,信息见表1。
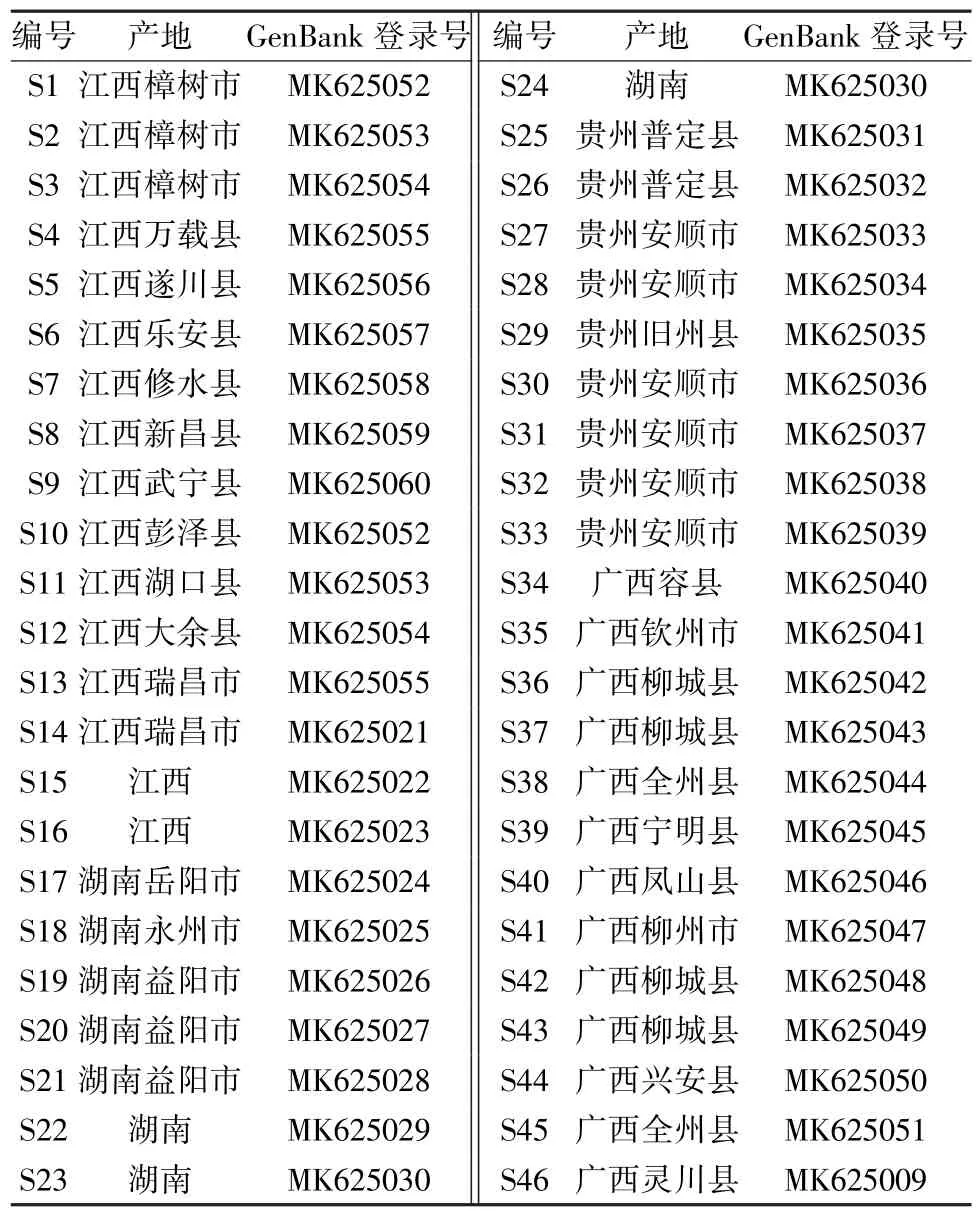
表1 样品信息Tab.1 Information of samples
2 方法与结果
2.1 DNA 条形码鉴定 采用植物基因组DNA 提取试剂盒(DP305,天根生化科技有限公司) 进行各批样品DNA 提取,参照《中药材DNA 条形码分子鉴定法指导原则》 进行ITS2 序列的PCR 扩增[5],PCR 扩增产物采取1% 琼脂糖凝胶电泳检测。委托赛默飞世尔科技有限公司对PCR 产物进行纯化和测序。46 批吴茱萸的DNA 序列已上传至GenBank 数据库,同时上传至中药材DNA 条形码鉴定系统 (http://www.tcmbarcode.cn/china/?optionid=176) 进行比对,均为正品吴茱萸Euodia rutaecarpa(Juss.) Benth.,各批药材GenBank 登录号见表1。
2.2 UPLC 指纹图谱建立
2.2.1 供试品溶液制备 取各批吴茱萸药材样品,粉碎,过40 目筛0.3 g,精密称定,置具塞锥形瓶中,精密加入70%乙醇25 mL,密塞,称定质量,浸泡1 h,超声提取40 min,取出,放冷,再次称定质量,用70%乙醇补足减失质量,摇匀,滤过,取续滤液,即得。
2.2.2 对照品溶液制备 精密称取吴茱萸碱、吴茱萸次碱、柠檬苦素、新绿原酸、隐绿原酸、水仙苷、二氢吴茱萸新碱、去氢吴茱萸碱、金丝桃苷、绿原酸各对照品适量,分别加甲醇溶解,制成1.0 mg/mL的对照品溶液。进行质谱分析时,分别加甲醇稀释至适宜浓度。
2.2.3 色谱条件 Acquity UPLC HSS T3 色谱柱(2.1 mm×150 mm,1.8 μm);流动相乙腈(A) -0.1%三氟乙酸水(B),梯度洗脱(0~3 min,10%A;3~15 min,10%~30% A;15~30 min,30%~100%A;30~35 min,100%~10% A);体积流量0.3 mL/min;柱温35 ℃;检测波长235 nm;进样量5 μL,记录液相色谱图。
2.2.4 方法学考察
2.2.4.1 精密度试验 取吴茱萸(S28) 供试品溶液,在“2.2.3” 项条件下,连续进样6 次,记录色谱图,以吴茱萸碱为参照峰,计算各共有峰的相对保留时间、相对峰面积的RSD 分别小于0.5%、2.9%,表明仪器精密度良好。
2.2.4.2 稳定性试验 取吴茱萸(S28) 供试品溶液,在“2.2.3” 项条件下,分别于0、2、4、8、12、24 h 进样,记录色谱图。以吴茱萸碱为参照峰,计算各共有峰的相对保留时间、相对峰面积RSD 分别小于1.5%、2.9%,表明供试品溶液在24 h 内稳定性良好。
2.2.4.3 重复性试验 取吴茱萸(S28) 粉末,按“2.2.1” 项下方法平行制备6 份供试品溶液,在“2.2.3” 项条件下进样,记录色谱图。以吴茱萸碱为参照峰,计算各共有峰的相对保留时间、相对峰面积RSD 分别小于0.7%、5.0%,表明该方法重复性良好。
2.2.5 指纹图谱结果分析
2.2.5.1 共有峰确定 将以上46 批样品UPLC 色谱图数据导入国家药典委员会“中药指纹图谱评价系统” (2012A 版),由此得到吴茱萸药材的UPLC 指纹图谱叠加图,见图1,对照图谱见图2。以吴茱萸药材中主要质量指标成分吴茱萸碱作为指纹图谱的参比峰,确定不同产地吴茱萸药材有31个共有峰,已确认的共有峰与参比峰的相对保留时间见表3。46 批药材的各共有峰相对保留时间RSD均小于0.8%,重复性好。
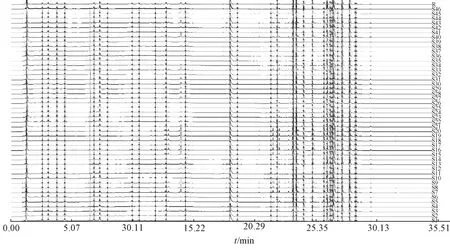
图1 46 批样品UPLC 指纹图谱Fig.1 UPLC fingerprints of forty-six batches of samples
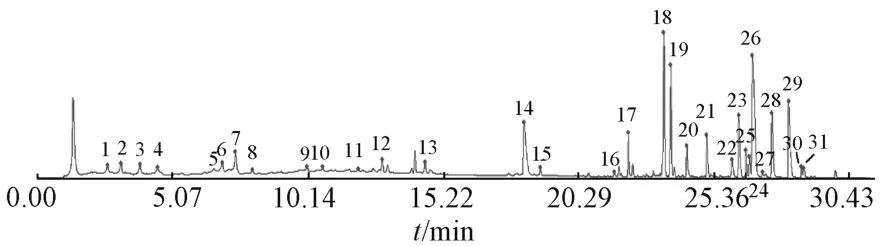
图2 46 批样品对照图谱Fig.2 Control fingerprint spectrum of forty-six batches of samples
2.2.5.2 相似度分析 对46 批各共有峰与吴茱萸碱参比峰的相对峰面积的分析结果显示,RSD 分别为18.24%~89.73%不等,表明不同产地药材中一些共有成分的含量波动较大。
将46 批吴茱萸药材指纹图谱与对照色谱图进行相似度分析,结果见表2。结果显示,不同产地样品的相似度在0.69~0.99 之间,表明采用指纹图谱的相似度分析不宜作为吴茱萸药材的质量评价方法。研究中广西和贵州两地样品的UPLC 指纹图谱相似度均大于0.9,呈现一定的产地相似度,是否由此可研究建立不同产地区分方法,还需积累更多研究数据才能定论。

表2 46 批样品相似度Tab.2 Similarities of forty-six batches of samples
2.2.5.3 聚类分析 为了研究46 批吴茱萸产地与质量关系,采用SIMCA14.1 软件中对共有峰面积进行数据处理,对4 个产地的样品进行层序聚类分析,聚类方法为Ward 离差平方和。系统聚类树表明,46 批样品聚类趋势可分为3 大类,贵州的9 批、湖南和江西各1 批(S25~S33、S24、S5)为第一类,广西产地的12 批吴茱萸(S34~S35,S37~S44) 聚为第二类,江西的15 批、湖南的7批和广西的1 批(S1~S4、S6~23、S36) 的样品可聚为第三类。结果见图3。
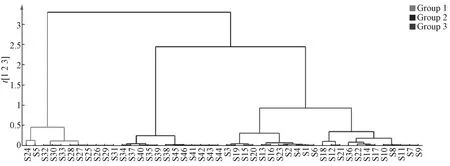
图3 46 批样品聚类树状图Fig.3 Dendrogram of forty-six batches of samples
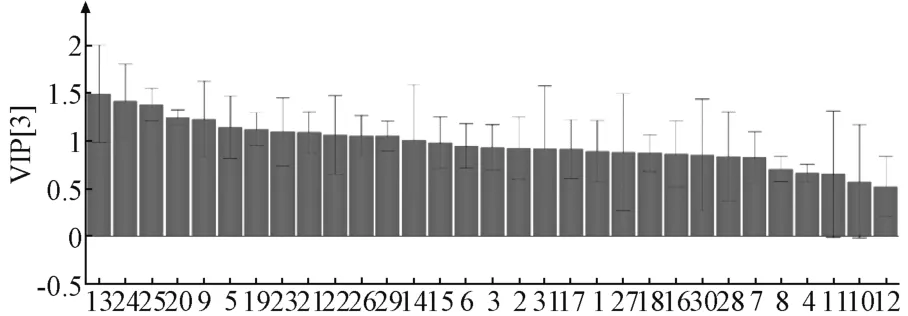
图4 偏最小二乘-判别分析变量重要性投影图Fig.4 VIp scores of partial least squares discrimination analysis
2.2.5.4 偏最小二乘-判别分析 为了进一步探究不同产地样品的差异性,对46 批样品的31 种共有组分采用偏最小二乘-判别分析模型进行拟合分析(SIMCA14.1 软件)。模型参数为R2X=0.755,R2Y=0.864,Q2=0.836,表明模型的准确性与可预测性良好。图4 为变量重要性投影图,表明各个变量对于区分3 个类别的吴茱萸药材的贡献程度。一般认为,VIP 值大于1 的变量存在显著性差异,贡献程度较高,以此为标准,由此筛选出13 种差异性成分,分别为峰13 (水仙苷)、峰24 [1-甲基-2-癸基-4 (1H) -喹诺酮/1-甲基-2-十一烷基-4-喹诺酮]、峰25、峰20 (1-甲基-2-壬 基-4-喹诺酮)、峰9 (柠檬黄素-3-O-β-D-葡萄糖苷)、峰5、峰19 (吴茱萸次碱)、峰23、峰21 [1-甲基-2-[(Z) -6-十一烯基] -4-喹诺酮]、峰22 [1-甲基-2-壬基-4 (1H) -喹诺酮]、峰26、峰29 (吴茱萸新碱) 和峰14 (去氢吴茱萸碱)。
2.3 UPLC-Q-TOF-MSE 鉴定共有峰
2.3.1 鉴定方法 液相色谱系统同“2.2.3” 项下,将流动相中0.1% 三氟乙酸水溶液替换为0.1%甲酸水溶液。电喷雾离子源,正离子模式;质量扫描范围m/z50~1 500;氮气体积流量500 L/h,温度40 0 ℃;电离源温度120 ℃;锥孔气体积流量100 L/h,电压40 V;毛细管电压3 500 V。在MSE模式下,碰撞低能6 eV,碰撞高能25~60 eV。亮氨酸脑啡肽溶液(0.2 ng/mL) 作为外标溶液对质量进行实时校正,校正离子在正离子模式下m/z556.277 1 [M+H]+。
分别精密吸取“2.2.1” “2.2.2” 项下吴茱萸(S28) 供试品溶液、各对照品溶液各2 μL,注入UPLC-QTOF/MS 仪器分析,得到吴茱萸样品总离子流图,见图5。
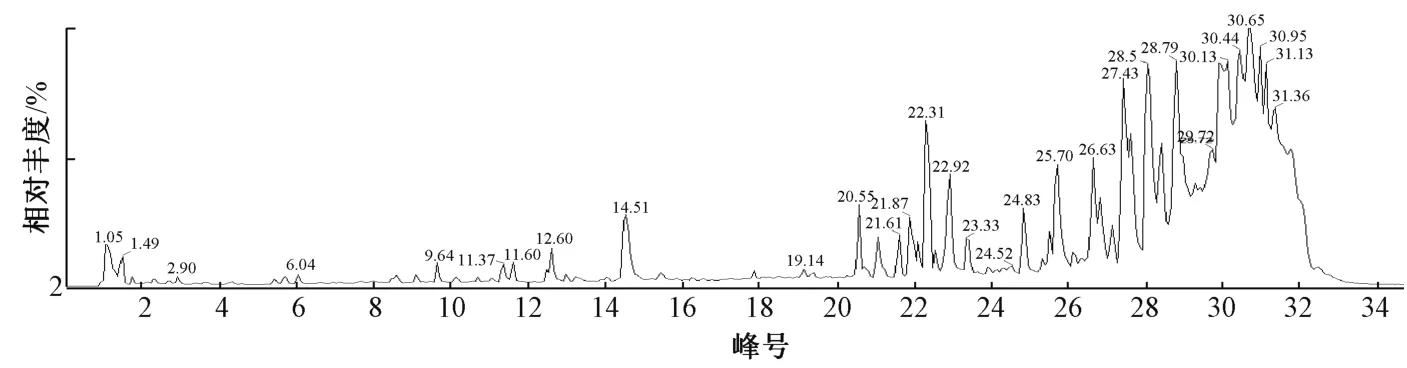
图5 吴茱萸样品总离子流图(正离子模式)Fig.5 Total ion current chromatogram of E.rutaecarpa (positive ion mode)
2.3.2 共有峰推导与指认 利用UNIFI 中自建的吴茱萸药材化学成分数据库进行筛查、鉴定,过滤掉精确质量数误差大于10-5的数据,得到初步的化合物鉴定结果;结合各化合物特征离子的精确质量数、相对保留时间、分子式、对照品信息以及相关文献[6-10],对UPLC 指纹图谱中31 个共有峰进行结构推导。初步确认21 种共有组分,包括3 个有机酸、4 个黄酮苷和14 个生物碱类化合物。其中,10 种共有组分经对照品比对,分别为新绿原酸、绿原酸、隐绿原酸、金丝桃苷、水仙苷、去氢吴茱萸碱、吴茱萸碱、吴茱萸次碱、吴茱萸新碱和二氢吴茱萸新碱。“2.2.5.4” 项下筛选出的13 种差异成分,共推导确认9 个,见表3。

表3 吴茱萸指纹图谱共有峰鉴定Tab.3 Identification of common peaks from E.rutaecarpa fingerprints
3 讨论
本研究建立的吴茱萸药材UPLC 指纹图谱方法,可较好实现药材中各组分的良好分离,且分析时间较短,方法学考察结果显示其稳定可靠。结合指纹图谱的共有峰分析,显示不同产地样品的各共有峰相对保留时间稳定,重现性好;但相对峰面积波动较大,提示共有峰存在明显差异,可能与不同产地药材的质量相关。
开展不同产地样品指纹图谱的共有峰分析,共呈现31 个共有峰,采用UPLC-Q-TOF-MSE 结合UNIFI 软件对其中21 种共有成分进行快速表征鉴别,包含生物碱类成分14 种、黄酮苷类4 种、有机酸类3 种。同时,采用化学计量学方法分析不同产地样品的共有成分,从中筛选出13 种差异化成分,已初步鉴定出9 种,分别为水仙苷、1-甲基-2-癸基-4 (1H) -喹诺酮/1-甲基-2-十一烷基-4-喹诺酮、1-甲基-2-壬基-4-喹诺酮、柠檬黄素-3-O-β-D-葡萄糖苷、吴茱萸次碱、1-甲基-2-[(Z) -6-十一烯基] -4-喹诺酮、1-甲基-2-壬基-4 (1H) -喹诺酮、吴茱萸新碱、去氢吴茱萸碱。
已有研究表明,本研究筛选出的差异化成分与吴茱萸的生物活性存在明显相关,柠檬黄素-3-Oβ-D-葡萄糖苷和吴茱萸次碱是吴茱萸汤治疗偏头痛的药效物质基础[11];吴茱萸新碱、去氢吴茱萸碱具有降压和舒张血管的药理作用[12];多种吴茱萸喹诺酮类生物碱具有抗血管生成及抗菌活性[13-18]。因此,这些差异化组分可一定程度表征吴茱萸药效活性差异,可考虑作为吴茱萸药材的质量标记物。
综上所述,建立吴茱萸药材的指纹图谱,结合共有组分及其差异化成分的质量标记物分析,以期为吴茱萸药材的质量评价提供更丰富信息,为进一步完善现行《中国药典》 吴茱萸药材的质量标准提供参考。
