川芎嗪调控miR-31-5p/Ednrb 通路抑制人肺泡上皮细胞BEAS-2B 凋亡和炎症反应
2021-03-25刘明宗刘于嵩龙国利江宇虹高榕茂
刘明宗,刘于嵩,龙国利,张 钊,江宇虹,高榕茂
(1.四川省医学科学院·四川省人民医院东院ICU,四川成都 610100;2.四川省医学科学院·四川省人民医院东院检验科,四川 成都 610100;3.西南医科大学临床医学院,四川 泸州 646000)
急性肺损伤(acute lung injury,ALI) 和急性呼吸窘迫综合征 (acute respiratory distress syndrome,ARDS) 是一种临床常见病和潜在致死综合征,以肺泡上皮细胞凋亡增加和过度炎症反应为特征[1-2]。近年来,尽管在呼吸生理学方面取得进展,但ALI/ARDS 死亡率仍居高不下。因此,有效控制肺泡上皮细胞异常炎症和凋亡对改善ALI/ARDS 患者预后具有重要意义。川芎嗪(tetramethylpyrazine,TMP) 又叫四甲基吡嗪,是从中药川芎Ligusticum chuanxiongHort.中提取的化合物,其除具有血管舒张和抗血小板活性外,还具抗氧化、抗炎作用,可减轻脂多糖或低密度脂蛋白诱导的内皮细胞炎性损伤[3-5],但川芎嗪对肺泡上皮细胞损伤的作用及潜在机制并未阐明。miR-31 是一种炎性相关微小RNA (microRNA,miRNA),其表达异常与糖尿病肾病、脊髓损伤等疾病进展有关[6-7]。生物信息学分析显示内皮素受体B (endothelin receptor B,Ednrb) 是miR-31-5p的潜在靶基因。Ednrb 在慢阻肺患者中表达增加,抑制Ednrb 表达通过抑制炎症反应可抑制慢阻肺进展[8]。于是推测川芎嗪对肺泡上皮细胞的抗炎和抗凋亡作用可能与调控miR-31-5p/Ednrb 通路有关。因此,本研究以脂多糖(lipopolysaccharide,LPS) 体外诱导人肺泡上皮细胞BEAS-2B 构建炎症模型[9],探讨川芎嗪对miR-31-5p和Ednrb 表达以及BEAS-2B 细胞凋亡和炎症反应的影响,以期为川芎嗪在ALI/ARDS 辅助治疗中的应用提供理论依据。
1 材料
1.1 细胞 人正常肺上皮细胞BEAS-2B 购于美国模式培养物保藏中心(American Type Culture Collection,ATCC)。
1.2 试剂 杜尔伯格伊戈尔培养液(DMEM)、胎牛血清购于美国Hyclone 公司;脂多糖购于美国Sigma 公 司。川芎嗪 (纯 度≥98%,批 号20181012) 购于上海源叶生物科技有限公司。模拟物对照(miR-con)、miR-31-5p模拟物(miR-31-5pmimics)、小干扰RNA 对照(si-con)、Ednrb 小干 扰 RNA (si-Ednrb)、Ednrb 过表达载 体(pcDNA-Ednrb)、空载体质粒(pcDNA)、miRNA抑制物对照 (anti-miR-con)、miR-31-5p抑制物(anti-miR-31-5p) 由南京金斯瑞生物科技有限公司提供;膜联蛋白V 异硫氰酸荧光素(Annexin VFITC)/碘化丙啶(PI) 细胞凋亡检测试剂盒(批号20181213)、Trizol 试剂(批号20190105)、二喹啉甲酸(BCA) 试剂盒(批号20190215) 购于上海碧云天生物科技有限公司;肿瘤坏死因子-α(TNF-α) (批号20181205)、白细胞介素1β (IL-1β)、白细胞介素6 (IL-6) (批号20190121) 酶连免疫吸附试验(ELISA) 检测试剂盒购于南京建成生物工程研究所;兔源Ednrb (批号20190201)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved caspase-3) (批号20181211)、B 细胞淋巴瘤/白血病-2 (Bcl-2) (批号20190207)、Bcl-2相关X 蛋白(Bax) (批号20190217)、β-actin 抗体(批号20181225)、山羊抗兔Ⅱ抗 (批号20181114) 购于美国Abcam 公司。
1.3 统计学分析 通过SPSS 18.0 软件进行处理,数据以() 表示,2 组间比较采用t检验,多组间比较采用单因素方差分析,组间进一步比较采用SNK-q 检验。P<0.05 表示差异具有统计学意义。
2 方法
2.1 细胞培养和实验分组 采用DMEM 培养基(含10% 的胎牛血清) 常规培养BEAS-2B 细胞,48 h显微镜下观察细胞生长状态,进行传代培养。取对数期细胞进行实验,调整细胞密度为2×105个/mL,按照2 mL/孔接种到6 孔板,实验分组如下。对照组:正常培养的BEAS-2B 细胞。LPS组:采用终浓度为1 μg/mL 的LPS 处理BEAS-2B细胞24 h。LPS+川芎嗪5 μmol/L 组、LPS+川芎嗪20 μmol/L 组、LPS+川芎嗪80 μmol/L 组:采用终浓度为5、20、80 μmol/L 的川芎嗪作用2 h 后,给予1 μg/mL 的LPS 刺激24 h。LPS+miR-con 组、LPS+miR-31-5p 组、LPS+si-con 组、LPS+si-Ednrb组:利用脂质体LipofectamineTM2000 将miR-con、miR-31-5pmimics、si-con、si-Ednrb 分别转染BEAS-2B 细胞后按照上述方式进行LPS 刺激。LPS+川芎嗪+pcDNA 组、LPS+川芎嗪+pcDNA-Ednrb组:将pcDNA、pcDNA-Ednrb 分别转染BEAS-2B细胞后按照上述方式进行川芎嗪(80 μmol/L) 和LPS 处理。
2.2 流式细胞术检测细胞凋亡 收集按照上述方式进行干预处理的各组细胞,PBS 液洗涤细胞2次,加入结合缓冲液调整细胞密度为1×106个/mL。取100 μL 细胞悬液加入到流式管,按照细胞凋亡检测试剂盒说明书分别加入5 μL 的Annexin VFITC 和5 μL 的PI,室温条件避光孵育15 min,随后立即上机检测细胞凋亡情况。
2.3 ELISA 试剂盒检测细胞培养液中TNF-α、IL-1β 和IL-6 水平 各组细胞上述方式进行干预处理后,吸取细胞培养液上清,采用ELISA 试剂盒分别测定细胞培养液中TNF-α、IL-1β 和IL-6 含量。步骤如下:向反应孔内加入100 μL 的待检测样品或标准品,空白孔调零后,于450 nm 波长处检测各孔吸光度值,根据标准品计算TNF-α、IL-1β 和IL-6 水平。
2.4 RT-qPCR 检测miR-31-5p和EdnrbmRNA 表达 收集按照上述方式进行干预处理的各组细胞,参照Trizol 说明书提取各组细胞总RNA,采用DNA 酶除去DNA 影响后,逆转录试剂盒合成cDNA。合成PCR 引物进行RT-qPCR 扩增。引物序列分别为miR-31-5p正向5′-GCGCAGGCAAGATGCTGG-3′,反向5′-GTGCAGGGTCCGAGGT-3′;U6正向5′-CTCGCTTCGGCAGCACATATACT-3′,反 向5′-ACGCTTCACGAATTTGCGTGTC-3′;Ednrb正 向5′-GGTTGTGTCCTGCCTTGTGTT-3′,反向5′-TTCGCATGCACTTGTTCTTGT-3′;β-actin正 向 5′-AAGATGA-CCCAGATCATGTTTGAG-3′,反 向 5′-TAGATGGGCACAGTGTGGGTG-3′。以cDNA 为 模板,采用SYBR 染料进行标记,于ABI 7500 上进行PCR 检测。分别以U6 和β-actin为内参,按照2-ΔΔCt法计算miR-31-5p和EdnrbmRNA 表达水平。
2.5 Western blot 检测Ednrb、Cleaved caspase-3、Bcl-2、Bax 蛋白表达 各组细胞上述方式进行干预处理后,BCA 法测定蛋白浓度。将蛋白样本和5×上样缓冲液混合1 ∶4 混合配置上样终液,100 ℃变性3 min,按照每孔到30 μg 细胞蛋白进行聚丙烯酰胺凝胶电泳。常规湿法转膜后将膜置于5%的脱脂牛奶中室温条件封闭1 h,加入稀释的Ⅰ抗后4 ℃侧摆摇床孵育过夜,回收Ⅰ抗后,TBST 洗膜3次,每次10 min。然后加入稀释的Ⅰ抗室温孵育2 h,TBST 洗膜3 次,每次10 min。配制化学发光显色液暗室内显色,ImageJ 软件分析目的条带的灰度值。
2.6 双荧光素酶报告基因实验验证miR-31-5p靶向调控 Ednrb 表达生物信息学分析工具Targetscan 预测显示miR-31-5p与Ednrb 的3’ -UTR区域存在部分特异性结合的核苷酸序列,推测miR-31-5p 可能靶向调控Ednrb 表达并进行验证。含有Ednrb 的3’ -UTR 的野生型荧光素酶报告基因载体(WT-Ednrb) 和突变型荧光素酶报告基因载体(MUT-Ednrb) 由上海吉玛制药公司构建。将miR-con、miR-31-5pmimics 分别与WT-Ednrb、MUT-Ednrb 共转染至BEAS-2B 细胞,转染48 h双荧光素酶报告基因试剂盒测定各组细胞的荧光素酶活性。为验证miR-31-5p 对Ednrb 的调控作用,分别将miR-con、miR-31-5pmimics、anti-miRcon、anti-miR-31-5p转 染 BEAS-2B 细 胞,转 染48 h,按“2.5” 项下方法测定Ednrb 蛋白表达水平。
3 结果
3.1 川芎嗪抑制BEAS-2B 细胞凋亡和炎症因子分泌 与对照组比较,LPS 组BEAS-2B 细胞Cleaved caspase-3 和Bax 蛋白表达增加,Bcl-2 蛋白表达降低,细胞凋亡率升高,细胞培养液中IL-1β、IL-6和TNF-α 的浓度增加(P<0.01);与LPS 组比较,LPS+川芎嗪5 μmol/L 组、LPS+川芎嗪20 μmol/L组、LPS +川芎嗪80 μmol/L 组BEAS-2B 细胞Cleaved caspase-3 和Bax 蛋白表达降低,Bcl-2 蛋白表达增加,细胞凋亡率降低,细胞培养液中IL-1β、IL-6 和TNF-α 的浓度降 低 (P<0.05,P<0.01)。见表1、图1。
表1 川芎嗪抑制BEAS-2B 细胞凋亡和炎症因子分泌(, n=9)Tab.1 BEAS-2B inhibited cell apoptosis and inflammatory factor secretion by TMP (, n=9)

表1 川芎嗪抑制BEAS-2B 细胞凋亡和炎症因子分泌(, n=9)Tab.1 BEAS-2B inhibited cell apoptosis and inflammatory factor secretion by TMP (, n=9)
注:与对照组比较,**P<0.01;与LPS 组比较,#P<0.05,##P<0.01。
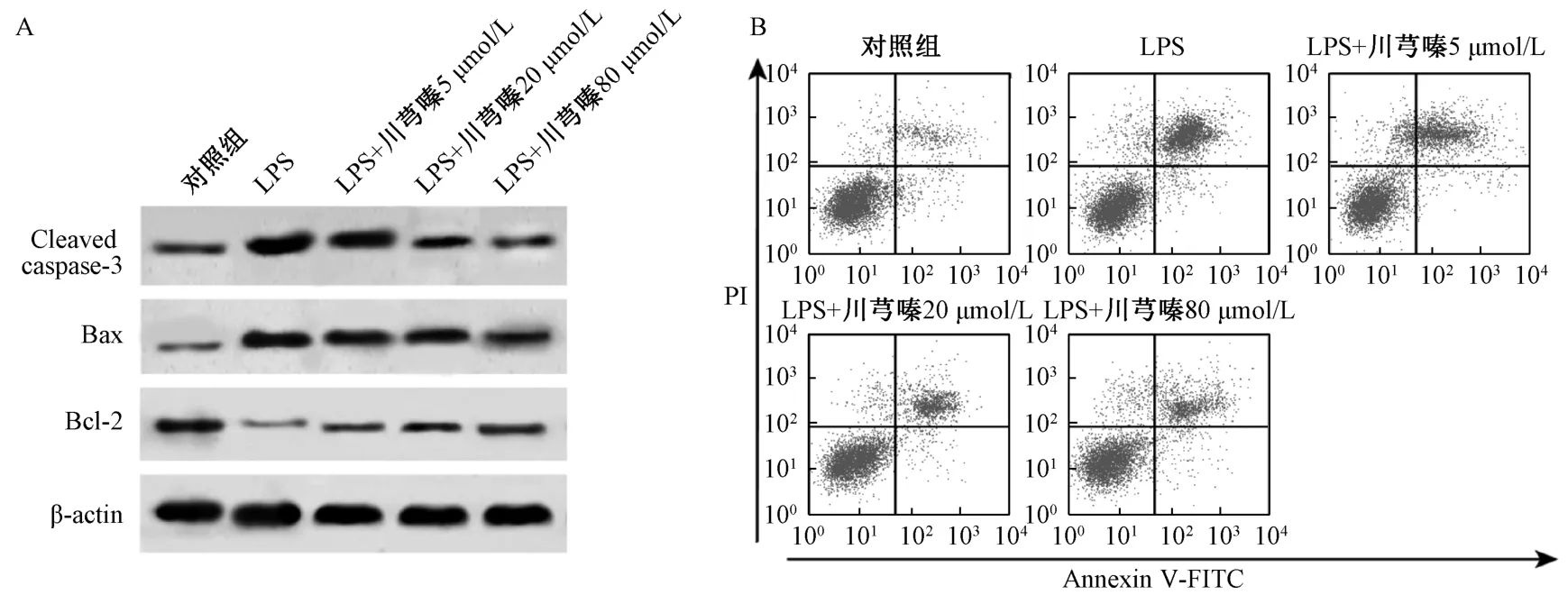
图1 川芎嗪抑制BEAS-2B 细胞凋亡Fig.1 TMP inhibited BEAS-2B cell apoptosis
3.2 川芎嗪影响BEAS-2B 细胞miR-31-5p 和Ednrb基因及蛋白表达 与对照组比较,LPS 组BEAS-2B细胞miR-31-5p 表达降低,EdnrbmRNA 和Ednrb 蛋白表达增加(P<0.01);与LPS 组比较,LPS+川芎嗪5 μmol/L 组、LPS+川芎嗪20 μmol/L组、LPS+川芎嗪80 μmol/L 组BEAS-2B 细胞miR-31-5p表达升高,EdnrbmRNA 和Ednrb 蛋白表达降低 (P<0.05,P<0.01)。见表2、图2。
表2 川芎嗪影响BEAS-2B 细胞miR-31-5p 和Ednrb 基因表达(, n=9)Tab.2 TMP impacts gene expressions of miR-31-5p and Ednrb in BEAS-2B cells (, n=9)
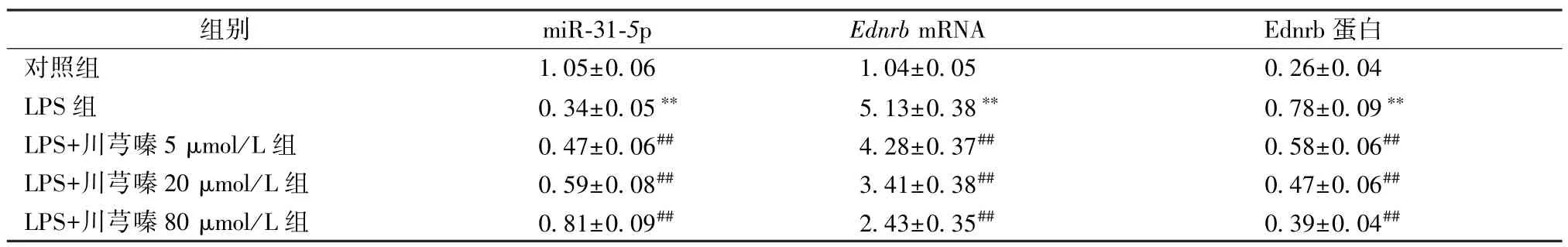
表2 川芎嗪影响BEAS-2B 细胞miR-31-5p 和Ednrb 基因表达(, n=9)Tab.2 TMP impacts gene expressions of miR-31-5p and Ednrb in BEAS-2B cells (, n=9)
注:与对照组比较,**P<0.01;与LPS 组比较,##P<0.01。
3.3miR-31-5p靶向调控Ednrb 表达 采用生物信息学分析工具Targetscan 进行靶基因预测,发现miR-31-5p、Ednrb 之间存在部分连续互补的核苷酸序列,见图3A。双荧光素酶报告显示,与miR-con和WT-Ednrb 共转染组比较,miR-31-5p和WTEdnrb 共转染组BEAS-2B 细胞荧光素酶活性降低(P<0.01);与miR-con 和MUT-Ednrb 共转染组比较,miR-31-5p 和MUT-Ednrb 共转染组BEAS-2B 细胞荧光素酶活性变化无统计学意义(P>0.05),见表3。上 调miR-31-5p表达后,BEAS-2B 细 胞Ednrb 蛋白表达降低;下调miR-31-5p 表达后BEAS-2B 细胞Ednrb 蛋白表达增加(P<0.01),见表4、图3B。

图2 Western blot 检测BEAS-2B 细胞中Ednrb 蛋白表达Fig.2 Detection of expressions of Ednrb protein in BEAS-2B cells by Western blot
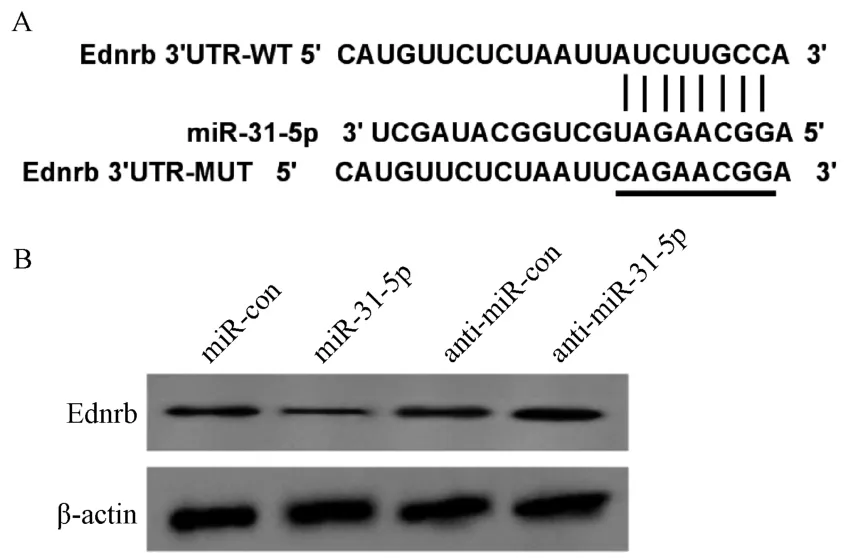
图3 miR-31-5p 靶向调控Ednrb 表达Fig.3 Targeted regulation on Ednrb expression by miR-31-5p
表3 双荧光素酶报告实验(, n=9)Tab.3 Report of Dual luciferase experiment (, n=9)

表3 双荧光素酶报告实验(, n=9)Tab.3 Report of Dual luciferase experiment (, n=9)
注:与miR-con 组比较,**P<0.01。
表4 miR-31-5p 调控Ednrb 蛋白表达(, n=9)Tab.4 Regulation of Ednrb protein expression by miR-31-5p (, n=9)

表4 miR-31-5p 调控Ednrb 蛋白表达(, n=9)Tab.4 Regulation of Ednrb protein expression by miR-31-5p (, n=9)
注:与miR-con 组比较,** P <0.01;与anti-miR-con 组比较,##P<0.01。
3.4 过表达miR-31-5p对BEAS-2B 细胞凋亡和炎症因子分泌的影响 与LPS+miR-con 组比较,LPS+miR-31-5p组BEAS-2B 细胞miR-31-5p表达升高,Cleaved caspase-3 和Bax 蛋白表达降低,Bcl-2蛋白表达增加,细胞凋亡率降低,细胞培养液中IL-1β、IL-6 和TNF-α 的浓度降低(P<0.01)。见表5、图4。
表5 过表达miR-31-5p 对BEAS-2B 细胞凋亡和炎症因子分泌的影响(, n=9)Tab.5 Effects of miR-31-5p overexpression on BEAS-2B cell apoptosis and inflammatory factor secretion (, n=9)
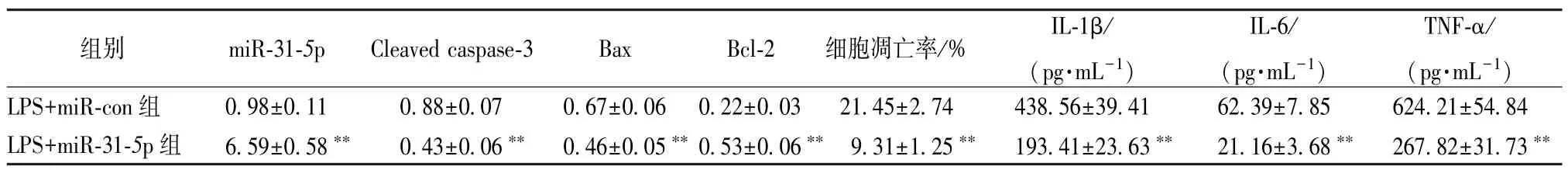
表5 过表达miR-31-5p 对BEAS-2B 细胞凋亡和炎症因子分泌的影响(, n=9)Tab.5 Effects of miR-31-5p overexpression on BEAS-2B cell apoptosis and inflammatory factor secretion (, n=9)
注:与LPS+miR-con 组比较,**P<0.01。
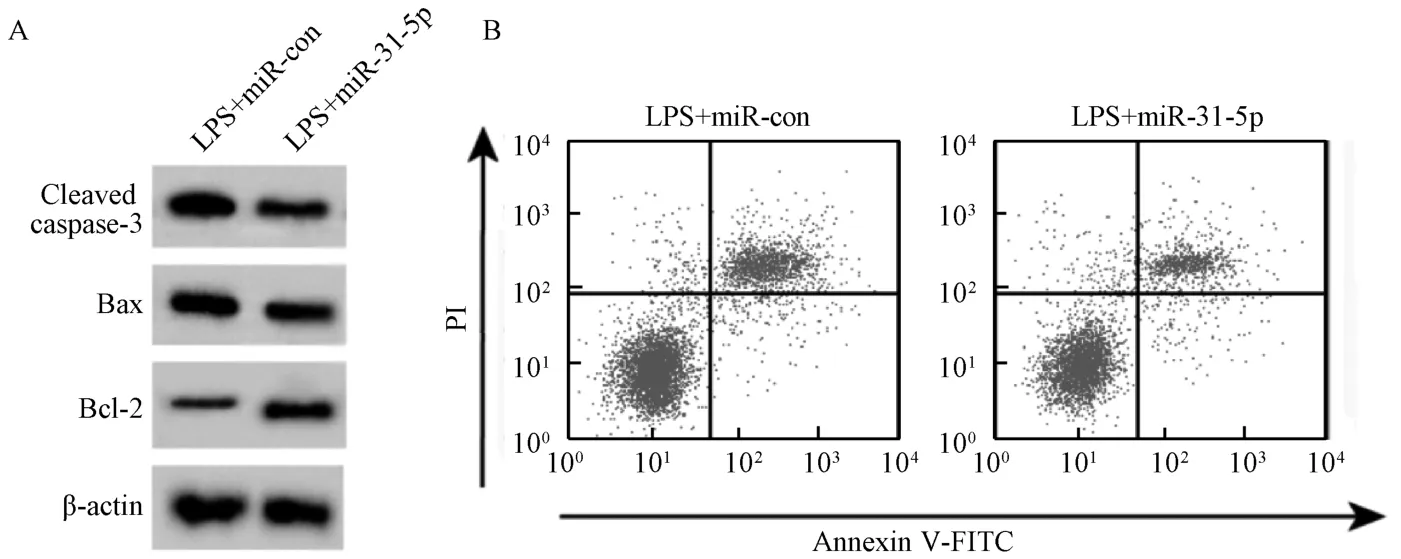
图4 过表达miR-31-5p 对BEAS-2B 细胞凋亡和炎症因子分泌的影响Fig.4 Effects of miR-31-5p overexpression on apoptosis and secretion of inflammatory factors in BEAS-2B cells
3.5 沉默Ednrb 对BEAS-2B 细胞凋亡和炎症因子分泌的影响 与LPS+si-con 组比较,LPS+si-Ednrb组BEAS-2B 细胞Ednrb 蛋白表达降低,Cleaved caspase-3 和Bax 蛋白表达降低,Bcl-2 蛋白表达增加,细胞凋亡率降低,细胞培养液中IL-1β、IL-6和TNF-α 水平降低(P<0.01),见表6、图5。
表6 沉默Ednrb 对BEAS-2B 细胞凋亡和炎症因子分泌的影响(, n=9)Tab.6 Effects of silencing Ednrb on BEAS-2B cell apoptosis and secretion of inflammatory factors (, n=9)

表6 沉默Ednrb 对BEAS-2B 细胞凋亡和炎症因子分泌的影响(, n=9)Tab.6 Effects of silencing Ednrb on BEAS-2B cell apoptosis and secretion of inflammatory factors (, n=9)
注:与LPS+si-con 组比较,**P<0.01。
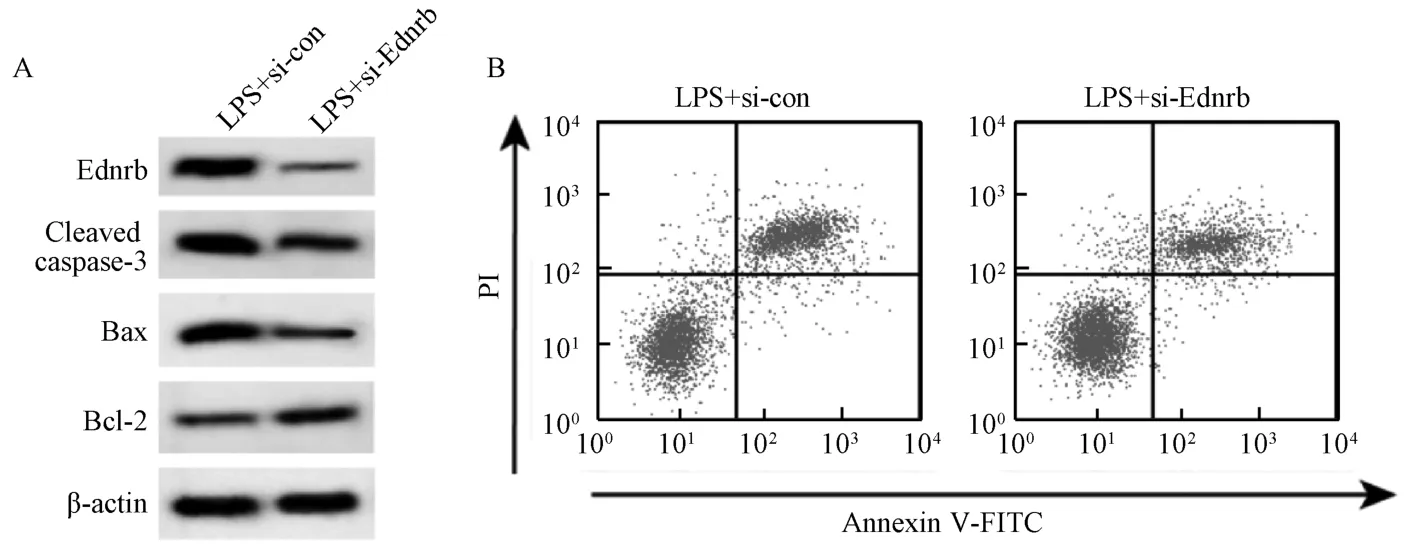
图5 沉默Ednrb 对BEAS-2B 细胞凋亡和炎症因子分泌的影响Fig.5 Effects of Ednrb silencing on BEAS-2B cell apoptosis and secretion of inflammatory factors
3.6 过表达Ednrb 部分逆转川芎嗪对BEAS-2B 细胞凋亡和炎症因子分泌的影响 与LPS+川芎嗪+pcDNA 组比较,LPS+川芎嗪+pcDNA-Ednrb 组BEAS-2B 细胞 Ednrb 蛋白表达升高,Cleaved caspase-3 和Bax 蛋白表达增加,Bcl-2 蛋白表达降低,细胞凋亡率升高,细胞培养液中IL-1β、IL-6和TNF-α 水平增加(P<0.01),见表7、图6。
表7 过表达Ednrb 部分逆转川芎嗪对BEAS-2B 细胞凋亡和炎症因子分泌的影响(, n=9)Tab.7 Partially reversed TMP’ s effects on apoptosis and secretion of inflammatory factors in BEAS-2B cells by Ednrb overexpression (, n=9)

表7 过表达Ednrb 部分逆转川芎嗪对BEAS-2B 细胞凋亡和炎症因子分泌的影响(, n=9)Tab.7 Partially reversed TMP’ s effects on apoptosis and secretion of inflammatory factors in BEAS-2B cells by Ednrb overexpression (, n=9)
注:与LPS+川芎嗪+pcDNA 组比较,**P<0.01。
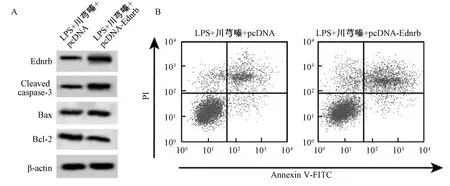
图6 过表达Ednrb 部分逆转川芎嗪对BEAS-2B 细胞凋亡和炎症因子分泌的影响Fig.6 Partially reversed TMP’s effects on apoptosis and secretion of inflammatory factors in BEAS-2B cells by Ednrb overexpression
4 讨论
川芎嗪是川芎提取物的主要活性成分之一,近年来其除用于心脑血管疾病治疗外,其在肺损伤中的潜在作用也被逐步揭示。Liu 等[10]研究显示川芎嗪可抑制内质网应激蛋白激酶诱导的肺微血管内皮细胞凋亡,对脓毒症诱发的ALI 具有治疗作用;Meng 等[11]研究指出川芎嗪可能通过减弱细胞凋亡进而保护钝性胸外伤所致的肺损伤;此外,川芎嗪还可提高机体抗氧化能力活性保护肺组织免受烫伤所致的伤害[12]。与上述保护作用一致,本研究显示川芎嗪干预可下调促凋亡蛋白Cleaved caspase-3、Bax 表达,上调抗凋亡蛋白Bcl-2 表达,减轻LPS诱导的BEAS-2B 细胞凋亡。TNF-α 是ALI 中重要的细胞因子,其可诱导IL-6 的释放,增强中性粒细胞对血管内皮的黏附,加剧机体炎症反应,抑制TNF-α、IL-1β 和IL-6 的分泌可减轻ALI 大鼠肺部损伤[13]。本研究显示川芎嗪干预可减轻LPS 诱导的BEAS-2B 细胞TNF-α、IL-1β 和IL-6 的分泌,抑制BEAS-2B 细胞炎症反应。提示川芎嗪通过抑制肺泡上皮细胞凋亡和炎症反应发挥ALI/ARDS 治疗作用。
miR-31 是一种具有多效作用的miRNA,在食管鳞癌[14]、宫颈癌[15]、结直肠癌[16]等多种人类恶性肿瘤中高表达发挥癌基因作用。在结肠炎中miR-31 表达上调,结肠内给予miR-31 抑制剂恢复抗炎因子IL-25 表达阻断Th1/Th17 介导的炎症反应是一种潜在的克罗恩病治疗方法[18]。然而,在2 型糖尿病性肾病患者中miR-31 表达降低,且miR-31 表达与白细胞黏附、炎性因子TNF-α 和IL-6 分泌呈负相关,血清miR-31 水平是2 型糖尿病性肾病的潜在生物标志物[5]。Targetscan 靶基因预测显示miR-31-5p与Ednrb之间存在相互作用,研究显示慢性阻塞性肺病患者Ednrb 表达明显升高,南蛇藤醇通过抑制Ednrb/Kng1 信号通路抑制香烟烟雾引起的细胞炎症,减轻慢性阻塞性肺疾病。但miR-31-5p/Ednrb 对LPS 诱导的肺泡上皮细胞损伤的影响尚未可知。LPS 干预后检测miR-31-5p和Ednrb 表达发现,miR-31-5p表达降低,Ednrb 表达升高,而川芎嗪呈剂量依赖性地抑制LPS 诱导的Ednrb 表达,促进miR-31-5p表达。进一步研究发现miR-31-5p靶向负性调控Ednrb 表达,过表达miR-31-5p 或沉默Ednrb 均可减轻LPS 诱导的BEAS-2B 细胞凋亡以及促炎因子TNF-α、IL-1β 和IL-6 的分泌,与川芎嗪的作用一致。进一步研究发现过表达Ednrb 可部分逆转川芎嗪对LPS 诱导的肺泡上皮细胞凋亡和炎症反应的保护作用。这些结果表明川芎嗪对LPS 诱导的肺泡上皮细胞损伤的保护作用与调控miR-31-5p/Ednrb 通路有关。
综上所述,川芎嗪通过上调miR-31-5p/Ednrb通路抑制人肺泡上皮细胞BEAS-2B 凋亡和炎症反应,为其在ALI/ARDS 辅助治疗中的应用奠定理论依据。
