LncRNA SNHG11对高糖诱导的人视网膜色素上皮细胞上皮间质转化及增殖、迁移的影响
2021-03-18杨静杨堃2孟旭霞王一博
杨静 杨堃2 孟旭霞 王一博
(青岛大学附属医院,山东 青岛 266500 1 眼科; 2 中心实验室)
糖尿病视网膜病变(DR)是糖尿病最常见、最严重的微血管并发症,在世界范围内因DR导致视力受损或丧失的患者正在逐年增加[1-2]。DR的病理机制与高血糖对视网膜微血管组织的影响有关[3]。高血糖可导致多元醇代谢途径异常、晚期糖基化终末产物(AGEs)积累、蛋白激酶C(PKC)激活、氧化应激增强、细胞因子失衡[4]。多种因素相互作用,使得内皮细胞和视网膜色素上皮细胞(RPE)分别建立的内层及外层血视网膜屏障(BRB)功能受损,加速DR的进展。
长链非编码RNA(LncRNAs)是一类长度超过200个核苷酸的RNA,由于缺乏完整的开放阅读框(ORF)而无蛋白质编码功能,但可通过多种不同的机制参与蛋白质编码基因和表观遗传基因的表达调控[5]。近年来LncRNA在眼部疾病发生发展中的作用及其机制受到越来越多的关注。小核仁宿主基因11(SNHG11)是一种新发现的LncRNA,被认为是前列腺癌和卵巢癌的预后标志物[6]。也有研究证实SNHG11作为胶质瘤的癌基因,可通过调节上皮-间质转化(EMT)来抑制细胞的增殖、侵袭以及迁移[7]。但目前尚未有研究SNHG11与DR关系的报道。
EMT是完全极化的细胞通过基底表面进入基底膜的生理或病理过程,经历多种形态和功能的改变,从而获得间质表型[8]。当机体在炎症、伤口愈合和癌变等病理情况下EMT可被激活,此时细胞的迁移、侵袭及抗凋亡的能力增强[9]。既往研究表明,高血糖诱导培养的RPE可发生EMT[10]。本研究旨在探讨SNHG11在高糖诱导的ARPE-19细胞EMT及增殖、迁移中的作用。
1 材料与方法
1.1 实验材料
ARPE-19 细胞购买于武汉生物细胞库,普通DMEM培养基、高糖型DMEM培养基以及胎牛血清、胰蛋白酶、Annexin V-FITC 细胞凋亡检测试剂盒均购买于大连美仑生物技术有限公司。荧光定量PCR试剂盒、细胞裂解液、反转录试剂盒以及TB GreenTMPremix Ex TaqTMⅡ试剂盒均购自日本TaKaRa 公司。荧光定量PCR所用引物由华大基因合成,Si-SNHG11由上海吉玛基因化学技术有限公司设计合成,脂质体LipofectamineTM3000购自美国 Invitrogen公司。
1.2 实验方法
1.2.1细胞处理及分组 RPE系ARPE-19细胞常规培养于含体积分数0.10胎牛血清DMEM/F12培养基中,置于37 ℃、含体积分数0.05 CO2的恒温箱中培养。每1~2 d换一次新鲜培养液,细胞融合至90%左右时,胰蛋白酶消化传代,取对数生长期的细胞进行分组并给予不同条件进行处理。低糖对照组:用5.5 mmol/L葡萄糖处理48 h;高渗对照组:使用60.0 mmol/L甘露醇处理48 h;高糖干预组:使用60.0 mmol/L的葡萄糖处理48 h;si-NC组:将si-conSNHG11转染至ARPE-19细胞以后,使用60.0 mmol/L的葡萄糖处理48 h;siSNHG11组:将siSNHG11转染至ARPE-19细胞以后,再使用60.0 mmol/L葡萄糖处理48 h。
1.2.2实时荧光定量PCR检测各组细胞SNHG11的表达 各组细胞按分组条件培养48 h后提取总RNA,再反转录成cDNA。按照荧光定量试剂盒使用说明进行PCR,每个样品设3个复孔,反应总体系为20 μL。循环条件为:95 ℃预变性3 min;95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共进行40个循环。以GAPDH为内参照。GAPDH上游引物序列5′-CA-AAACAGCCTCAAGATCATCA-3′,下游引物序列5′-GACTGTGGTCATGAGTCCTTCCA-3′。定量分析结果以荧光强度(CT)值表示,待测基因表达水平以GAPDH作为参比,待测基因的相对表达量用2-△△CT计算,实验重复3次,取均值。
1.2.3Western blot实验检测各组细胞EMT标记物蛋白的表达 各组细胞按分组条件培养48 h后,收集细胞,提取总蛋白,BCA试剂盒测定蛋白浓度,加入5×Loading buffer以后高温加热10 min使蛋白变性。按照SDS-PAGE凝胶试剂盒说明书配置150 g/L的分离胶及50 g/L的浓缩胶,电泳、转膜,以50 g/L脱脂奶粉室温封闭2 h,再分别加入一抗 E-钙黏蛋白(E-cad)、紧密连接蛋白(ZO-1)、波形蛋白(Vimentin)、α-平滑肌肌动蛋白(α-SMA),4 ℃孵育过夜,Tris盐吐温缓冲液(TBST)洗膜。加入二抗室温孵育90 min,TBST洗涤3次,ECL化学发光液显像,使用Image J软件分析各组蛋白条带的灰度值。蛋白相对表达量=目的条带灰度值/GAPDH条带灰度值,结果取3次重复实验的均值。
1.2.4CCK8实验检测细胞活力 将生长状态良好、处于对数期的ARPE-19细胞接种于96孔板中,待细胞密度达到40%~60%时,将细胞按实验要求分为低糖对照组、高渗对照组、高糖干预组、si-NC组、si-SNHG11组,各组细胞按分组条件培养48 h后,分别加入5 g/L CCK8溶液20 μL,37 ℃培养箱中孵育4 h,吸去培养液。酶标仪检测490 nm波长处吸光度(A)值,细胞存活率=(A实验组/A对照组)×100%,结果取3次重复实验的均值。
1.2.5细胞划痕实验检测细胞迁移能力 将生长状态良好、处于对数期的ARPE-19细胞接种于6孔板中,待细胞密度达到40%~60%时,使用无菌200 μL移液枪头垂直于培养板底画“一”字水平划痕,形成一个无细胞区,PBS洗涤3次去除离壁漂浮的细胞,将细胞按实验要求分为低糖对照组、高渗对照组、高糖干预组、si-NC组、si-SNHG11组,每组细胞设3个复孔,在培养后第0、48 h使用倒置相差显微镜拍照,采用Image J图像分析软件分别测量初始无细胞区面积与当前无细胞区面积,细胞相对迁移面积=(初始无细胞区面积-当前无细胞区面积)/48 h无细胞区面积×100%。
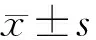
2 结 果
2.1 各组ARPE-19细胞中SNHG11基因相对表达量变化
低糖对照组、高渗对照组以及高糖干预组SNHG11基因相对表达量比较差异具有统计学意义(F=44.27,P<0.01);低糖对照组与高渗对照组相比,差异无统计学意义(P>0.05);高糖干预组SNHG11相对表达量显著高于低糖对照组、高渗对照组(t=7.86、6.19,P<0.05)。si-SNHG11组中SNHG11基因相对表达量与si-NC组比较显著升高(t=18.62,P<0.01)。见表1。
2.2 各组ARPE-19细胞相对迁移面积比较
低糖对照组、高渗对照组、高糖干预组相对迁移面积比较差异均具有统计学意义(F=9.14,P<0.05);高糖干预组48 h的相对迁移面积显著高于低糖对照组、高渗对照组(t=3.99、2.96,P<0.05);低糖对照组与高渗对照组进行比较差异无显著性(P>0.05)。si-SNHG11组48 h的相对迁移面积显著小于si-NC组(t=10.09,P<0.05)。见表1。
2.3 各组ARPE-19细胞存活率比较
低糖对照组、高渗对照组、高糖干预组细胞存活率相比差异具有统计学意义(F=7.71,P<0.05);高糖干预组细胞存活率显著高于低糖对照组、高渗干预组(t=3.18、4.74,P<0.05);低糖对照组与高渗对照组进行比较差异并无显著性(P>0.05)。si-SNHG11组细胞存活率显著低于si-NC组,差异具有显著性(t=5.37,P<0.05)。见表1。
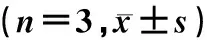
表1 各组SNHG11相对表达量、相对迁移面积、细胞存活率比较
2.4 各组ARPE-19细胞中EMT标志物的蛋白表达量比较
低糖对照组、高渗对照组、高糖干预组E-cad、ZO-1、Vimentin、α-SMA的表达量比较差异均具有显著性(F=5.48~124.41,P<0.05);高糖干预组中Vimentin、α-SMA的表达量显著高于低糖对照组、高渗对照组,差异具有统计学意义(P<0.05);低糖对照组与高渗对照组相比,Vimentin、α-SMA的表达量无明显差异(P>0.05)。高糖干预组中E-cad、ZO-1的表达量显著低于低糖对照组、高渗对照组(P<0.05);低糖对照组与高渗对照组相比,E-cad以及ZO-1的表达量并没有明显的差异(P>0.05)。
si-SNHG11组中E-cad及ZO-1的表达量显著高于si-NC组(t=3.15、3.34,P<0.05);同时Vimentin以及α-SMA的表达量显著低于si-NC组(t=3.30、13.44,P<0.05)。见表2、图1。
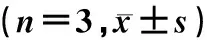
表2 各组EMT标志物蛋白表达量比较
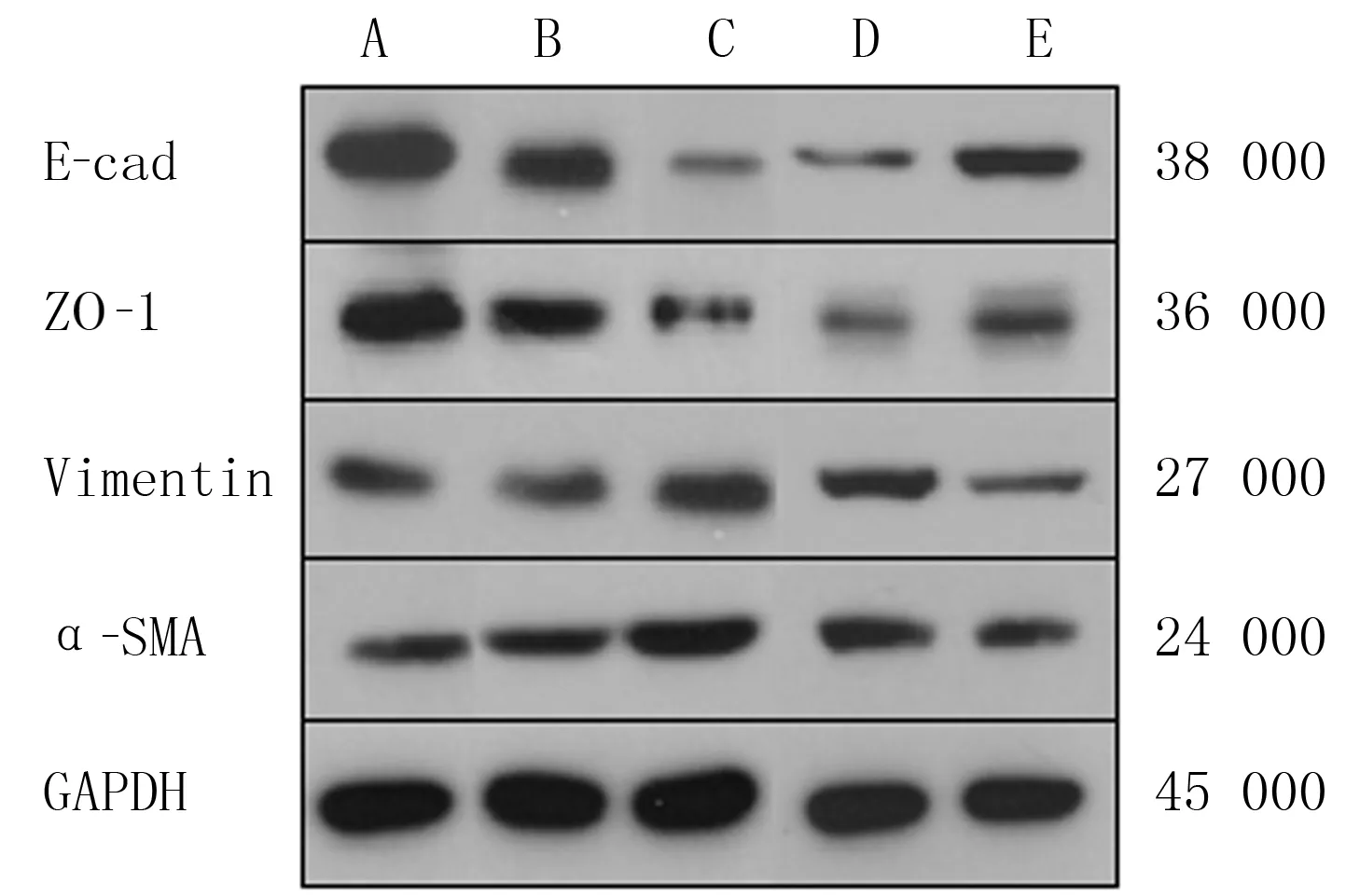
A、B、C、D、E分别为低糖对照组、高渗对照组、高糖干预组、 si-NC组、si-SNHG11组
3 讨 论
RPE细胞是视网膜神经上皮层与脉络膜毛细血管层之间含有黑色素的单层多边形上皮细胞,具有极为重要的生理功能,特别是作为外层BRB,在DR的发病中发挥着至关重要的作用[11]。目前,在DR发病机制的基础研究方面,RPE细胞的研究相对于视网膜内皮细胞及周细胞仍较少。ARPE-19细胞是目前最常用的人RPE细胞系,保持了RPE良好的特性。因此,本研究将ARPE-19细胞作为研究对象进行相关的研究。
当机体在正常生理状态下时,RRE细胞通常处于静止状态,当发生炎症、衰老或损伤等情况时,RPE细胞可经历上皮细胞向间质细胞转变的过程,细胞间的紧密连接被破坏,细胞发生迁移并聚集到邻近的组织或器官[12-15]。以往的实验研究显示,体外培养的RPE细胞可在生长因子TGF-β1、EGF或CTGF的作用下发生EMT[16-17]。最近的研究发现,高糖也可诱导ARPE-19细胞系的EMT,这可促进纤维化因子的上调以及BRB的破坏[18]。RPE细胞间的紧密连接对BRB的稳定性起着至关重要的作用,在糖尿病实验模型中已经证实ZO-1表达水平的降低可引起BRB的破坏[19]。BRB完整性的保持也是由于紧密连接和黏附连接之间相互作用的结果,这种相互作用由细胞和细胞黏附分子介导,如E-cad[20]。本研究利用高糖刺激ARPE-19细胞建立高糖模型,并通过Western blot检测EMT相关标记物。实验结果显示,上皮细胞标记物E-cad、ZO-1显著下调,间质标志物Vimentin、α-SMA显著上调,证实高糖可诱导ARPE-19细胞的EMT。划痕实验以及CCK8实验结果显示,高糖诱导的ARPE-19细胞的迁移以及增殖能力均显著增强,这与CHE等[10]的研究结果一致。
近年来,LncRNA在视网膜疾病发生发展中的作用受到越来越多的关注,到目前为止,已发现几种LncRNA与常见视网膜疾病有密切关联[21-22]。已证实LncRNAMALAT1在增殖性玻璃体视网膜病变中促进RPE细胞增殖、迁移以及视网膜前膜形成[23-24]。LncRNAMIAT在糖尿病视网膜病变中促进内皮细胞的增殖和迁移[25]。SNHG11作为新发现的LncRNA,已在多种肿瘤的发病机制中得到广泛研究,包括肺癌[26]、结直肠癌[27]、肾癌[28]等。目前,尚无关于SNHG11在DR中相关作用的报道,本研究结果首次证明了SNHG11在高糖诱导的ARPE-19细胞EMT中发挥了重要作用。
本研究结果显示,高糖诱导的ARPE-19细胞中SNHG11的表达显著上调,利用小干扰RNA敲低SNHG11以后,ARPE-19细胞中上皮细胞标记物E-cad、ZO-1显著上调,间质标志物Vimentin及α-SMA显著下调,ARPE-19细胞的增殖及迁移能力均下降,EMT发生逆转。由此猜测SNHG11是通过激活EMT的相关信号促进了高糖诱导的ARPE-19细胞的增殖和迁移。GENG等[7]研究也发现,SNHG11作为胶质瘤的癌基因,通过调控miR-154-5p促进胶质瘤细胞发生EMT。因此,推测SNHG11可能是通过靶向调控miR-154-5p促进高糖诱导的ARPE-19细胞的EMT,但具体机制仍需进一步研究探讨。
众所周知,当细胞发生EMT时,其迁移、增殖及抗凋亡的能力增强[29]。RPE细胞不受控制的增殖和迁移可导致神经视网膜表面纤维增生性前膜的形成,BRB被破坏,继而发生视网膜水肿、脱离或变性,最终导致视力损害[30-31]。此外,纤维增生性前膜的形成也是增生性DR的主要特征[32]。及时抑制RPE细胞增殖、迁移对保护BRB至关重要。本研究发现敲低SNHG11可逆转高糖诱导的ARPE-19细胞的EMT,阻止细胞的增殖和迁移,但此研究结果仅限于细胞水平,后续的体内实验及具体分子机制还需进一步研究。
综上所述,LncRNASNHG11参与了高糖诱导的ARPE-19细胞EMT的过程,从而促进了细胞的增殖和迁移,敲低SNHG11可逆转ARPE-19细胞的EMT,从而抑制细胞的增殖以及迁移,提示SNHG11在DR的发病过程中发挥着重要的作用。本研究结果为LncRNA在DR的预防和治疗中发挥调控作用提供了更多的实验室依据。
