新型钛表面微纳米共存梯度仿生结构对骨髓间充质细胞黏附、增殖及成骨分化的影响
2021-03-09王旻姜楠祝颂松
王旻, 姜楠, 祝颂松
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心 四川大学华西口腔医院口腔医院颌面外科,四川 成都(610041)
骨内植入体在整形外科和牙科应用十分广泛[1-2]。低弹性模量的纯钛或钛合金是目前植入体的首选材料[3]。但钛及钛合金属于生物惰性材料,直接植入常无法获得良好快速的骨结合,制约了其更为广泛的应用。骨结合是骨内植入体植入成功的标志[4],细胞在种植体表面黏附、增殖是种植体与周围组织作用的关键环节,通过影响细胞黏附、增殖、分化等细胞反应最终影响植入体骨结合性能[5-7]。如何通过种植体表面改性促进成骨细胞早期黏附,缩短植入体骨结合时间,增强骨结合强度,仍然是口腔种植体领域研究热点[8-10]。研究证实,通过电化学阳极氧化形成的纳米级表面形貌可以促进成骨细胞在植入体表面的早期附着[11]。同时,骨具有微纳米级共存的梯度结构[12],从仿生角度,具有微纳米级共存的梯度仿生表面结构更利于植入体-周围骨组织营养运输和骨引导生长[13]。目前,钛材如何在三维空间中影响细胞-植入体的相互作用尚未达到共识。本研究制备一种新型微纳米共存的梯度仿生表面结构,即在微米骨小梁样结构上制备TiO2纳米管结构,并研究其对体外大鼠骨髓间充质细胞(bone marrow mesenchymal cells,BMMCs)增殖、黏附及成骨向分化潜能的影响。
1 材料和方法
1.1 主要材料、试剂及仪器
纯钛材料(中国科学院金属研究所);SPS-1050放电等离子烧结系统(Thermal Technology LLC,SantaRosa,CA,美国);PGSTAT302N 电化学工作站(Metrohm,中国);4 周大雄性SD 大鼠(SYXK(川)2018-185)由四川大学动物实验中心提供;10%水合氯醛(四川大学华西妇产儿童医院);胰蛋白酶、胎牛血清、α-MEM 培养基(Gibco,美国);MTT(Sigma-Aldrich,美国);碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(Beyotime,中国);DAPI 染色液(碧云天生物科技有限公司);DyLight 549 标记的山羊抗兔二抗IgG、DyLight488 标记的山羊抗鼠二抗IgG、兔抗鼠骨钙素(osteocalcin,OCN)抗体、鼠抗鼠骨桥蛋白(osteopontin,OPN)抗体、Alex Fluor647 标 记 的Anti-Vinculin 抗 体、FITC-phalloidin(Millipore,美国);引物(Invitrogen,美国)、SYBR 定量PCR 试剂盒(Takara,日本);扫描电子显微镜(Inspect F,FEI,荷兰);原子力显微镜(Nanoscope Multi Mode & Expolre SPM,Vecco Instrument,美国);倒置荧光显微镜(Olympus,日本);TL101 接触角分析仪(TL101,Biolin scientific,瑞典),cDNA 试剂盒(Takara,日本)。
1.2 材料制备及表征观察
1.2.1 材料制备 将纯钛试样预处理,依次用丙酮、去离子水超声清洗10 min,高温蒸汽灭菌后备用,命名为纯钛组。一组纯钛试件表面行放电等离子烧结处理,制备微米骨小梁样形貌,命名为微米骨小梁组;一组纯钛试件表面行阳极氧化处理,制备TiO2纳米管形貌,命名为TiO2纳米管组;一组纯钛表面首先通过放电等离子烧结法制备微米骨小梁样形貌,再通过阳极氧化法在微米骨小梁形貌上制备TiO2纳米管结构,形成新型微纳米共存梯度仿生表面结构,命名为微纳米复合钛组。
1.2.2 表征观察 ①表面形貌:扫描电子显微镜观察4 组材料表面形貌,通过原子力显微镜进一步观察纯钛组和TiO2纳米管组表面形貌,使用Nanoscope Multi Mode 图形分析软件对样品表面的表面平均粗糙度均方根、表面积差值(三维表面积比二维表面积的比值增加的百分比)、垂直距离等表面粗糙度指标进行定量分析。
②表面能:利用静态水接触角实验检测不同植入材料表面能,每个样本表面随机选取5 个点进行测量。
1.3 体外实验
1.3.1 大鼠骨髓间充质细胞分离和培养 取4 周大雄性SD 大鼠,10%水合氯醛腹腔注射麻醉后颈椎脱臼处死,浸泡于75%酒精。迅速分离胫骨和腓骨周围的皮肤、肌肉等结缔组织,将股骨和胫骨置于1%双抗溶液中。在无菌条件下,剪去股骨及胫骨的骨垢端,用无菌注射器吸取培养基冲洗骨髓腔获得细胞悬液,1 000 r/min 离心5 min 后用含10%胎牛血清的α-MEM 培养基重悬,记为P0。37 ℃、体积分数为5%CO2、饱和湿度的细胞培养箱孵育。48 h 后首次换液,更换新鲜培养基,隔日换液,待细胞生长至80%~90%融合时按1∶3 传代培养。在细胞超净台中,将第2~4 代BMMCs 以5 ×104/mL 细胞密度接种于4 组植入材料表面,置于37 ℃、5%CO2、饱和湿度的培养箱中培养。在不同时间点进行如下检测。
1.3.2 细胞黏附情况 细胞接种2 h 后,PBS 清洗2 次,2.5%戊二醛固定30 min,依次用20%、40%、60%、80%、90%酒精以及无水乙醇梯度脱水,每个梯度脱水10 min。将样本轻轻粘在导电胶上,临界点干燥、真空喷镀,行扫描电镜观察。
1.3.3 细胞增殖能力(MTT 法) 细胞接种于4 组材料表面1、3、5、7、9 d 后,PBS 清洗,每孔加入10 mg/mL 的MTT 10 μL,37 ℃培养箱中孵化4 h,弃掉上清液,每孔再加入二甲亚砜150 μL,室温下孵育15 min 充分震荡溶解沉淀,使用酶联免疫检测仪检测OD590nm。每组样本在每个时间点选4 个平行样进行检测,以纯钛组接种细胞第1 天检测的结果为参照,计算各组细胞相对增殖率。
1.3.4 碱性磷酸酶检测 钛材样品接种细胞24 h后,将培养基更换为成骨诱导液(含体积分数10%的胎牛血清,地塞米松100 nmol/L、抗坏血酸50 mg/L、β-甘油磷酸钠10 mmol/l 的α-MEM 培养液)。每48 h 换液1 次。培养7、10、14 d 后,PBS 清洗3 次,每孔加入0.2%Triton-X-100 裂解液400 μL,放置4 ℃过夜。次日细胞裂解液50 μL 和50 μL 对硝基苯 磷 酸 盐(p-nitrophenyl phosphate,PNPP)孵 育30 min 后每孔加入100 μL 反应终止液终止反应,使用酶联免疫检测仪在OD405nm。同时按照BCA蛋白定量试剂盒说明书操作测定总蛋白浓度。每组样本在每个时间点选4 个平行样进行检测。
1.3.5 免疫荧光检测细胞黏着斑蛋白、成骨分化相关蛋白表达 接种24 h 后,PBS 清洗3 次,4%多聚甲醛固定30 min,0.2%Triton X-100 通透15 min,避光、4 ℃条件下Alex Fluor647 标记的Anti-Vinculin 抗体、FITC-phalloidin 对各组表面上附着的细胞进行染色并过夜。
接种72 h 后,PBS 清洗3 次,4%多聚甲醛固定30 min,0.2% Triton X-100 通透细胞膜15 min,观察OCN、OPN 表达。一抗孵育:吸水纸吸掉封闭液,每张爬片上滴加足够量稀释好的一抗(OCN 1∶200;OPN 1∶200)并放入湿盒,4 ℃过夜;二抗孵育:取出湿盒,37 ℃下复温45 min,PBS 清洗爬片3 次,吸水纸吸掉残留的PBS,滴加稀释好的DyLight 549标记的二抗Ig G(1∶500)、DyLight488 标记的二抗IgG(1∶500)。
最后均用DAPI 避光染色5 min。激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)下观察。
1.3.6 qRT-PCR 检测成骨标志基因表达 细胞接种7 d 后,用Trizol 试剂提取总RNA,使用1 步法cDNA 试剂盒逆转录成cDNA,再行qRT-PCR 检测。引物序列如表1 所示。PCR 反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,运行40 个循环,目的基因表达均依据管家基因GAPDH 表达水平进行标准化处理后进行比较,根据2-△△Ct法对成骨标志基因:RUNX2、OCN、OPN 和I 型胶原(collagen type I,COL I)进行基因相对表达倍数转化。
1.4 统计学分析
采用IBM SPSS 19.0 软件进行数据分析,结果均以±s来表示,采用单因素方差分析及q检验进行组间比较,P<0.05 为差异有统计学意义。

表1 PCR 引物序列Table 1 Specific prime sequences of PCR
2 结 果
2.1 样品表征
2.1.1 材料表面形貌特点分析 扫描电子显微镜下纯钛组表面仅见机械打磨的痕迹(图1a);微米骨小梁组表面形成微米骨小梁样表面形貌,有些微米管之间互相交通(管径30~100 μm),类似骨小梁结构(图1b);TiO2纳米管组表面形成均一排列的TiO2纳米管样结构(图1c、图1d);微纳米复合钛组表面形成微米骨小梁结构上有均一排列TiO2纳米管的新型梯度仿生表面结构。原子力显微镜下可见纯钛组表面光滑,没有明显的孔洞或任何规则的形状;TiO2纳米管组纳米孔近似圆形,直径从十几纳米至上百纳米不等,纳米孔深度从十几至几十纳米不等(图2)。AFM 粗糙度的定量分析结果见表2,TiO2纳米管组表面比纯钛组粗糙(P<0.001),TiO2纳米管组表面粗糙度、轮廓最大高度偏差、表面积差值分别约为纯钛组的2.9 倍、2.2 倍、1.9 倍。

Figure 1 SEM images of the surface of titanium samples图1 材料表面形貌扫描电镜观察
2.1.2 材料表面的表面能检测 4 组材料表面的表面能检测结果显示(图3):静态水接触角分别为35° ± 2.3°(纯钛组)、18° ± 1.6°(微米骨小梁组)、14° ± 1.6°(TiO2纳米管组)和9° ± 2.1°(微纳米复合钛组)。微纳米复合钛组的静态水接触角最小(P<0.001),说明其表面亲水性最好。
2.2 体外材料表面细胞行为
2.2.1 细胞黏附情况 4 组材料表面接种4 h 后细胞黏附情况显示,纯钛组细胞多呈梭形,部分可见伪足和触角(图4a)。微米骨小梁组细胞呈扁平多角形,可明显见伪足和触角(图4b)。TiO2纳米管组细胞扁平多角形,紧密附着在材料表面(图4c)。微纳米复合钛组细胞伸展更加充分,细胞与细胞间相互交织连接,大多成片,可见大量伪足和触角(图4d)。

Figure 2 AFM images of samples in the untreated-Ti group and nano-TiO2 group图2 纯钛组和TiO2纳米管组表面AFM 扫描图

表2 纯钛组和TiO2纳米管组表面参数比较Table 2 Surface parameters of samples in the untreated-Ti group and nano-TiO2 group
2.2.2 细胞增殖能力(MTT) BMMCs 接种4 组材料表面增殖活性MTT 检测结果如图5 所示。接种后1~9 d 细胞增殖活性呈递增趋势,但1 d 和3 d 差异无统计学意义(P=0.278),结果表明,1~4 d,微纳米复合钛组和TiO2纳米管组细胞增殖活性高于纯钛组和微米骨小梁组,但差异没有统计学意义。5~9 d,微纳米复合钛组和TiO2纳米管组的细胞增殖活性显著高于纯钛组和微米骨小梁组(P<0.001)。

Figure 3 The static contact angles on the samples in the four groups图3 4 组材料表面静态接触角

Figure 4 SEM images of BMMCs 4 h after culture on the surfaces of samples in the four groups图4 骨髓间充质细胞接种于4 组钛材表面4 h 后的扫描电镜图

Figure 5 The cell proliferation rate of BMMCs cultured on the samples in the four groups图5 BMMCs 接种于4 组材料表面后的细胞相对增殖率
2.2.3 ALP 活性 BMMCs 接种4 组材料表面7、10、14 d ALP 活性检测结果如图6。细胞在4 组材料表面ALP 活性在7~14 d 呈递增趋势。10 d 和14 d时,TiO2纳米管组和微纳米复合钛组表面细胞ALP活性明显高于纯钛组(P<0.001)。14 d 时,微纳米复合钛组表面ALP 活性最高,说明微纳米复合钛表面促进骨髓间充质细胞成骨向分化。
2.2.4 细胞黏附、成骨分化相关蛋白表达 培养24 h 后,纯钛组黏着斑蛋白染色较微米骨小梁组、TiO2纳米管组和微纳米复合钛组浅,微米管组、TiO2纳米管组和微纳米复合钛组之间无明显差异;TiO2纳米管组和微米骨小梁组中肌动蛋白染色深于纯钛组,微纳米复合钛组肌动蛋白染色最深(图7a)。培养72 h 后,纯钛组表达OCN 和OPN 最弱,微纳米复合钛组表达OCN,OPN 比微米骨小梁组和TiO2纳米管组强(图7b)。
2.2.5 qRT-PCR 检测成骨标志基因表达 TiO2纳米管组和微纳米复合钛组表面细胞所有成骨转录因子的基因表达水平高于纯钛组和微米骨小梁组,其中COL I 基因表达水平有显著性差异(P<0.001)。结果表明TiO2纳米管组和微纳米复合钛组促进BMMCs 早期成骨转化。纯钛组的OPN 和OCN 基因表达水平最低,与细胞免疫荧光染色结果一致(图8)。

Figure 6 ALP activity of BMMCs cultured on the samples in the four groups图6 BMMCs 接种于4 组材料表面后的细胞ALP活性
3 讨 论
骨结合是骨内植入体植入成功的标志,良好的骨结合说明人体骨组织与植入体表面形成直接稳定连接,有利于抗压和负重[14]。植入体骨结合效果受其表面性质(如粗糙程度、表面形貌等)的影响,可以通过表面改性增强其骨结合性能,如放电等离子烧结、酸蚀、阳极氧化[15-17]。骨具有微纳米级共存的梯度结构,从仿生角度,具有微纳米级共存的梯度仿生表面结构更利于植入体-周围骨组织营养运输和骨引导生长。研究证实微纳米复合钛表面形貌骨结合性能优于微米管和TiO2纳米管表面形貌[18]。本研究制备出一种新型微纳米共存梯度仿生表面结构,首先通过放电等离子烧结法在纯钛表面制备微米骨小梁样结构,再通过阳极氧化法在微米骨小梁样结构上制备TiO2纳米管结构,形成新型微纳米共存梯度仿生表面结构,将BMMCs 接种于新型微纳米共存梯度仿生表面结构表面,探究其对大鼠骨髓间充质细胞生物学活性的影响。

Figure 7 Immunofluorescence staining images of BMMCs cultured on the samples in the four groups (×400)图7 BMMCs 接种于4 组材料表面的细胞免疫荧光染色图 (×400)
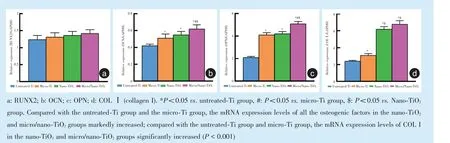
Figure 8 mRNA expression levels of various osteogenic transcription factors in the four groups图8 4 组成骨转录因子mRNA 表达
MTT 细胞增殖结果显示,1~9 d,微纳米复合钛组和TiO2纳米管组细胞增殖活性高于纯钛组和微米骨小梁组;5~9 d,微纳米复合钛组和TiO2纳米管组的增殖活性显著高于纯钛组和微米骨小梁组;提示联合应用放电等离子烧结和阳极氧化处理的钛表面表面接种的BMMCs 增殖活性更好。ALP 是成骨分化的早期标志,可水解磷酸离子,形成羟基磷灰石晶体并促进矿化[19]。成骨诱导10 d和14 d,TiO2纳米管组和微纳米复合钛组表面细胞ALP 活性明显高于纯钛组(P<0.001),证实联合应用放电等离子烧结和阳极氧化处理的钛表面可促进BMMCs 成骨分化。
CLSM 结果示微纳米复合钛组和TiO2纳米管组OCN、OPN 染色深于纯钛组和微米管组。qRT-PCR结果示TiO2纳米管组和微纳米复合钛组表面细胞的RUNX2、OCN、OPN 和COL I 基因表达水平强于纯钛组和微米骨小梁组,I 型胶原表达水平有显著性差异(P<0.001)。结果表明微纳米复合钛组可促进细胞黏附、增殖以及成骨向分化。
综上所述,联合应用放电等离子体烧结和阳极氧化法在纯钛植入体表面制备的新型微纳米共存的梯度仿生表面结构可促进骨髓间充质细胞的黏附、增殖及成骨向分化。下一步将进行动物体内实验,进一步证实改性钛表面的成骨活性。
【Author contributions】Wang M peformed the experiments,analyzed the data,and wrote the article. Jiang N revised the article. Zhu ZS designed the study. All authors read and approved the final manuscript as submitted.
