卷枝毛霉苹果酸转运蛋白生物信息学分析
2021-03-08王艳霞王璐杨俊换张瑶
王艳霞,王璐,杨俊换,张瑶
(山东理工大学 农业工程与食品科学学院,山东 淄博 255049)
早期研究表明,氮源限制是产脂微生物积累脂质的重要营养特征,当培养基中氮源耗尽后,细胞内能荷升高,腺苷一磷酸(adenosine monophosphate,AMP)度降低,三羧酸循环(tricarboxylic acid cycle,TCA cycle)受阻,此时胞内蛋白质、核酸等大分子的合成趋于停止,菌体不再生长,而培养基中大量的碳源(葡萄糖及其他被微生物吸收利用的糖类)持续吸收并转化为脂质,引起胞内脂质大量积累[1-3]。至今,科学家们对微生物脂质积累过程做了大量的研究工作,对产脂微生物氮源限制引发三羧酸循环调节到脂肪酸合成的生化机制有了较为清楚的认识[3-4]。对真核生物而言,糖酵解的终产物——丙酮酸进入线粒体内,经丙酮酸脱氢酶转化为重要中间代谢产物——乙酰-CoA。线粒体内乙酰-CoA必须转运到细胞溶胶,才能用于脂质合成[5-7];因此,转运乙酰-CoA(柠檬酸为其乙酰基载体)的线粒体三羧酸(柠檬酸)转运体系是连接糖代谢与脂质合成的纽带,是影响真核生物脂质合成的一个重要因素[5-7]。
三羧酸(柠檬酸)转运体系中另一个重要转运蛋白质是苹果酸(或二羧酸)转运体(malate transporter,MT)。对大鼠肝脏[8]、胰腺beta细胞[9]线粒体,以及从大鼠肝脏中分离、纯化的二羧酸转运蛋白质[10-11]的研究结果表明,该转运体通过电荷中性交换原则,在转入磷酸盐(或含硫化合物)的同时,将二羧酸(苹果酸、琥珀酸)转出线粒体用于糖异生。对酿酒酵母二羧酸转运体的研究[12-14]显示,MT有可能通过转入苹果酸而增加线粒体内柠檬酸的合成量,从而促进线粒体柠檬酸的转出。近年来,随着全基因组测序与全外显子测序等高通量测序技术的出现和发展[15],大量新的基因序列及氨基酸序列被载入到生物数据库中,促进了生物信息学的繁荣。研究那些通过实验难以确定结构的蛋白质,利用生物信息学软件对其结构进行快速预测和分析,具有重要的理论意义和实用价值。
产脂真菌卷枝毛霉(Mucorcircinelloides)是研究脂质积累机制的模式生物,也是全球首次商业化生产微生物油脂的菌株,其生产的油脂富含ω-6多不饱和脂肪酸γ-亚麻酸[5-6]。目前关于产脂丝状真菌柠檬酸转运蛋白的结构和功能报道较少。本研究借助生物信息学分析技术对来源于卷枝毛霉的MT蛋白的理化特性、空间结构及功能位点进行预测,为后续探究该转运蛋白的三维结构与功能奠定基础。
1 实验方法
1.1 卷枝毛霉MT蛋白序列
根据JGI数据库公布的卷枝毛霉CBS277.49的基因组信息,通过BLAST工具将基因组中全部基因序列与转运体系分类数据库(TCDB)进行比对,找到编码卷枝毛霉MT蛋白的基因只有一个,通过BLAST工具在CBS277.49的基因数据库(http://genome.jgi.doe.gov/pages/search-for-genes.jsf?organism=Mucci2)中查找CBS 277.49中的苹果酸转运体相关基因,序列如下:

MGEKLERKSLKEMVRHFTPSWFSVIMGTGILSILLHVFPFQFRGLQTIALVVYIMNVVMFCIFLIITIARYAIWPSIIRLVLEHSNQSLFIGTMPMGLTTITNFTILAIREKYAWGLNLAFVLWIIEYVLTILTVLVVPYFVIVHHNHALETMNGTWLLPIVPCVVASASGGLLAQYLDQDRALVVLVISIITMGMGLSLALSVIVIYFYRLIVNKLPPKEVIISSFLPLGPLGQGAYGVIQLGIASKAVLGDRFIVGLGDVAHSVGFLLALFLWGYGVWYLVVATFSVGITTKQGIPFNMGWWALTFPLGVFTAGTLSIGNVLNSMFFWVLGAIFTCLLVLLWLAVMAKTLKGIFTGEMFYAPCLSPVILNS
1.2 卷枝毛霉MT蛋白结构分析
通过借助在线分析工具Protparam(http://www.expasy.org/tools/protparam.html)对卷枝毛霉MT蛋白的理化性质进行分析;借助ProtScale(http://www.expasy.org/cgi-bin/protscale.pl)对 MT 蛋白的疏水性进行分析。通过借助在线预测工具PredictProtein(http://www.predictprotein.org)和Sopma(https://npsa-prabi.ibcp.fr/cgi-bin/)预测 MT 蛋白的二级结构,借助在线分析网站(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)进一步预测该蛋白的跨膜螺旋结构。借助 SWISS-MODEl工具在线完成 MT 蛋白三级结构模型的构建。
1.3 卷枝毛霉MT蛋白功能预测
通过借助在线预测工具 SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)预测 MT 蛋白的信号肽;借助在线分析工具TMHMMServer v.2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0/)对MT蛋白的跨膜特征进行分析;借助 NCBI 网站上 Conserved Domains Search (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)工具分析 MT 蛋白的保守结构域;借助在线分析工具NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)分析 MT 蛋白的磷酸化位点以及借助 Motif Scan(https://myhits.isb-sib.ch/cgi-bin/motif_scan)在线工具对 MT 蛋白翻译后修饰位点及膜体位置进行分析。
1.4 卷枝毛霉MT蛋白系统发育树构建
利用卷枝毛霉MT蛋白序列在NCBI网站上借助BLAST工具进行同源性分析,从中挑选出同源性较高的不同代表性物种的蛋白序列进行多重序列比对,并使用MEGA软件构建系统发育树。
2 结果与分析
2.1 卷枝毛霉MT蛋白的理化性质
通过对卷枝毛霉中MT蛋白理化性质的分析,得知该转运蛋白的分子量约为41 247.79 Da,分子式为C1967H3062N454O475S18,等电点为9.14,不稳定系数(Instability index)为24.01(Ⅱ级),因此将该类蛋白归类为相对稳定的蛋白。该蛋白的氨基酸总数为373个,含量相对较高的氨基酸主要包括Leu(56个,15.0%)、Val(40个、10.7%)、Ile(38个、10.2%)、Gly(32个、8.6%)、Phe(25个、6.7%)、Ala(24个、6.4%)、Thr(23个、6.2%),不含有Pyr和Sec两类氨基酸,因此其脂肪族氨基酸指数偏高,约为135.82。该蛋白为膜蛋白,它的亲水性总平均值为1.052,一般根据亲水性总平均值的正负来判断其亲水性与疏水性(正值为疏水性,负值为亲水性),因此我们推断这是一个疏水性蛋白。通过使用ProtScale工具对该蛋白的疏水性进一步分析,结果表明MT蛋白的疏水性较强,利于它向内部折叠形成二级结构,进一步形成结构域、三级结构等,同时利于形成α螺旋,保证其稳定性,符合其跨膜蛋白的特性(图1)。
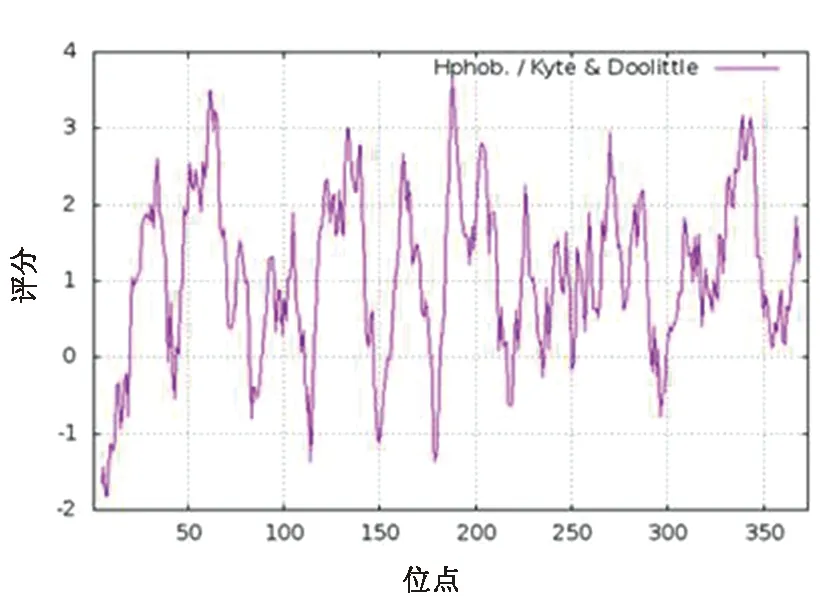
图1 MT蛋白的疏水性/亲水性预测Fig.1 Hydrophobic/hydrophilic prediction of MT protein
2.2 卷枝毛霉MT蛋白的二级结构预测
对卷枝毛霉MT蛋白的二级结构预测结果(图2)显示,该蛋白中二级结构为:α螺旋(蓝色线条,193残基)占比为51.74%、无规则卷曲(紫色线条,101残基)占比为27.08%、延伸链(红色线条,65残基)占比为17.43%、β转角(绿色线条,14残基)占比为3.75%。α螺旋占比最高,是组成该MT蛋白的主要结构。膜蛋白分子中,镶嵌在膜内的部分为α螺旋结构。借助Phyre工具进一步对跨膜螺旋结构(图3)进行分析发现,该蛋白总计有10处跨膜区,分别位于:19-36,48-72,87-107,119-141,156-176,186-221,225-242,263-290,303-321,329-358氨基酸位点处。
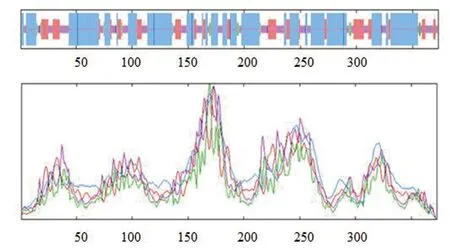
图2 MT蛋白的二级结构Fig.2 Secondary structure of MT protein
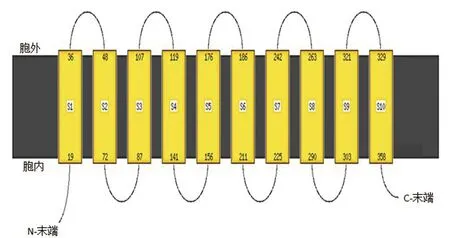
图3 MT蛋白的跨膜螺旋拓扑结构Fig.3 Transmembrane helical topology of MT protein
2.3 卷枝毛霉MT蛋白的三级结构预测
卷枝毛霉MT蛋白的三级结构预测结果如图4所示,可知该蛋白在N端以无规则卷曲和延伸的形式存在,中部由10个α螺旋和少量β转角交替出现,C端以β转角和无规则卷曲结束。整个模型是通过α螺旋和少量β转角等二级结构元素在三维空间的上述形式排列形成的一个接近于椭球形的蛋白质分子的三维结构。此蛋白分子由10个跨膜螺旋逆时针形成活性中心镶嵌于膜内的磷脂双分子层之间,符合其跨膜蛋白的结构。
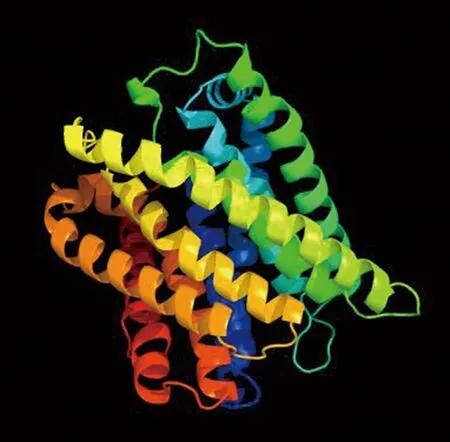
图4 预测的MT蛋白的三级结构Fig.4 Predicted tertiary structures of MT protein
2.4 卷枝毛霉MT蛋白的分析
通过使用SignalIP 3.0 Server工具Neural Networks(NN)程序对卷枝毛霉MT蛋白的信号肽进行分析,发现Cleavage site score(C-score)没有明显特征、Signal peptide score(S-score)在40残基处有高的分值;但综合分析信号肽剪切分值并不高,因此预测该蛋白不存在信号肽属于非分泌型蛋白(图5)。通过使用TMHMM工具对卷枝毛霉MT蛋白的跨膜结构进行分析(图6),发现该蛋白跨膜结构域的位置为:20-42,52-74,87-109,122-144,156-178,188-210,223-245,265-287,299-321,326-348氨基酸位点处,符合其跨膜蛋白的特性。TMHMM工具对卷枝毛霉MT蛋白跨膜结构域的位置预测与上述Phyre工具的位点稍有偏差,但跨膜区域总数相一致。
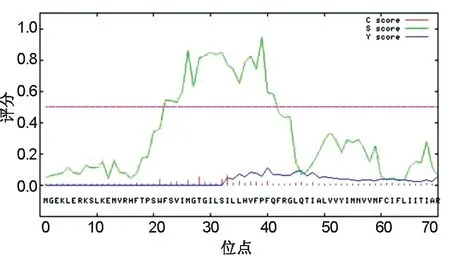
图5 MT蛋白的信号肽分析Fig.5 Signal peptide analysis of MT protein
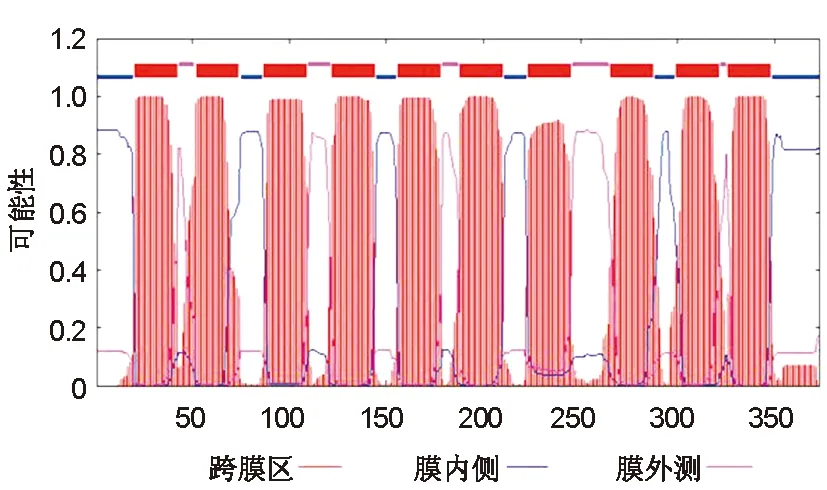
图6 MT蛋白的跨膜区分析Fig.6 Transmembrane analysis of MT protein
2.5 卷枝毛霉MT蛋白的保守结构域预测
通过使用NCBI网站上的Conserved domains分析可知,卷枝毛霉MT蛋白的保守结构域有一个(图7),预测结果显示该蛋白中14-348氨基酸属于亚硒酸盐抗性/二羧酸转运体(TDT)家族。含有门控离子通道中的苯丙氨酸,与亚硫酸盐敏感蛋白(SSU1)保守结构域一致。
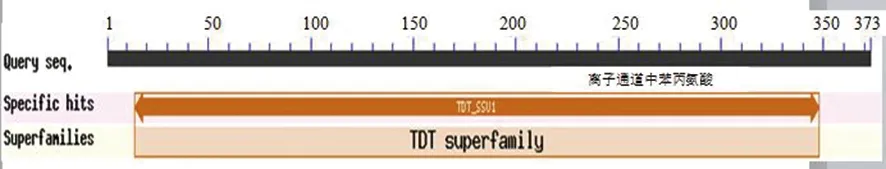
图7 MT蛋白的保守结构域分析Fig.7 Conservative domain analysis of MT protein
2.6 卷枝毛霉MT蛋白翻译后修饰与结构的特征性序列分析
通过对卷枝毛霉MT蛋白理化性质的分析可知,丝氨酸(Ser)及苏氨酸(Thr)不是其主要组成,含量较低,故此推测该蛋白的磷酸化位点较少。通过借助NetPhos 2.0 Server分析工具进一步预测的结果表明,MT蛋白潜在的Ser磷酸化位点有3个,潜在的Thr磷酸化位点有2个,无潜在的酪氨酸(Tyr)磷酸化位点。
不同的翻译后修饰类型都可能影响蛋白的基本性质进而影响其功能,借助Motif Scan程序分析卷枝毛霉MT蛋白翻译后修饰位点及膜体位置见表1。由表1可知:该蛋白存在3个ASN-糖基化位点,分别位于氨基酸86-89、103-106、154-157处;8个豆蔻酰化位点,分别位于氨基酸116-121、171-176、195-200、296-301、311-316、321-326、333-338、354-359处;1个酪蛋白激酶II磷酸化位点,位于氨基酸9-12处;3个蛋白激酶C磷酸化位点,分别位于氨基酸9-11、291-294、351-353处。同时在氨基酸19-316处存在一个C4-二羧酸转运体/MT蛋白保守结构域,概率值为4.8e-89,与功能域预测的结果一致。
2.7 卷枝毛霉MT蛋白系统发育树分析
借助网站NCBI中的Blast工具将卷枝毛霉MT蛋白与其他物种中的MT蛋白进行同源性分析随后生成系统发育树(图8)。结果显示卷枝毛霉CBS277.49与毛霉菌(Mucorambiguous)的同源性最高,其次与卷枝毛霉WJ11也有很高的同源性,因此聚为一类;与栽培大豆(Cultivatedsoybeans)和植物拟南芥(Arabidopsisthaliana)两个物种亲缘关系较远。
3 结束语
本研究借助生物信息学分析技术对产脂丝状真菌卷枝毛霉的MT蛋白进行多方面预测。经分析推断可知,该蛋白疏水性强且性质稳定,不存在明显的信号肽特征,属于非分泌型蛋白。α螺旋是组成该MT蛋白占比最高的二级结构,并且膜蛋白分子中α螺旋结构是镶嵌在膜内的部分[6],符合该蛋白跨膜运输的特性。MT蛋白由10个跨膜螺旋逆时针排列形成一个接近于椭球形的蛋白质分子的三维结构。对MT蛋白保守结构域分析结果表明,该蛋白存在一个C4-二羧酸转运体/MT蛋白保守结构域。该转运蛋白磷酸化位点、翻译后修饰与结构的特征性序列分析显示其潜在的Ser磷酸化位点有3个,潜在的Thr磷酸化位点有2个,无潜在的Tyr磷酸化位点;有8个豆蔻酰化位点,3个ASN-糖基化位点和蛋白激酶C磷酸化位点,1个酪蛋白激酶II磷酸化位点。系统发育分析发现卷枝毛霉MT蛋白与毛霉菌(Mucorambiguous)的同源性最高,聚为一类,与植物拟南芥(Arabidopsisthaliana)的亲缘关系较远。本研究将为后续探究MT蛋白的三维结构与功能奠定基础。
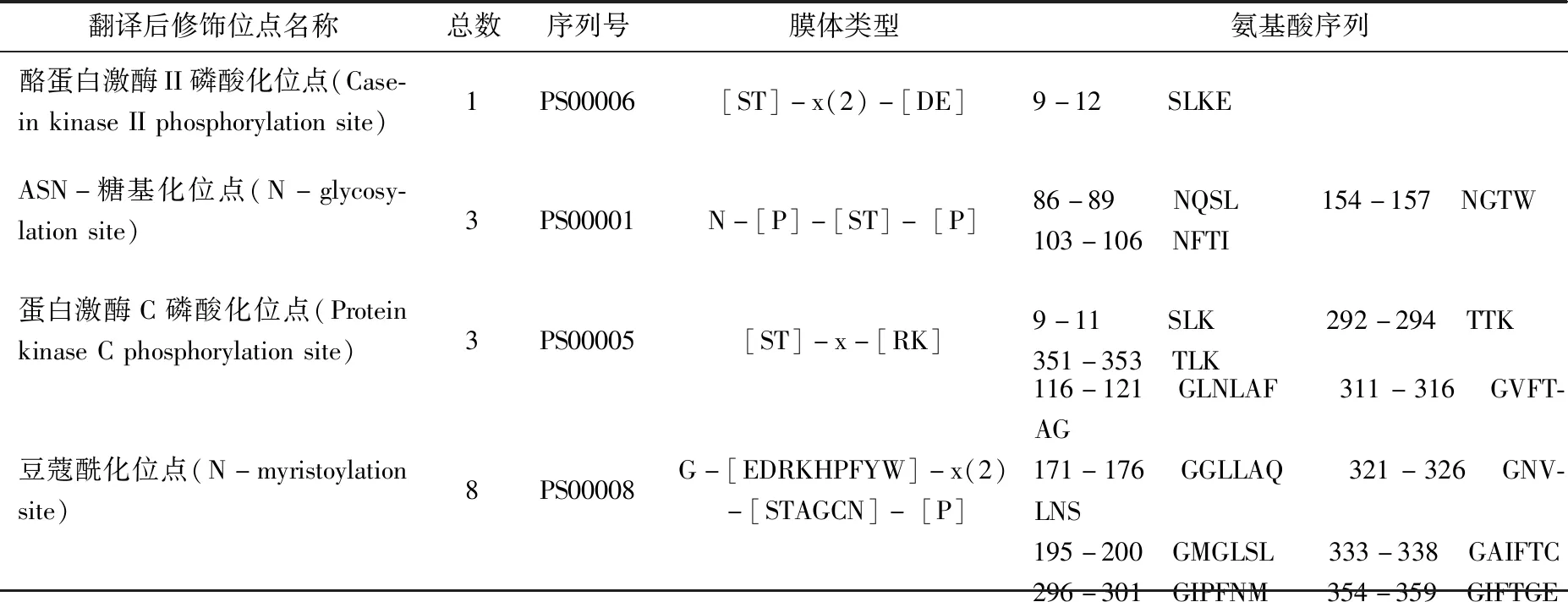
表1 MT蛋白翻译后修饰位点预测Tab.1 Post-translational modification site prediction of MT protein
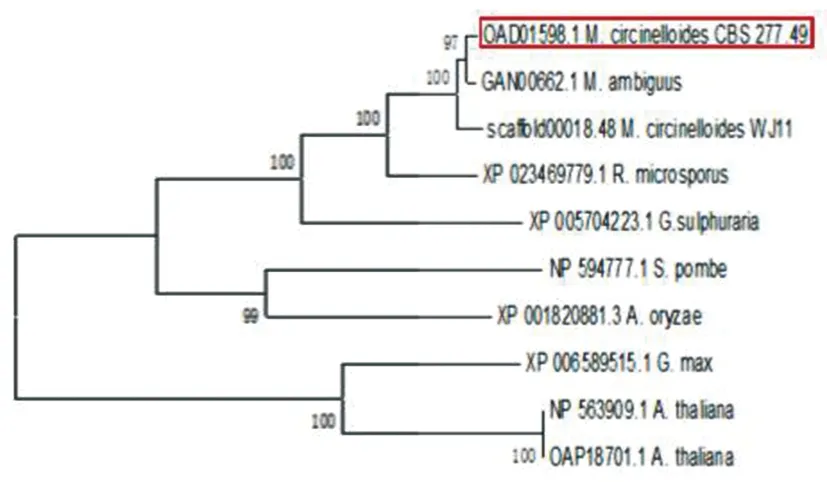
图8 不同种属的MT蛋白系统进化树Fig.8 Phylogenetic tree of MT protein system from different species
