COX-2、CD44V6与卵巢癌恶性生物学指标的关系
2021-03-06狄海红冯未萍王凤姣
狄海红 冯未萍 王凤姣
临床上卵巢癌患者的多器官功能衰竭风险可超过15%以上,同时患者的远期生存预后恶化程度较高[1-2]。有研究指出,在卵巢癌病情发展的过程中,细胞因子或者肿瘤蛋白表达异常,进而影响了卵巢生发上皮细胞的异常病变,从而促进卵巢肿瘤的发生发展。环氧化酶-2(COX-2)是氧化酶家族成员,能够通过影响到卵巢癌细胞的增殖速度,提高了卵巢癌细胞的转录激活程度,从而促进癌细胞的持续性自我扩增效应[3];CD44变异性V6(CD44V6)是跨膜糖蛋白,能够通过诱导癌细胞粘附和浸润,增强癌细胞对于基膜组织的突破能力,进而促进卵巢癌的发生发展[4]。部分研究者认为在卵巢癌患者中,COX-2的表达浓度可显著上升[5],但对于CD44V6的分析不足。本文选取90例卵巢癌标本,探讨了COX-2、CD44V6的表达及其与卵巢癌患者的临床病理特征相关性,并将结果报告如下。
1 资料与方法
1.1 一般资料
收集了我院2017年1月至2019年3月的90例卵巢癌标本作为卵巢癌组、45例卵巢良性肿瘤组织标本为良性组。纳入标准:①卵巢癌、卵巢良性肿瘤均以手术后病理学检查结果作为金标准;②诊断标准参考中华医学会制定的标准[6];③年龄范围19~59岁;④所有纳入对象既往均无放化疗、免疫学治疗史;⑤本研究经医学伦理委员会的批准。排除标准:①伴有全身感染性疾病;②肝肾功能疾病;③长期使用糖皮质激素、免疫抑制剂的患者;④其他部位恶性肿瘤。卵巢癌组,年龄范围33~58岁,平均(46.6±7.0)岁,临床分期:Ⅰ期患者21例、Ⅱ期患者31例、Ⅲ期患者29例、Ⅳ期患者9例;分化程度:高分化患者26例、中分化患者31例、低分化患者33例;发生淋巴结转移阳性55例。良性组,年龄范围36~59岁,平均(48.0±9.4)岁;黏液性囊腺瘤20例、浆液性囊腺瘤16例、成熟畸胎瘤9例。2组患者就上述一般资料比较,差异无统计学意义(P>0.05),可进行比较。
1.2 COX-2蛋白、CD44V6蛋白的免疫组化检测方法
将标本石蜡包埋后,行连续性切片厚度为3 m,在温度60 ℃下烤片60 min后脱水,使用EDTA进行抗原修复,加入10 μl蒸馏水及10%过氧化氢5 μl,并在室温下孵育30 min,再采用磷酸盐缓冲液(PBS)洗涤3次×3 min后,加入P16蛋白的单克隆抗体(1∶1000 购自罗氏检测公司),37 ℃孵育60 min,PBS洗涤3次×3 min,加入HRP标记的COX-2、CD44V6二抗(1∶2000 购自罗氏公司),37 ℃孵育20 min,PBS洗涤3次×3 min,加入DAB后,PBS冲洗和复染,脱水后进行仔细观察。
1.3 结果判定
(1)根据着色程度分为:0分-无色、1分-淡黄色、2分-棕黄色、3分-褐色、黑色;(2)根据阳性细胞比例分为:1分-阳性细胞数目所占比例≤10%、2分-阳性细胞所占比例>10%~50%、3分-阳性细胞数>50%~75%、4分-阳性细胞数所占比例>75%。两种积分相乘总分<3分为阴性、≥3分为阳性。
1.4 统计学处理
2 结果
2.1 卵巢癌组织、卵巢良性肿瘤中的COX-2、CD44V6蛋白表达水平比较
卵巢癌组织中的COX-2蛋白、CD44V6蛋白阳性表达率明显高于卵巢良性肿瘤组织,差异均具有统计学意义(P<0.05),见表1。
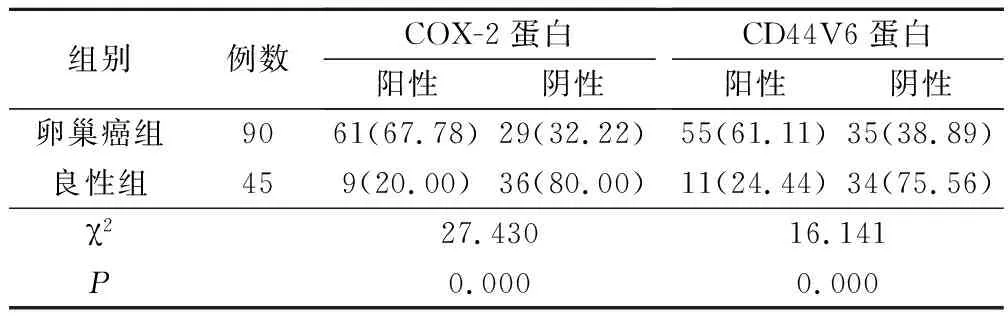
表1 2组COX-2蛋白、CD44V6蛋白表达水平比较(例,%)
2.2 卵巢癌组织、卵巢良性肿瘤中的COX-2蛋白、CD44V6蛋白表达与恶性指标的关系
不同临床分期、不同分化程度、是否发生淋巴结转移的卵巢癌组织中的COX-2蛋白阳性表达率比较,差异均具有统计学意义(P<0.05);不同分化程度、是否发生淋巴结转移的卵巢癌组织中的CD44V6蛋白阳性表达率比较,差异均有统计学意义(P<0.05),见表2。
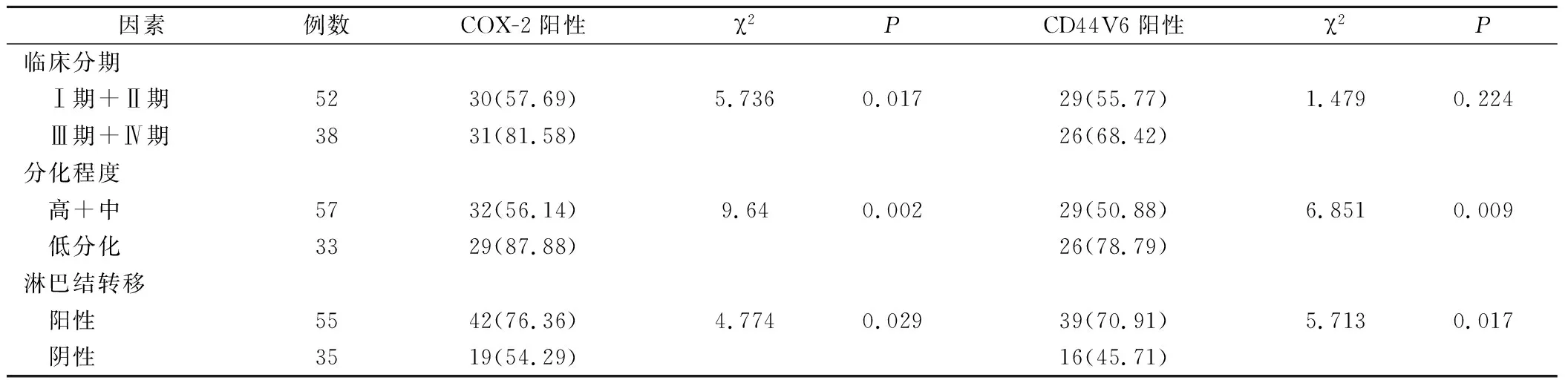
表2 卵巢癌COX-2、CD44V6蛋白表达与肿瘤恶性程度指标的关系(例,%)
3 讨论
不同病理性因素刺激下,卵巢生发上皮细胞或者卵泡细胞的异常病变,均能够促进卵巢癌的发生,在合并有雌激素受体基因突变或者游离雌激素活性改变的群体中,卵巢癌的发病率可进一步的上升[7]。卵巢癌患者的3年及5年生存率不足35%[8],经不同治疗措施治疗后,卵巢癌患者的病情进展风险仍然较高。临床上对于卵巢癌患者的血清学病情评估具有重要的作用,其能够在协助临床诊疗、预后判断或者出院后随访方面发挥作用。血清糖链抗原125(CA125)虽然在卵巢癌的病情评估或者预后随访中发挥作用,但多中心的临床分析研究发现,单纯依靠CA125评估卵巢癌病情或者预后的灵敏度不超过30%,其评估的一致性较低[9]。本次研究对于卵巢癌患者病灶组织中COX-2、CD44V6的表达分析研究,不仅能够揭示卵巢癌的病情进展原因,同时能够为临床上提供新型的血清学参考指标。
COX-2能够通过诱导环氧化酶的代谢障碍,提高环氧化酶对于卵巢肿瘤微环境的改变,增加卵巢癌细胞的生物学恶化的风险。COX-2蛋白结构上包含的脯氨酸结构,能够结合卵巢癌基因DNA上游转录配体,提高癌细胞核基因转录激活的程度。相关研究还认为,COX-2能够促进肿瘤血管内皮细胞的新生,促进新生血管的形成,进而提高肿瘤细胞的血流灌注水平[10];CD44V6是CD44蛋白的变异体,其能够通过影响到卵巢癌细胞的上皮-间质转换过程,提高肿瘤细胞的浸润深度,进而促进卵巢癌的病情发展[11-12]。
本次研究对于卵巢癌及卵巢良性肿瘤患者病灶组织中COX-2、CD44V6的分析可见,在卵巢癌患者中,COX-2、CD44V6的表达阳性率明显的上升,高于良性肿瘤组,统计学差异较为显著,提示了COX-2、CD44V6的高表达均能够参与到卵巢癌的发生过程。相关细胞因子的表达对于卵巢癌的发生影响,主要通过下列途径[13-14]:①COX-2的表达能够提高肿瘤血管内皮的迁移速度,促进肿瘤组织血管分子的形成,为肿瘤细胞的浸润提供前提;②CD44V6能够提高卵巢癌细胞的干细胞特性,提高癌细胞对于盆腔内脏器组织的粘附和浸润能力。研究者发现[15],在卵巢浆液腺癌患者中,CD44V6的表达阳性率或者表达浓度可显著上升,同时在合并有明显的腹水或者远处脏器转移的患者中,CD44V6的表达水平可翻倍上升。分析COX-2、CD44V6的表达与卵巢癌患者临床病理特征相关性可以看出,在临床分期较晚、发生了淋巴结组织转移或者卵巢癌细胞低分化的患者中,COX-2蛋白的表达阳性率较高,提示了COX-2的表达与卵巢癌临床病理特征的关系,这主要由于COX-2的表达上升,能够加剧癌细胞生物学特征的恶化,从而引起肿瘤细胞浸润深度的增加,提高了癌细胞对于盆腔内淋巴结的粘附能力。在癌细胞分化程度较差或者发生淋巴结转移的患者中,CD44V6的表达阳性率较高,提示CD44V6的表达与卵巢癌的临床病理特征同样密切相关,这主要由于CD44V6的表达上升能够促进卵巢癌分化成熟的调控障碍,诱导卵巢癌细胞的低分化,但并未发现临床分期与CD44V6的关系,推测CD44V6的表达并不能影响到卵巢癌细胞的浸润或者转移过程。
综上所述,在卵巢癌患者病灶组织中,COX-2、CD44V6的表达阳性率均明显上升,同时COX-2、CD44V6的表达与卵巢癌患者的临床分期、癌细胞分化及淋巴结转移密切相关。但本次研究未能探讨COX-2、CD44V6的表达与卵巢癌患者的预后关系。
