卵巢癌组织中SSBP1的表达意义及作用
2021-03-06康安静
苗 丽 王 栋 马 莉 康安静 张 洁
卵巢癌(ovarian cancer)是严重威胁女性健康的常见恶性肿瘤之一,与其他妇科肿瘤相比,卵巢癌死亡率最高,术后晚期患者的五年生存率不足30%[1]。近年来靶向药物的应用为肿瘤治疗提供了新思路。
Warburg 效应在肿瘤发生及进展中具有关键作用,其调控机制研究一直是肿瘤领域的热点问题[2]。Warburg效应重要特点就是线粒体氧化磷酸化减弱及糖酵解显著增强。作为真核细胞中唯一具有独立基因组的细胞器,线粒体在能量代谢、钙稳态调节、活性氧产生和凋亡调控等细胞生理过程中发挥着重要作用。线粒体数量和功能异常参与了包括肿瘤在内的多种人类疾病的发生与进展。例如研究表明,线粒体DNA拷贝数异常与肝癌、结直肠癌和胶质瘤等肿瘤发病风险和生存显著相关[3-4]。但关于肿瘤中线粒体DNA复制及线粒体拷贝数增加的具体诱因及机制尚不明确。线粒体单联DNA结合蛋白(SSBP1,又称mtSSB)具有促进线粒体DNA复制和损伤修复进而调控线粒体生成的重要作用[5]。近年来,SSBP1在肿瘤中作用受到越来越多的关注。本研究通过从SSBP1在卵巢癌组织中的表达变化入手,通过从TCGA数据库中选取正常卵巢及卵巢癌组织的转录组数据,利用Kaplan-Meier模型分析SSBP1与患者生存情况,并进一步研究SSBP1对卵巢细胞恶增殖的影响,以期为阐明SSBP1在卵巢癌发生发展中的作用提供思路和线索。
1 材料与方法
1.1 数据来源
从TCGA 数据库(https://tcgadata.nci.nih.gov/tcga/)下载正常卵巢组织转录组数据97例以及有预后信息的373例卵巢癌数据集(年龄30~87岁,中位年龄59岁);并利用Bioconductor/TCGAbiolinks 函数包提取mRNA表达RNASEqV2数据。基因的表达量由Fregments Per Kilobase per Million(FPKM)表示。计算方法为FPKM=106×nf/L/N。nf是比对至目标基因的片段(fragment)数量、L是目标基因的外显子长度之和除以1000(L单位为kb)、N 是总有效比对至基因组的读取次数(read数量)。
1.2 细胞培养及转染
人卵巢癌细胞SKOV-3购于ATCC细胞库,细胞采用含10%胎牛血清(四季青生物)的RPMI-1640培养基(上海生工生物)培养,培养箱含5%浓度的CO2,温度设定为37 ℃。
取对数期卵巢癌细胞系SKOV-3,胰蛋白酶消化后用无双抗 10﹪血清培养液制成细胞悬液,接种到35 mm培养皿并培养至70%汇合率,进行转染。取出培养皿,吸去培养皿中的培养液,并每皿加入DMEM培养液约0.5 ml重复冲洗细胞两遍,而后每皿加入 DMEM 培养液1.5 ml,转染复合物混合液0.5 ml。 轻轻混匀,放入37 ℃、5% CO2孵育箱中培养6 h左右后更换培养基。用G418筛选稳定细胞株。
1.3 Western Blot
首先,用RIPA蛋白裂解液裂解卵巢癌细胞并提取细胞总蛋白,BAC法对蛋白浓度进行测定后加入2×上样缓冲液并置于沸水中煮沸5 min。随后进行聚丙烯酰胺凝胶电泳,并用湿转法将凝胶中蛋白转印至PVDF膜上,用5%脱脂奶粉室温封闭1 h后,分别加入用封闭液稀释过的SSBP1与actin抗体于4 ℃反应过夜,TPBS洗膜3次后加入二抗并在室温下继续反应1.5 h,继续用TPBS洗膜3次后用化学发光法对最终条带进行检测。
1.4 线粒体定量
去除细胞培养液,加入配制好的并37 ℃预温育的Mito-Tracker Red染色工作液,与细胞37 ℃共孵育15 min。 去除Mito-Tracker Red染色工作液,加入37 ℃预温育的新鲜细胞培养液。随后通常用荧光显微镜进行观察分析。
1.5 乳酸及氧气消耗定量
依照索莱宝乳酸定量试剂盒(货号:BC2235)方法:收集5×106个细胞加入1 ml提取液,冰浴超声波破碎细胞(功率300 w,超声3秒,间隔7秒,总时间3 min),随后4 ℃条件下12 000 g离心10 min取上清应用试剂盒测定。细胞氧耗检测采用氧电极法(Strathkelvin),信号采集间隔时间为0.5秒。
1.6 统计方法
应用SPSS 19.0统计学软件进行数据分析。生存分析采用Kaplan-Meier法。为了选择最佳FPKM截断值(Best FPKM cut-offs)对患者进行最显著分组,本研究使用所有处于20~80%的FPKM值对患者进行分组,检查各组生存率的差异,并选择产生最低log-rankP值的分组方式。利用Person函数对两个变量之间的相关性开展分析。P<0.05为差异具有统计学意义。
2 结果
2.1 SSBP1在卵巢癌中的表达
TCGA数据集中正常卵巢组织中SSBP1的表达量最高为33.8 FPKM,最低为18.4 FPKM,平均数为26.5 FPKM。而在卵巢癌组织中SSBP1的表达量最高为58.2 FPKM,最低为5.3 FPKM,平均数为17.5 FPKM。统计分析可见,肿瘤组织中SSBP1表达水平显著低于正常卵巢组织(P<0.001),见图1。
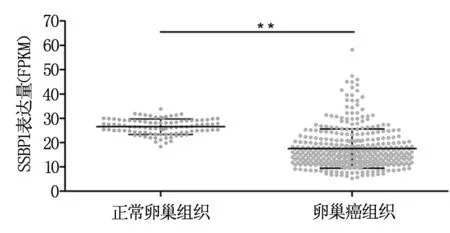
图1 SSBP1在正常卵巢组织及卵巢癌组织中的表达分析
2.2 SSBP1表达水平与卵巢癌患者预后
利用373卵巢癌患者的转录组测序及预后数据的进行Kaplan-Meier Plotter生存分析得出,低表达SSBP1患者的预后显著差于高表达患者(P<0.05,图2)。进而提示,肿瘤组织中高水平的SSBP1是预后良好因素,低表达或不表达与患者生存期缩短显著相关。
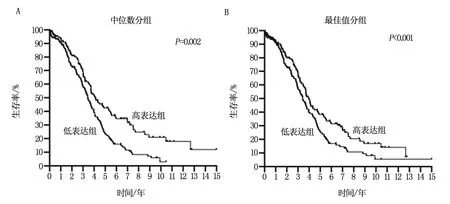
图2 SSBP1表达水平与卵巢癌患者预后
2.3 SSBP1过表达对细胞糖代谢能力的影响
进一步研究发现,在卵巢癌细胞SKOV-3中稳定过表达SSBP1(图3A)可显著增加线粒体含量及细胞氧耗速率(图3B和3C),抑制糖酵解(3D),提示卵巢癌细胞中SSBP1的降低可促进糖酵解、抑制线粒体氧化磷酸化,进而促进Warburg效应。
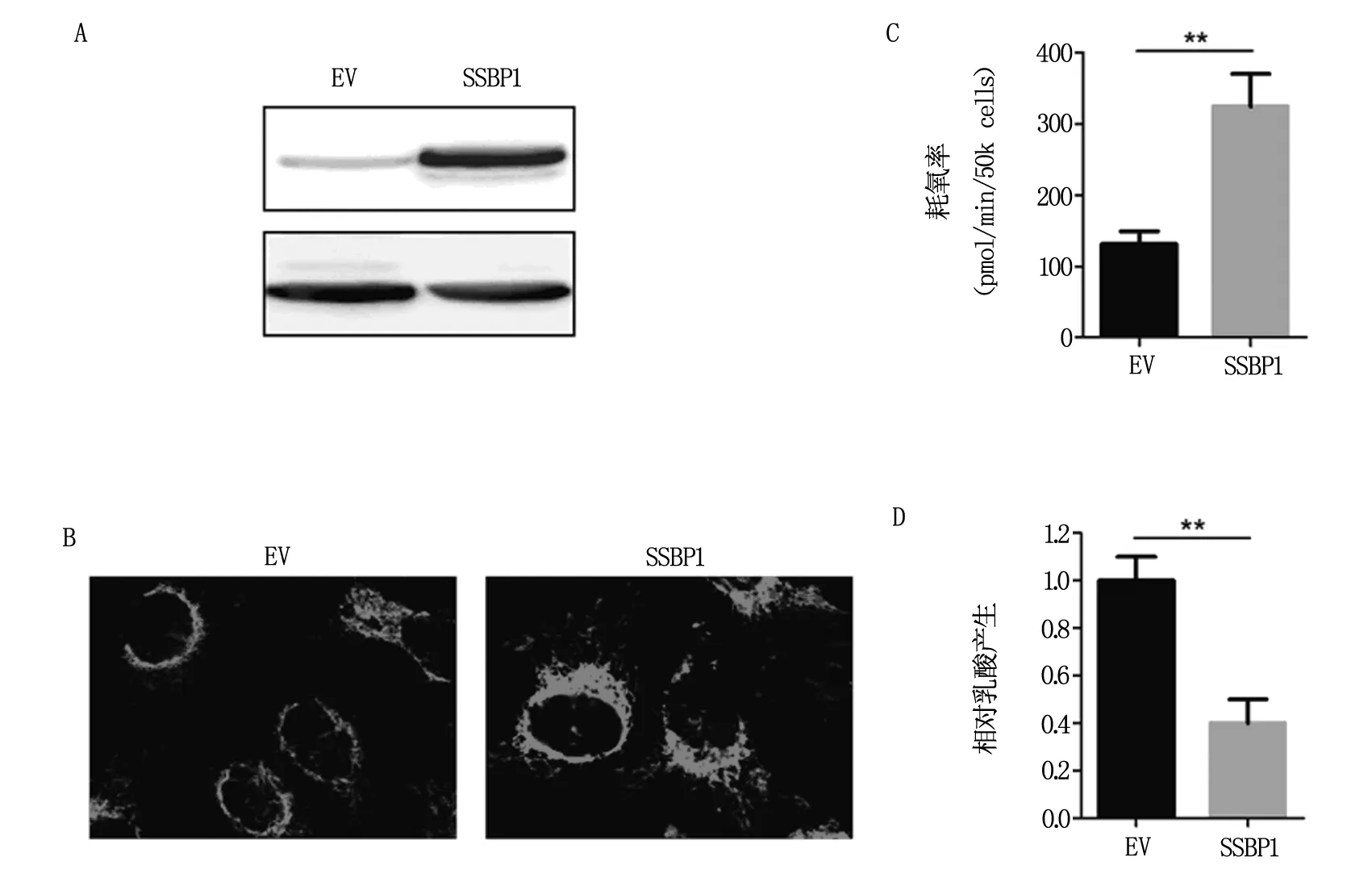
图3 SSBP1过表达对细胞糖代谢能力的影响
2.4 SSBP1过表达对卵巢癌细胞生长的影响
如图4所示,过表达SSBP1可显著抑制结卵巢癌细胞的生长,提示肿瘤内低表达SSBP1与较较差预后可能存在因果关系。
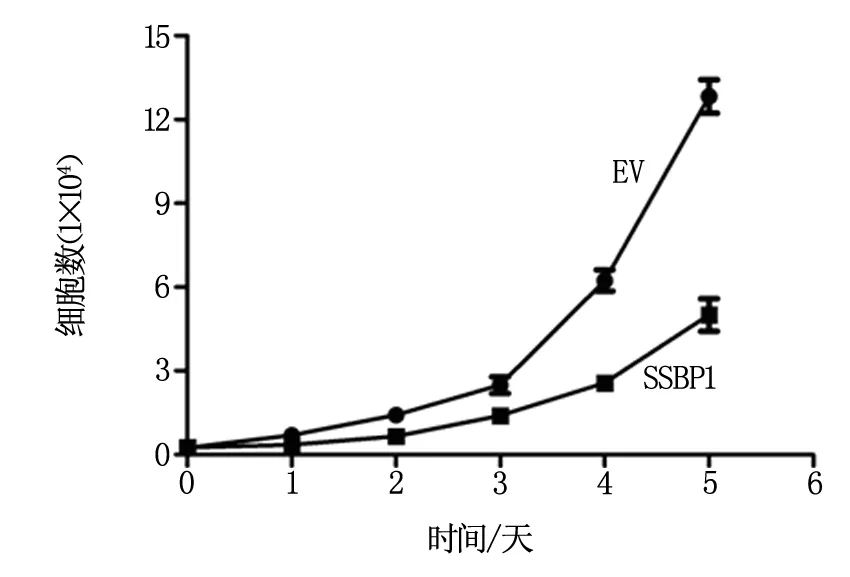
图4 SSBP1过表达对卵巢癌细胞生长的影响
3 讨论
mtSSBP1在线粒体DNA(mtDNA)的复制、转录及修复过程发挥关键作用。因此,mtSSBP1突变或表达失调将导致mtDNA发生基因突变,最终可能会导致肿瘤的发生。在本研究中,我们首次发现了SSBP1在卵巢癌组织中的表达显著低于正常卵巢组织,且肿瘤组织中低表达SSBP1的患者预后显著差与高表达组患者。与之类似,Li等发现SSBP1基因多态性(rs6976500G)可显著降低SSBP1的转录活性及表达水平,进而与胃癌的不良预后显著相关[6]。进一步Jiang等研究发现,三阴性乳腺癌组织中SSBP1的表达下调可通过“线粒体-核交互信号通路”激活上皮-间质转换(EMT)过程,继而促进肿瘤细胞的转移[7]。Wang等发现在非小细胞肺癌中SSBP1表达下降、mtDNA拷贝数降低,并导致肿瘤细胞的放疗敏感性升高[5]。此外,Ye等还利用蛋白质印迹及免疫组化等方法对20例肝癌组织的进行分析发现,与对照组相比,SSBP1在肿瘤组织中表达异常上调,推测可能是由于mtSSBP1蛋白不能正确折叠而导致其在细胞中的异常累积,并可能造成了mtDNA的复制障碍及突变[8]。以上研究结果都提示SSBP1的表达异常可通过抑制mtDNA复制及线粒体正常功能,进而促进肿瘤的发生进展。
正常细胞通过线粒体氧化磷酸化产生ATP 提供能量,而肿瘤细胞则表现出了不同的能量代谢方式。因此,糖代谢重编程是肿瘤细胞的一个重要特征,其与肿瘤的发生发展互为因果。早在上个世纪,德国生理学家Otto.Warburg就提出了著名的Warburg效应:相比于正常细胞,肿瘤细胞糖酵解显著增强,线粒体氧化磷酸化降低来满足快速生长的需求[9]。在很长一段时间内,科研工作者一直认为肿瘤细胞有氧呼吸存在不同程度的损伤,即线粒体功能的不可逆性损伤是所有肿瘤的共同起因。然而,进来越来越多的研究表明绝大部分肿瘤细胞中线粒体数目下降。在本研究中我们发现SSBP1的表达下调可减少线粒体数目,并促使卵巢癌细胞糖酵解与增殖能力的增强。与之相类似,Huang等发现肝癌中高表达的CD147分子可通过抑制p53通路下调线粒体生物生成的关键调控分子PGC-1α、TFAM等进而导致肿瘤细胞线粒体数目减少,与肿瘤细胞的增殖[10]。
上述研究结果提示,线粒体数目有望成为1种新型标志物用于卵巢癌患者预后评估及药物治疗靶点。
