CPT1A在能量应激时卵巢癌细胞生存中的调控作用
2021-03-06罗剑波邓晓杨
邓 洁 罗剑波 彭 聪 邓晓杨
肿瘤研究领域内的著名学者Hanahan于2011年在Cell杂志撰写综述,对肿瘤细胞的十项最主要特征进行了总结,其中包括肿瘤细胞代谢的异常改变,即代谢重编程[1]。大量研究证实,代谢重编程与肿瘤的发生与发展高度相关[2-3]。由于肿瘤在快速分裂增殖时,新生血管往往相对滞后,当肿瘤体积不断增大时内部常出现营养缺乏的慢性微环境,肿瘤细胞在营养缺乏环境中存活的机制一直是肿瘤代谢研究领域的热点问题[4]。目前研究发现,营养缺乏首先会促进肿瘤细胞产生能量应激,此时肿瘤细胞通过使原有代谢特征发生转变,由非能量应激状态时的合成代谢转变为能量应激时的分解代谢,通过分解细胞内糖类、脂类、蛋白质等大分子物质,对营养缺乏时的能量危机做出适应性反应[5-6]。
人肉毒碱棕榈酰基转移酶1A(carnitine palmitoyltransferase 1A,CPT1A)是定位于线粒体内膜参与脂肪酸氧化调控的关键酶,它负责将细胞浆中的脂肪酸转运至线粒体内进行后续的脂肪酸氧化[7]。然而目前,作为参与脂肪酸氧化调控的重要酶,CPT1A在能量应激时肿瘤细胞存活中的作用却尚不清楚。本项目将首次分析CPT1A在卵巢癌细胞能量应激时的表达变化及其在细胞生存中的调控作用。
1 材料与方法
1.1 材料
人卵巢癌细胞SKOV3购于ATCC细胞库,细胞采用含10%胎牛血清(四季青生物)的RPMI-1640培养基(上海生工生物)培养,培养箱含5% 浓度的CO2,温度设定为37 ℃。
细胞能量应激建模方法:采用HBSS平衡盐溶液饥饿法作为能量应激建模策略。首先,弃去细胞中RPMI-1640培养液,用商品化的HBSS平衡盐溶液(Thermo Fisher公司,货号14025076)将细胞洗涤2次后加入HBSS继续培养3 h或6 h。
1.2 实验步骤与方法
1.2.1 qRT-PCR 首先,用商品化的RNA提取试剂盒(OMEGA公司,货号R6688)提取细胞中总RNA。之后,将所提RNA用反转录试剂盒(TAKARA公司,货号RR037A)反转录合成cDNA。目的基因CPT1A与内参基因GAPDH的PCR引物由华大基因合成,CPT1A引物序列为:上游5'-ATGCGCTACTCCCTGAAAGTG-3',下游5'-GTGGCACGACTCATCTTGC-3'。GAPDH序列为:5'-GGAGCGAGATCCCTCCAAAAT-3,5'-GGCTGTTGTCATACTTCTCATGG-3'。最后,采用2-△△Ct法对各组细胞中CPT1A相对表达水平进行计算。
1.2.2 Western Blot 首先,用RIPA蛋白裂解液裂解卵巢癌细胞并提取细胞总蛋白,BAC法对蛋白浓度进行测定后加入2×上样缓冲液并置于沸水中煮沸5 min。随后,用加样器将各组细胞蛋白加入聚丙烯酰胺凝胶各孔中并进行电泳。第一阶段电泳采用90 V恒压,待样品进入分离胶后将电压增大至120 V,溴酚蓝被电泳至凝胶底部时即可停止电泳。随后用湿转法将凝胶中蛋白转印至PVDF膜上,用5%脱脂奶粉室温封闭1 h后,分别加入用封闭液稀释过的CTP1A与GAPDH抗体于4 ℃反应过夜,TPBS洗膜3次后加入二抗并在室温下继续反应1.5 h,继续用TPBS洗膜3次后用化学发光法对最终条带进行检测。
1.2.3 siRNA转染细胞 首先,合成靶向CPT1A的RNA干扰片段与无关对照片段(Qiagen公司)。siRNA转染步骤为:首先,于转染前一日将细胞以1.5×105个/孔的密度接种至6孔板中,采用脂质体lip2000作为介质进行转染。随后,用无血清培养基分别稀释siRNA片段与lip2000,放置5 min后将两种稀释液混和,混合液放置25 min后即可加入6孔板中(每孔100 μl),细胞置于孵箱中培养6 h后即可更换含血清培养基继续培养24 h。
1.2.4 流式细胞仪检测细胞凋亡 首先,按上步所述方法对卵巢癌细胞中CPT1A表达进行干涉处理,用胰蛋白酶消化并离心收集细胞,PBS洗涤两次后按试剂盒操作说明(US Everbright lnc 公司,货号Y6026)对各组卵巢癌细胞进行Annexin V与PI染色,染色结束后即可上流式细胞仪进行各组细胞的凋亡分析。
1.2.5 细胞氧耗速率分析 首先,按上步所述方法对卵巢癌细胞中CPT1A表达干涉,用胰蛋白酶消化并离心收集细胞。细胞氧耗速率分析采用液相氧电极(英国汉莎公司)。首先,对阳极与阴极电极进行认真清洗,清洗过后按先阳性后阴性的顺序依次连接电极,连接完毕后打开电脑软件并对电极进行校正,随后建立“零氧线”并依次加入各组细胞并进行氧耗速率测定。
1.2.6 胞内ATP检测 首先,按上步所述方法对卵巢癌细胞中CPT1A表达干涉,用胰蛋白酶消化并离心收集细胞,随后用ATP检测试剂盒(碧云天生物公司,货号S0026)中提供的ATP检测裂解液对细胞进行裂解并将裂解液于4 ℃条件下12 000 g离心5 min。最后,按试剂盒操作说明对各组细胞中ATP进行检测。
1.3 统计学方法
用SPSS 17.0统计软件对结果进行分析,采用单因素方差分析对2组间差异进行分析,P<0.05时认为差异具有统计学意义。
2 结果
2.1 能量应激可诱导卵巢癌细胞中CPT1A表达上调
分别对卵巢癌细胞SKOV3进行HBSS培养3 h与6 h,利用qRT-PCR与western blot方法检测CPT1A表达后发现(图1):HBSS饥饿处理后,SKOV3细胞中CPT1A表达在mRNA与蛋白水平均显著升高;随HBSS饥饿处理时间由3 h延长到6 h,CPT1A表达呈逐步升高趋势。表明能量应激可上调CPT1A表达,且呈时间依赖效应。
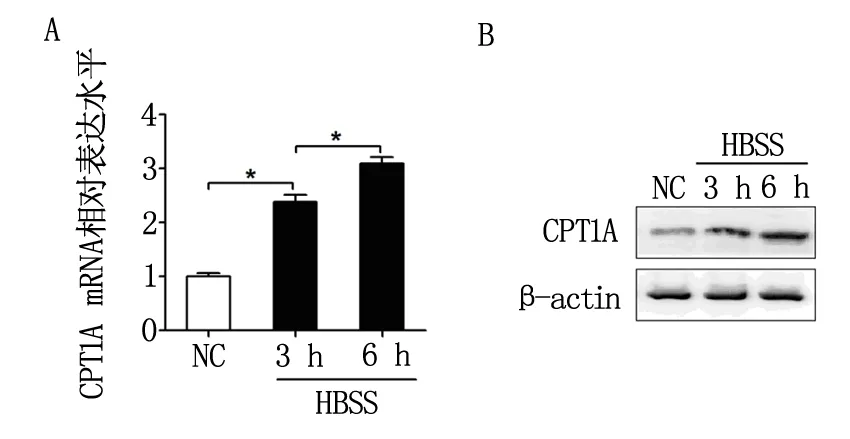
注:A:qRT-PCR实验分析;B:Western Blot实验分析。图1 能量应激(HBSS处理)对卵巢癌细胞中CPT1A表达的影响
2.2 下调CPT1A可加重饥饿诱导的细胞凋亡
为研究CPT1A在能量应激时卵巢癌细胞生存中的调控作用,我们首先合成了靶向CPT1A的siRNA干涉片段(si-CPT1A),将其转染SKOV3细胞并利用qRT-PCR与western blot对干涉效率进行检测后发现(图2A与2B):我们合成的siRNA可显著下调SKOV3细胞中CPT1A表达。
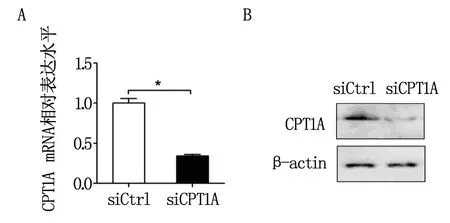
注:A:qRT-PCR实验分析;B:Western Blot实验分析。图2 siRNA下调卵巢癌SKOV3中CPT1A表达的效率分析
随后,我们利用流式细胞术,分析了下调CPT1A对饥饿处理时卵巢癌细胞存活的影响,结果如图3所示:用siRNA下调CPT1A表达后,饥饿诱导的卵巢癌细胞凋亡被显著增强,表明CPT1A具有抑制能量应激时卵巢癌细胞凋亡的作用。
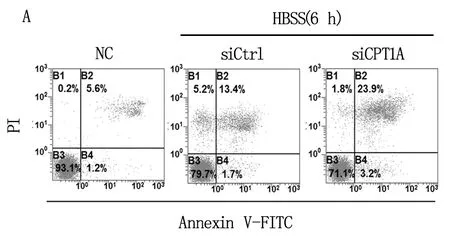
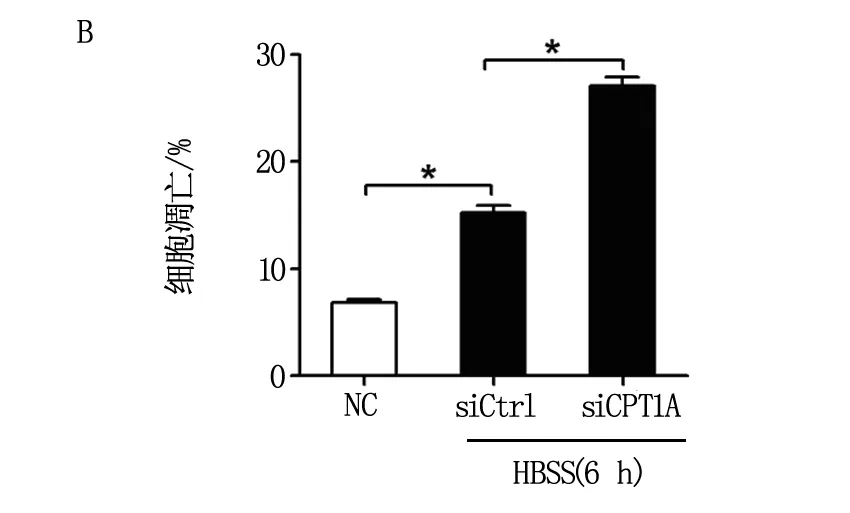
注:A为典型凋亡检测结果;B为统计分析结果。图3 流式细胞术分析下调CPT1A对卵巢癌细胞凋亡的影响
2.3 下调CPT1A可降低饥饿时卵巢癌细胞的氧耗与ATP生成
为初步探讨CPT1A是否通过增强脂肪酸氧化与能量ATP产生,进而发挥保护能量应激时卵巢癌细胞凋亡,我们进一步分析了下调CPT1A表达对能量应激时卵巢癌细胞氧气消耗速率与能量ATP产生的影响,结果如图4与图5所示:用siRNA下调CPT1A表达后,能量应激时卵巢癌细胞的氧气消耗速率与能量ATP产生均显著降低,提示下调CPT1A可能通过抑制脂肪酸氧化而加重饥饿时细胞的凋亡。
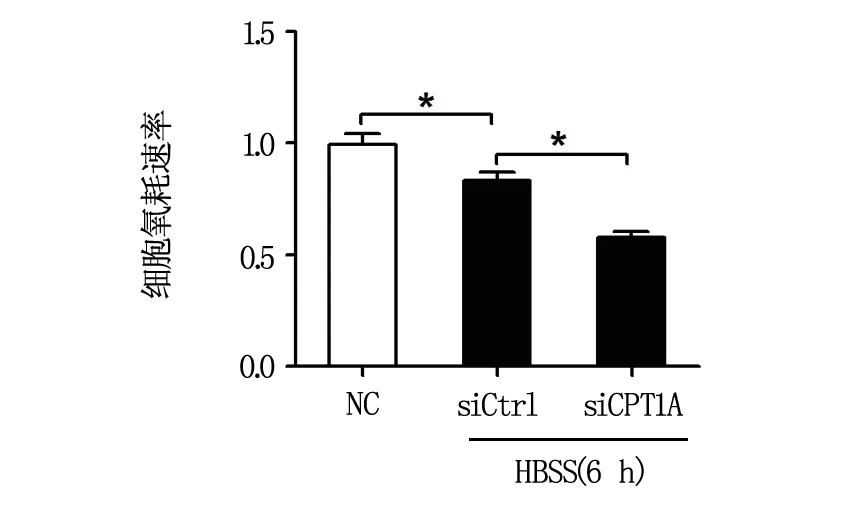
图4 下调CPT1A对能量应激时卵巢癌细胞氧耗速率的影响
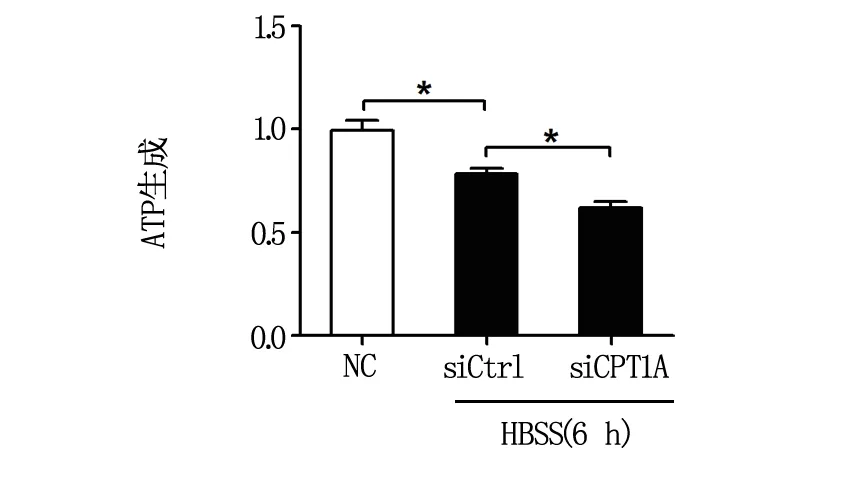
图5 下调CPT1A对能量应激时卵巢癌细胞ATP生成的影响
3 讨论
代谢重编程是肿瘤细胞新的十大特征之一,在肿瘤的发生发展过程中发挥关键作用,促进代谢重编程发生的分子机制是目前肿瘤研究领域的热点[8]。肿瘤细胞具有异常快速分裂增殖的特性,而与之相比,肿瘤的血管新生则相对滞后,常导致实体肿瘤内部出现慢性营养缺乏微环境,肿瘤细胞克服营养缺乏微环境得以存活的机制是该肿瘤代谢领域的重要科学问题之一[4,9]。目前观点认为,营养缺乏时肿瘤细胞主要通过使原有代谢特征发生转变,由以合成代谢为主转变为以氧化分解代谢为主,通过氧化分解胞内糖、脂等生物大分子,对营养缺乏做出适应性反应[10]。然而,哪些关键代谢酶介导了能量应激时肿瘤细胞代谢重编程并促进细胞存活尚不十分清楚。
CPT1A是参与细胞脂肪酸氧化调控的关键酶,负责将细胞浆中的游离脂肪酸转运至线粒体进行后续的氧化[7]。近年来,CPT1A被证实与多种肿瘤的发生发展相关。如Wang等研究发现,CPT1A介导的脂肪酸氧化可促进结直肠癌细胞的侵袭与转移能力[11]。此外,Xiong等研究证实,CPT1A被证实可通过调控血管内皮生长因子VEGF而促进乳腺癌的淋巴管生成[12]。Shi等在急性白血病中研究发现,CPT1A表达与患者预后显著相关,高表达患者具有较差的预后[13]。Tan等证实,通过RNA下调CPT1A可增强鼻咽癌对放疗的敏感性[14]。我们研究证实,CPT1A在能量应激时表达显著上调,下调CPT1A可加重饥饿诱导的细胞凋亡,表明CPT1A具有促进能量应激时肿瘤细胞存活的作用。因此,上述研究共同表明,CPT1A是一个重要的促癌基因,不但能在正常情况下促进肿瘤进展,也可在应激条件下促进肿瘤细胞存活。
CPT1A是重要的脂肪酸氧化调控酶,CPT1A发挥促能量应激时肿瘤细胞存活是否是通过促进脂肪酸氧化呢?为回答以上问题,我们对两个最主要的细胞氧化代谢指标(细胞氧气消耗速率与ATP生成)进行了分析并发现:下调CPT1A表达后,能量应激时卵巢癌细胞的氧气消耗速率与能量ATP产生均显著降低,表明CPT1A极可能是通过激活脂肪酸氧化而促进能量应激时卵巢癌细胞的存活。与我们结果类似,Sang-Min等的研究同样证实,增强的脂肪酸氧化可促进能量应激时肿瘤细胞的存活[15]。该研究发现能量应激可激活细胞内能量感受器AMPK(AMP-activated protein kinase),后者进一步磷酸化活化参与脂肪酸氧化第一步反应调控的关键酶ACC1(Acetyl-CoA carboxylas 1)活性,进而激活细胞内脂肪酸氧化,最终促进了肿瘤细胞的存活。上述结果共同提示:激活脂肪酸氧化是能量应激时肿瘤细胞存活的重要机制。
本研究首次在卵巢癌证实,能量应激时CPT1A表达显著上调,进一步通过促进脂肪酸氧化与ATP生成而促进肿瘤细胞存活。提示CPT1A是治疗卵巢癌的潜在分子靶标。
