安石榴苷通过miR-132-5p/TRAF6途径调控oxLDL诱导的血管平滑肌细胞损伤的分子机制
2021-03-01陈九霖
陈 刚 陈九霖 吴 俊
(黔西南州人民医院心血管内科,兴义 562400)
动脉粥样硬化是临床常见的一种炎症性疾病,其主要病理特征为脂质沉积形成动脉管壁脂肪条纹导致粥样斑块的形成,并可引发缺血性心脏病等心血管疾病,目前心血管疾病发病率与死亡率较高,发病率逐年上升[1-2]。研究表明动脉粥样硬化是增加心血管疾病发病率与死亡率的危险因素[3]。因而寻找治疗动脉粥样硬化的药物对心血管疾病的预防及治疗均具有重要意义。安石榴苷(punicalagin,PUN)是石榴皮多酚的主要活性成分,研究表明PUN具有抗炎、抗氧化等多种生理活性,还可通过抗氧化作用而减轻慢性支气管炎大鼠的炎症反应[4-5]。但PUN对动脉粥样硬化的治疗效果及其可能作用机制尚未可知。微小RNA-132-5p(microRNA-132-5p,miR-132-5p)在急性心肌梗死患者中呈低表达,药物处理后可能通过提高miR-132-5p的表达达到治疗效果[6]。StarBase预测显示肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)可能是miR-132-5p的靶基因,研究表明沉默TRAF6表达可抑制炎症相关细胞因子及炎症介质表达水平从而减轻内毒素/半乳糖诱导的小鼠急性肝损伤[7]。但PUN是否通过miR-132-5p/TRAF6途径调控氧化型低密度脂蛋白(oxidized low density lipoprotein,oxLDL)诱导的血管平滑肌细胞损伤尚未可知。本研究主要探讨PUN对oxLDL诱导的血管平滑肌细胞凋亡及炎症反应的影响及其分子机制。
1 材料与方法
1.1材料 PUN购自济宁天之蓝生物科技有限公司;人主动脉血管平滑肌细胞HA-VSMC购自美国ATCC细胞库;oxLDL购自上海鲁汶生物科技有限公司;杜氏改良培养基(DMEM)、胎牛血清均购自赛默飞世尔科技公司;miR-132-5p模拟物(mimics)及阴性对照(miR-NC)、miR-132-5p特异性寡核苷酸抑制剂(anti-miR-132-5p)及其阴性对照(anti-miR-NC)均购自广州锐博生物科技有限公司;Lipofectamine2000购自美国Invitrogen公司;TRIzol试剂、反转录与荧光定量PCR试剂盒均购自大连TaKaRa公司;膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡试剂盒购自上海碧云天生物技术有限公司;IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒购自上海酶联生物科技有限公司;兔抗人TRAF6抗体购自武汉艾美捷科技有限公司;兔抗人B淋巴细胞瘤-2相关蛋白(Bcl-2-associated X protein,Bax)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体购自上海玉博生物科技有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗购自北京索莱宝科技有限公司。
1.2方法
1.2.1药物处理及实验分组 人主动脉血管平滑肌细胞培养于含10%胎牛血清的DMEM培养基,置于37℃、体积分数5%CO2培养箱中培养,用50 mg/ml的oxLDL处理血管平滑肌细胞24 h构建动脉粥样硬化模型[8]。Con组采用等量生理盐水处理细胞。收集造模后的血管平滑肌细胞,用不同浓度的PUN处理 24 h,分别记作oxLDL+PUN-L组(5 μg/ml PUN)、oxLDL+PUN-M组(10 μg/ml PUN)、oxLDL+PUN-H组(20 μg/ml PUN)[9]。后续实验观察miR-132-5p过表达及抑制miR-132-5p表达对oxLDL诱导的血管平滑肌细胞损伤的影响,实验分组:oxLDL+miR-NC组(miR-NC转染至血管平滑肌细胞48 h,随后使用oxLDL处理24 h)、oxLDL+miR-132-5p组(miR-132-5p mimics转染至血管平滑肌细胞48 h,随后使用oxLDL处理24 h)、oxLDL+PUN+anti-miR-NC组(anti-miR-NC转染至血管平滑肌细胞48 h,随后用50 mg/ml oxLDL与20 μg/ml PUN共同处理24 h)、oxLDL+PUN+anti-miR-132-5p组(anti-miR-132-5p转染至血管平滑肌细胞48 h,随后用50 mg/ml oxLDL与20 μg/ml PUN共同处理 24 h)。
1.2.2ELISA检测IL-1β、TNF-α浓度 收集各组细胞培养上清,采用IL-1β、TNF-α ELISA检测试剂盒检测IL-1β、TNF-α浓度,严格按照试剂盒说明书进行操作。
1.2.3流式细胞术检测细胞凋亡 取各组血管平滑肌细胞,预冷PBS洗涤,加入1×Binding buffer制备细胞悬液(1×106个/ml),加入5 μl Annexin V-FITC与5 μl PI,室温避光孵育15 min,加入400 μl结合缓冲液置于流式细胞仪检测并计算细胞凋亡率。
1.2.4实时定量PCR(quantitative real-time reverse transcription PCR,qRT-PCR)检测细胞中miR-132-5p、TRAF6 mRNA表达水平 取oxLDL+miR-NC组、oxLDL+miR-132-5p组、oxLDL+PUN+anti-miR-NC组、oxLDL+PUN+anti-miR-132-5p组血管平滑肌细胞,采用TRIzol法提取细胞总RNA,利用紫外分光光度计检测RNA浓度。按照反转录试剂盒说明书配置反应体系得到cDNA。miR-132-5p正向引物:5′-TGGATCCCCCCCAGTCCCCGTCCCTCAG-3′,反向引物:5′-TGAATTCGGATACCTTGGCCGGGA-GGAC-3′;U6正向引物:5′-CTCGCTTCGGCAGC-ACA-3′,反向引物:5′-AACGCTTCACGAATTTGCGT-3′;TRAF6正向引物:5′-AGTTGTGTGCGTGTGACA-GT-3′,反向引物:5′-ATGTAGCTGCGTCGCTTGTA-3′;GAPDH正向引物:5′-AACGGATTTGGTCGTAT-TG-3′,反向引物:5′-GGAAGATGGTGATGGGATT-3′,引物均由上海生工生物工程股份有限公司合成。根据试剂盒说明书配置qRT-PCR反应体系,置于实时荧光定量PCR仪检测各基因Ct值,反应条件:95℃ 5 min,95℃ 30 s,60℃ 30 s,72℃ 30 s,共循环40次。miR-132-5p以U6为内参基因,TRAF6以GAPDH为内参基因,反应结束后,采用 2-ΔΔCt法计算miR-132-5p、TRAF6 mRNA相对表达量。
1.2.5荧光素酶报告基因检测 靶基因预测网站StarBase预测显示TRAF6的3′UTR中含有与miR-132-5p互补的核苷酸序列,将含有结合位点的TRAF6-3′UTR插入构建野生型载体WT-TRAF6,利用基因突变技术将结合位点进行突变,将含有突变位点的TRAF6-3′UTR插入构建突变型载体MUT-TRAF6,取对数期血管平滑肌细胞,将WT-TRAF6、MUT-TRAF6分别与miR-NC、miR-132-5p mimics共转染至血管平滑肌细胞,检测各组荧光素酶活性。为验证miR-132-5p对TRAF6表达的调控作用,通过Western blot检测miR-132-5p过表达或抑制miR-132-5p的表达后细胞中TRAF6蛋白表达情况,实验分组:miR-NC组、miR-132-5p组、anti-miR-NC组、anti-miR-132-5p组,转染时严格按照Lipofectamine2000试剂盒说明书进行操作。
1.2.6Western blot检测TRAF6、Bax、Bcl-2蛋白表达 收集各组对数期血管平滑肌细胞,加入蛋白裂解液提取蛋白,采用BCA法定量蛋白,加入5×上样缓冲液,沸水中煮10 min,蛋白变性,采用SDS-PAGE凝胶电泳分离蛋白,转膜、封闭,加入TRAF6(1∶1 000)、Bax(1∶800)、Bcl-2(1∶800)一抗,TBST洗膜,加入二抗(1∶5 000),TBST洗膜,滴加ECL反应,暗室内曝光显影,应用Quantity One软件检测条带灰度值,蛋白相对表达量=目的蛋白条带灰度值/内参照条带灰度值。
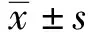
2 结果
2.1PUN对oxLDL诱导的血管平滑肌细胞炎症因子表达的影响 实验结果显示,与Con组相比,oxLDL组血管平滑肌细胞中促炎因子IL-1β、TNF-α水平均显著升高(P<0.05);与oxLDL组相比,oxLDL+PUN-L组、oxLDL+PUN-M组、oxLDL+PUN-H组血管平滑肌细胞中促炎因子IL-1β、TNF-α水平均显著降低(P<0.05);oxLDL+PUN-H组血管平滑肌细胞中促炎因子IL-1β、TNF-α水平均显著低于oxLDL+PUN-L组、oxLDL+PUN-M组(P<0.05),PUN不同剂量组间IL-1β、TNF-α水平比较差异有统计学意义(P<0.05),见表1。

表1 PUN对oxLDL诱导的血管平滑肌细胞炎症因子表达的影响
2.2PUN对oxLDL诱导的血管平滑肌细胞凋亡的影响 与Con组相比,oxLDL组血管平滑肌细胞凋亡率显著升高(P<0.05),Bcl-2蛋白相对表达量显著降低(P<0.05),Bax蛋白相对表达量显著升高(P<0.05);与oxLDL组相比,oxLDL+PUN-L组、oxLDL+PUN-M组、oxLDL+PUN-H组血管平滑肌细胞凋亡率显著降低(P<0.05),Bcl-2蛋白相对表达量显著升高(P<0.05),Bax蛋白相对表达量显著降低(P<0.05),PUN不同剂量组间比较差异有统计学意义(P<0.05),其中oxLDL+PUN-H组作用效果最为显著(P<0.05),见图1、表2。
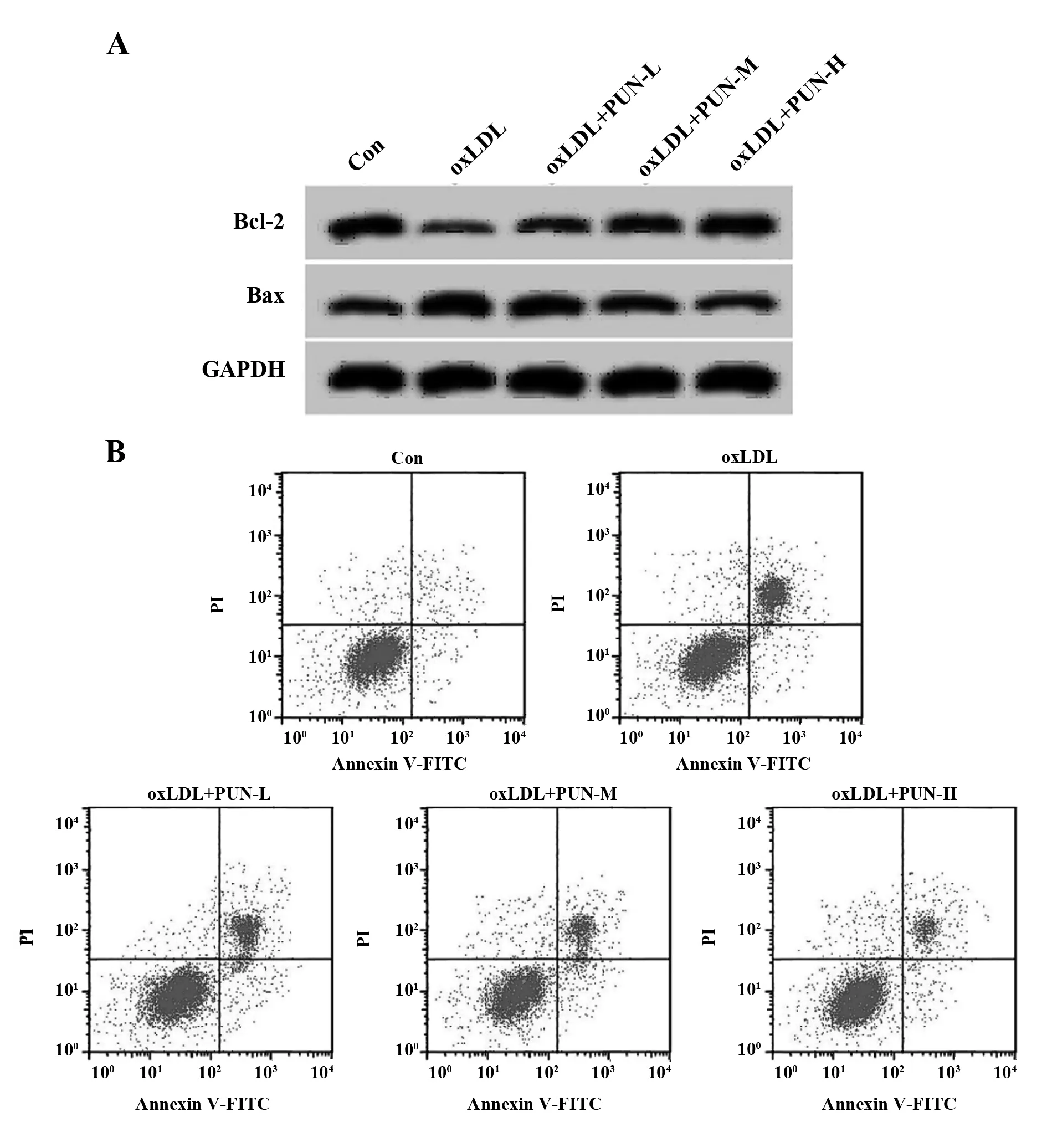
图1 PUN对oxLDL诱导的血管平滑肌细胞凋亡的影响
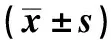
表2 PUN对oxLDL诱导的血管平滑肌细胞凋亡的影响
2.3PUN对oxLDL诱导的血管平滑肌细胞中miR-132-5p和TRAF6表达的影响 与Con组相比,oxLDL组血管平滑肌细胞中miR-132-5p的表达水平显著降低(P<0.05),TRAF6 mRNA及蛋白表达水平均显著升高(P<0.05);与oxLDL组相比,oxLDL+PUN-L组、oxLDL+PUN-M组、oxLDL+PUN-H组血管平滑肌细胞中miR-132-5p的表达水平显著升高(P<0.05),TRAF6 mRNA及蛋白表达水平均显著降低(P<0.05),PUN不同剂量组间比较差异有统计学意义(P<0.05),其中oxLDL+PUN-H组作用效果最为显著(P<0.05),见图2、表3。
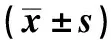
表3 PUN对oxLDL诱导的血管平滑肌细胞中miR-132-5p和TRAF6表达的影响
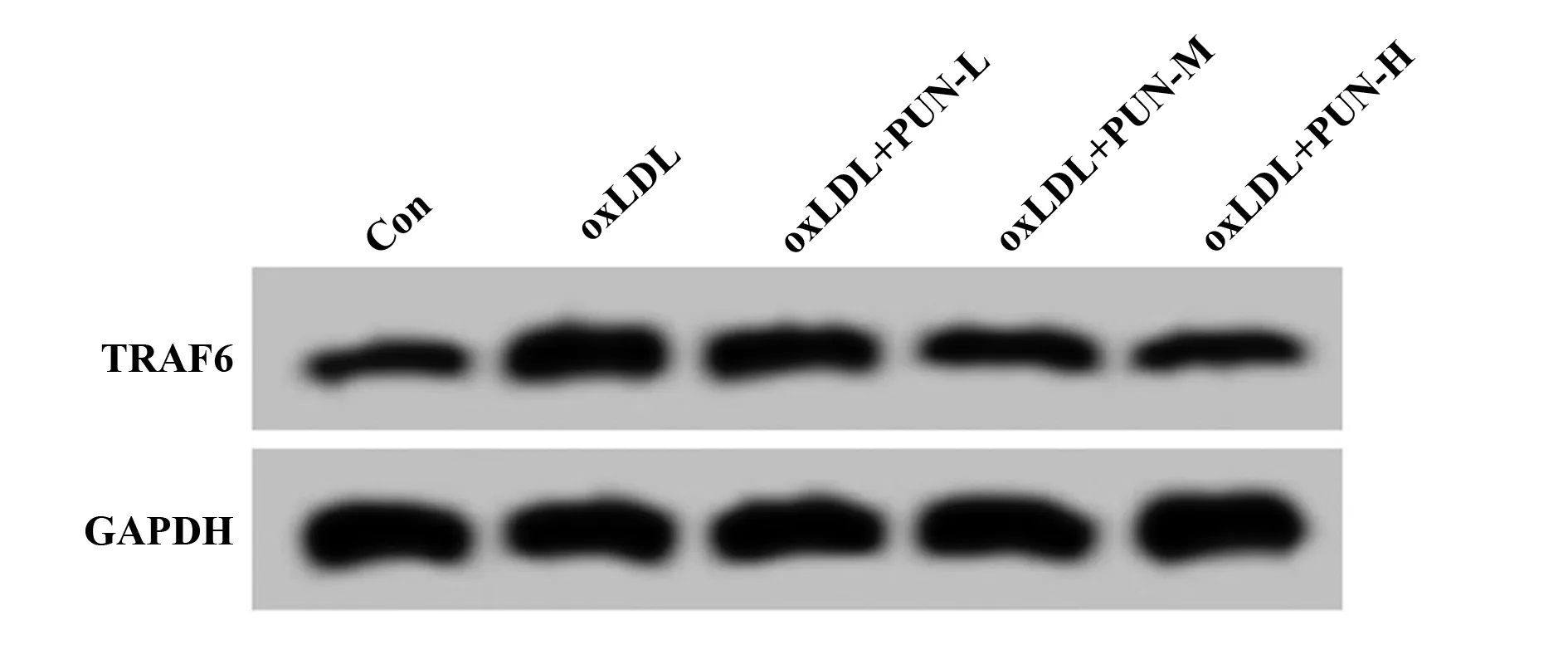
图2 TRAF6蛋白表达
2.4miR-132-5p靶向调控TRAF6的表达 StarBase预测显示TRAF6的3′UTR中含有与miR-132-5p互补的核苷酸序列,见图3A。双荧光素酶报告实验结果显示,转染野生型载体WT-TRAF6的细胞中,与miR-NC组相比,miR-132-5p组荧光素酶活性显著降低(P<0.05);转染突变型载体MUT-TRAF6的细胞中,miR-132-5p组与miR-NC组荧光素酶活性相比差异无统计学意义(P>0.05),见表4。Western blot检测结果显示,与miR-NC组比较,miR-132-5p组TRAF6蛋白相对表达量显著降低(P<0.05);与anti-miR-NC组比较,anti-miR-132-5p组TRAF6蛋白相对表达量显著升高(P<0.05),见图3B、表5。
表4 双荧光素酶报告实验
表5 miR-132-5p调控TRAF6蛋白表达
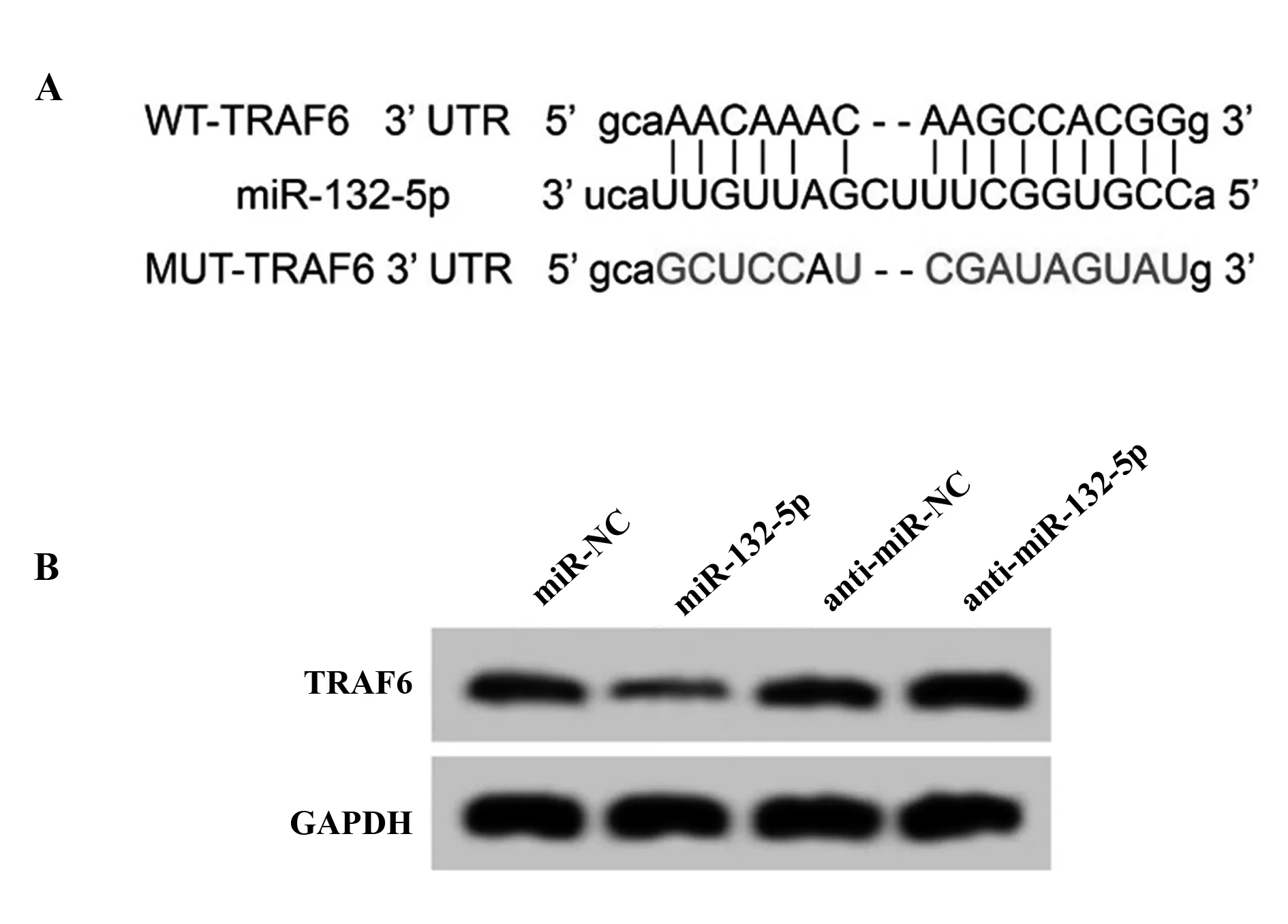
图3 miR-132-5p靶向调控TRAF6的表达
2.5miR-132-5p过表达对oxLDL诱导的血管平滑肌细胞损伤的影响 与oxLDL+miR-NC组比较,oxLDL+miR-132-5p组血管平滑肌细胞中miR-132-5p的表达水平显著升高(P<0.05),TRAF6蛋白相对表达量显著降低(P<0.05),促炎因子IL-1β、TNF-α水平均显著降低(P<0.05),细胞凋亡率显著降低(P<0.05),Bax蛋白相对表达量显著降低(P<0.05),Bcl-2蛋白相对表达量显著升高(P<0.05),见图4、表6。
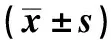
表6 miR-132-5p过表达对oxLDL诱导的血管平滑肌细胞损伤的影响
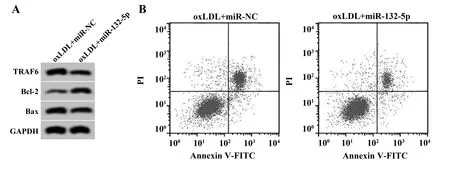
图4 miR-132-5p过表达对oxLDL诱导的血管平滑肌细胞凋亡的影响
2.6抑制miR-132-5p表达逆转PUN(20 μg/ml)对oxLDL诱导的血管平滑肌细胞损伤的作用 与oxLDL+PUN+anti-miR-NC组相比,oxLDL+PUN+anti-miR-132-5p组血管平滑肌细胞中miR-132-5p的表达水平显著降低(P<0.05),TRAF6蛋白相对表达量显著升高(P<0.05),促炎因子IL-1β、TNF-α水平显著升高(P<0.05),细胞凋亡率显著升高(P<0.05),Bax蛋白相对表达量显著升高(P<0.05),Bcl-2蛋白相对表达量显著降低(P<0.05),见图5、表7。
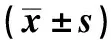
表7 抑制miR-132-5p表达逆转了PUN对oxLDL诱导的血管平滑肌细胞损伤的作用
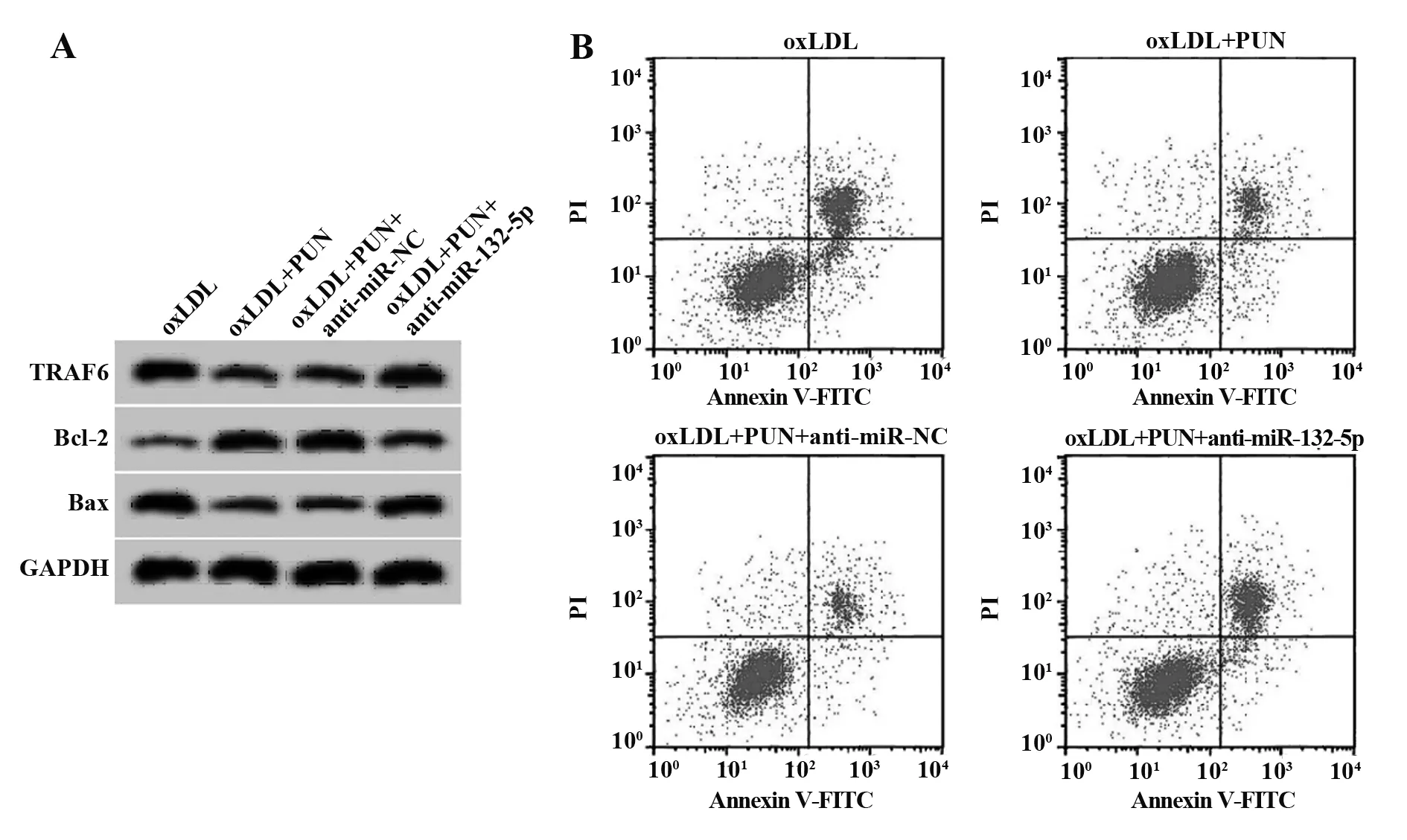
图5 抑制miR-132-5p表达逆转PUN对oxLDL诱导的血管平滑肌细胞凋亡的作用
3 讨论
动脉粥样硬化的发病机制尚未阐明,研究表明血管平滑肌细胞过度凋亡、炎症反应可能是引发动脉粥样硬化的重要原因[10]。目前临床主要采用降胆固醇或降血压、抗炎等药物治疗动脉粥样硬化,既往研究显示部分药物可通过抑制血管炎症及血管平滑肌细胞凋亡从而抑制动脉粥样硬化的发生及发展,但副作用较大[11]。因而寻找安全且副作用较小的中草药提取物具有重要意义。
PUN具有抗氧化、抗癌、抗炎等功能,可有效缓解肿瘤、炎症相关性疾病等多种疾病发生及发展[12]。研究表明PUN可通过抗氧化作用减轻脑缺血再灌注损伤[13]。相关报道指出PUN可通过降低心肌氧化应激、减少心肌细胞凋亡从而减轻心肌缺血再灌注损伤[14]。但PUN对oxLDL诱导的血管平滑肌细胞损伤的影响尚未可知。本研究结果显示oxLDL处理后促炎因子IL-1β、TNF-α水平显著升高,与相关文献结论相似[15]。提示成功建立oxLDL诱导的血管平滑肌细胞动脉粥样硬化模型。不同浓度的PUN处理后细胞中促炎因子IL-1β、TNF-α水平显著降低,且呈剂量依赖性。提示PUN可减轻oxLDL诱导的血管平滑肌细胞炎症反应。血管平滑肌细胞异常凋亡可促进动脉粥样硬化斑块的形成从而促进动脉粥样硬化发展,研究表明Bcl-2是抑制细胞凋亡基因,Bax是促凋亡基因,Bcl-2表达水平升高、Bax表达水平降低则细胞凋亡被抑制[16-17]。本研究结果显示,oxLDL处理后细胞凋亡率显著升高,而PUN处理后细胞凋亡率显著降低,随着PUN使用剂量的增加而显著降低,进一步研究显示oxLDL可降低细胞中Bcl-2的表达,促进Bax的表达,而PUN处理后细胞中Bcl-2的表达水平显著升高,Bax的表达水平显著降低,且随着PUN使用剂量的增加而明显变化,提示PUN可减弱动脉粥样硬化模型中人主动脉血管平滑肌细胞凋亡。
miR-132-5p在急性心肌梗死患者血浆中表达下调,并可作为急性心肌梗死早期诊断的生物标志物[18]。研究表明TRAF6激活后可诱导单核/巨噬细胞产生TNF-α等炎症因子而引发动脉壁炎症反应从而促进动脉粥样硬化发生及发展[19]。相关报道指出抑制TRAF6的表达可能通过抑制TLR4信号通路而抑制炎症因子的释放从而抑制动脉粥样硬化的发生[20]。本研究通过双荧光素酶报告实验与Western blot实验证实miR-132-5p可靶向结合TRAF6,并可负向调控TRAF6的表达,进一步研究显示miR-132-5p过表达可通过下调TRAF6的表达,降低炎症因子IL-1β、TNF-α水平,抑制oxLDL诱导的血管平滑肌细胞凋亡,还可促进Bcl-2的表达,而抑制Bax的表达,提示miR-132-5p过表达可通过靶向TRAF6减弱oxLDL诱导的血管平滑肌细胞凋亡,抑制炎症反应。同时本研究进一步分析显示抑制miR-132-5p的表达后可明显逆转PUN对oxLDL诱导的血管平滑肌细胞凋亡及炎症反应的抑制作用。提示PUN可能通过上调miR-132-5p的表达及下调TRAF6的表达从而改善凋亡标记蛋白表达的异常,抑制促炎因子水平的升高从而减缓动脉粥样硬化发展进程。
综上所述,PUN可通过调控miR-132-5p/TRAF6分子轴而发挥抗炎及抑制血管平滑肌细胞凋亡的作用,可为动脉粥样硬化新药的研发提供理论依据。但仍需进行体内实验探索PUN对动脉粥样硬化的影响。
