LncRNA ITGB2-AS1靶向miR-338-3p对肺癌细胞多西他赛耐药性的影响
2021-03-01杨士杰刘春盛高丽环
杨士杰,刘春盛,高丽环
0 引言
越来越多的研究表明,长链非编码RNA(lncRNA)在肺癌细胞生长、凋亡和转移等过程中起调节作用[1]。许多测序技术表明,lncRNA在耐药和敏感肺癌细胞中的表达不同,可能参与肺癌耐药的分子机制[2]。LncRNA ITGB2-AS1(ITGB2 antisense RNA1)在胰腺导管腺癌[3]、骨肉瘤组织和细胞[4]中表达上调,下调或敲低ITGB2-AS1表达可抑制癌细胞的增殖和转移等过程。本研究通过LncBase Predicted v.2预测发现,miR-338-3p与ITGB2-AS1存在结合位点。miR-338-3p在非小细胞肺癌组织中表达下调[5],上调其表达可抑制癌细胞的增殖和克隆形成,诱导细胞凋亡。但ITGB2-AS1在肺癌中的表达作用,及其与miR-338-3p在肺癌多西他赛耐药细胞中的关系目前还尚未可知。本项目主要研究 lncRNA ITGB2-AS1和miR-338-3p对肺癌耐药细胞A549/DTX增殖、凋亡和多西他赛耐药性的影响,以期为肺癌的多西他赛耐药性提供新的研究方向。
1 材料与方法
1.1 材料 人肺癌细胞株A549购自ATCC;多西他赛(Docetaxel,DTX)购自江苏奥赛康药业有限公司;胎牛血清(Fetal bovine serum,FBS)和RPMI-1640培养液购自美国Hyclone公司,引物、si- ITGB2-AS1和阴性对照si-NC、miR-NC、miR-338-3p mimics(miR-338-3p)、pcDNA和pcDNA-ITGB2-AS1、anti-miR-NC和anti-miR-338-3p均购自上海吉玛制药有限公司。胰蛋白酶、RNA提取试剂Trizol购自美国Sigma-Aldrich公司;Lipofectamine 2000转染试剂、Real-time PCR试剂盒、反转录试剂盒(RT-PCR)购自宝生物工程(大连)有限公司;双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)购自美国Promega公司;CyclinD1、p21、Bax、Bcl-2和GAPDH抗体购自美国Santa cruz公司;细胞凋亡检测试剂盒、BCA蛋白检测试剂盒购自上海碧云天生物技术有限公司;流式细胞仪购自BD公司;Real-time PCR仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养和A549/DTX耐药细胞系的建立 将A549细胞培养于含10 % FBS、100 U/ml青霉素-100 μg/ml链霉素的RPMI-1640培养基中,于37 ℃ 5% CO2培养箱中培养。根据文献[6]采用DTX小剂量、梯度间歇诱导法使A549细胞产生DTX耐药性。将A549细胞培养在含0.5 μg/L DTX的RPMI-1640培养基中,24 h后去除死细胞换培养液,用脱药新鲜培养液培养2周,待细胞恢复对数生长期时,再用较高浓度DTX培养液筛选诱导,重复上述诱导过程,直至A549细胞可稳定生长于含终浓度50 μg/L DTX的培养液中,获得肺癌多西他赛耐药A549/DTX细胞。
1.2.2 CCK8实验检测细胞增殖抑制率和IC50将DTX处理或/和转染后的A549、A549/DTX细胞以3×104个细胞/孔接种于96微孔板中,每孔100 μl细胞,过夜培养后在培养液中加入终浓度为6.25 μg/L、12.5 μg/L、25 μg/L、50 μg/L、100 μg/L、200 μg/L的DTX,培养24 h,每孔加入 10 μl CCK8溶液,培养2h,酶标仪测定450 nm 吸光度(A)值。抑制率%=(对照组A值-实验组A值)/对照组A值×100%。以药物浓度和抑制率分别为横轴和纵轴,绘制浓度效应曲线,计算半数抑制浓度IC50。
1.2.3 Real-time PCR检测lncRNA ITGB2-AS1和miR-338-3p的表达 用Trizol试剂提取A549和A549/DTX细胞总RNA,然后按照反转录PCR试剂盒说明书合成cDNA,取cDNA按照Real-time PCR的说明书进行反应检测lncRNA ITGB2-AS1和miR-338-3p的含量。引 物 如 下:miR-338-3p上游引物:5′-GGGTCCAGCATCAGTGATT-3′,下游引物:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGGCCTCAGA-3′;lncRNA ITGB2-AS1上游引物:5′-AGGAGATGGAACGAGGAAA-3′,下游引物5′- TTAGTGGTCTGCGAAGGTG-3′;U6上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′;GAPDH上游引物5′-GTCAACGGATTTGGTCTGTATT-3′,下游引物 5′-AGTCTTCTGGGTGGCAGTGAT-3’。运用 2-ΔΔCt法进行数据分析。
1.2.4 细胞转染 将对数生长期A549/DTX细胞以2×105个细胞/孔接种于6孔板中,细胞融合为一层时进行转染。根据Lipofectamine 2 000转染试剂试剂盒说明书将si-NC、si-ITGB2-AS1、miR-NC、miR-338-3p、pcDNA、pcDNA-ITGB2-AS1、si-ITGB2-AS1+anti-miR-NC、si-ITGB2-AS1+anti-miR-338-3p等各组载体或片段转染入A549细胞,分别记为si-NC组、si-ITGB2-AS1组、miR-NC组、miR-338-3p组、pcDNA组、pcDNA-ITGB2-AS1组、si-ITGB2-AS1+anti-miR-NC组、si-ITGB2-AS1+anti-miR-338-3p组。转染48 h,收集细胞。
1.2.5 流式细胞术检测细胞凋亡率 将转染后的各组A549/DTX细胞培养至对数生长期,用含12.5 μg/L DTX无血清RPMI-1640培养基,培养24h,收集细胞,洗涤并稀释为1×106个细胞/ml,根据凋亡试剂盒说明书进行操作,取100 μl标记缓冲液重悬细胞,然后加入5 μl膜联蛋白V-FITC(Annexin V-FITC)和 10 μl碘化丙啶(PI),室温避光15 min,流式细胞仪分析细胞凋亡率。
1.2.6 Western blot实验 收集转染并经12.5 μg/L DTX处理的各组A549/DTX细胞,破碎细胞,收集蛋白并检测浓度。进行SDS-PAGE,转膜,脱脂奶粉室温封闭2 h,加入一抗(CyclinD1 1∶2 000、p21 1∶1 000、Bax 1∶2 000、Bcl-2抗体1∶1 000和GAPDH抗体1∶4 000),置于4 ℃过夜孵育。PBST缓冲液洗膜3次,然后加入稀释的二抗,室温孵育1 h,显影,拍照。以GAPDH为内参照,分析蛋白水平。
1.2.7 双荧光素酶报告系统实验 根据方法1.2.4将构建的lncRNA ITGB2-AS1的野生型(WT-ITGB2-AS1)和突变型(MUT-ITGB2-AS1)报告载体分别与miR-NC或miR-338-3p共转染A549/DTX细胞,转染48 h,收集细胞,裂解细胞,离心收集上清,检测上清中荧光素酶活性。以海肾荧光素酶活性为内参照,计算相对萤火虫荧光素酶活性。
2 结果
2.1 多西他赛对肺癌A549细胞和多西他赛耐药细胞A549/DTX抑制率的影响 用浓度6.25 μg/L、12.5 μg/L、25 μg/L、50 μg/L、100 μg/L、200 μg/L的多西他赛(DTX)分别处理肺癌细胞A549和肺癌多西他赛耐药细胞A549/DTX,结果发现,随着浓度的升高,DTX对A549细胞和A549/DTX的抑制率逐渐升高,但最高浓度200 μg/L DTX对A549/DTX的抑制率(43.69±4.58)%显著低于A549(84.25±8.04)%,DTX对A549和A549/DTX细胞的IC50分别为(23.57±2.11) μg/L和(256.80±10.22)μg/L,见表1。说明DTX对A549/DTX细胞的抑制率显著低于A549细胞。后续实验选择对A549/DTX抑制率在10%左右的DTX浓度12.5 μg/L,此浓度对细胞影响较小。

表1 多西他赛对肺癌A549细胞和肺癌多西他赛耐药细胞A549/DTX抑制率的影响
2.2 lncRNA ITGB2-AS1和miR-338-3p肺癌A549细胞和肺癌多西他赛耐药细胞A549/DTX中的表达 检测肺癌A549细胞和肺癌多西他赛耐药细胞A549/DTX,结果发现,lncRNA ITGB2-AS1 在A549/DTX中含量显著高于A549细胞(P<0.05),miR-338-3p在A549/DTX中含量显著低于A549细胞(P<0.05),见表2。

表2 lncRNA ITGB2-AS1和miR-338-3p在肺癌A549和多西他赛耐药细胞A549/DTX中的表达
2.3 抑制lncRNA ITGB2-AS1表达联合多西他赛(12.5 μg/L)对A549/DTX细胞增殖和凋亡的影响 与DTX+si-NC组相比,DTX+si-ITGB2-AS1组A549/DTX细胞中lncRNA ITGB2-AS1含量降低,细胞抑制率和凋亡率均升高,Cyclin D1和Bcl-2蛋白含量降低,p21和Bax含量升高,差异均具有统计学意义(P<0.05),见图1和表3。说明抑制ITGB2-AS1联合12.5 μg/L DTX处理可抑制A549/DTX细胞增殖,促进细胞凋亡,增强多西他赛对细胞的抑制率。

图1 抑制lncRNA ITGB2-AS1表达联合多西他赛对肺A549/DTX细胞增殖和凋亡的影响注:A.增殖、凋亡相关蛋白表达;B.细胞凋亡流式图

表3 抑制lncRNA ITGB2-AS1表达联合多西他赛对A549/DTX细胞增殖、凋亡的影响
2.4 ITGB2-AS1靶向调控miR-338-3p的表达 通过LncBase Predicted v.2预测发现,miR-338-3p序列中含有与lncRNA ITGB2-AS1互补的结合位点,见图2。双荧光素酶报告实验结果表明,与miR-NC组相比,过表达miR-338-3p组共转染野生型WT-ITGB2-AS1的萤火虫荧光素酶相对活性显著降低(P<0.05),而突变型MUT-ITGB2-AS1的荧光素酶相对活性无明显变化,见表4。qRT-PCR结果发现,过表达 lncRNA ITGB2-AS1可显著下调miR-338-3p含量(P<0.05);抑制lncRNA ITGB2-AS1可上调miR-338-3p含量(P<0.05),见表5。说明lncRNA ITGB2-AS1靶向负调控miR-338-3p的表达。

表4 双荧光素酶报告实验
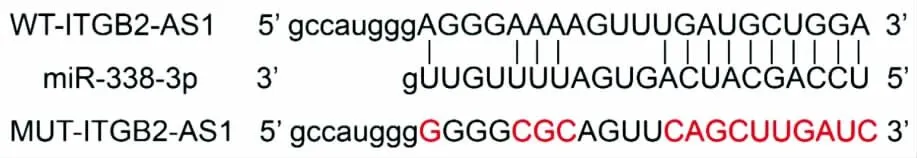
图2 ITGB2-AS1的序列中含有与miR-338-3p互补的核苷酸序列
2.5 下调miR-338-3p表达逆转了抑制lncRNA ITGB2-AS1对A549/DTX细胞多西他赛耐药性的影响 与DTX+si-ITGB2-AS1+anti-miR-NC组相比,DTX+si-ITGB2-AS1 + anti-miR-338-3p组A549/DTX细胞中miR-338-3p含量降低,细胞抑制率和凋亡率均降低,CyclinD1和Bcl-2表达量升高,p21和Bax表达量降低,差异均具有统计学意义(P<0.05),与2.3结果相反,见图3和表5。说明下调miR-338-3p逆转了抑制lncRNA ITGB2-AS1对A549/DTX细胞增殖、凋亡和多西他赛耐药性的作用。

表5 lncRNA ITGB2-AS1调控miR-338-3p的表达
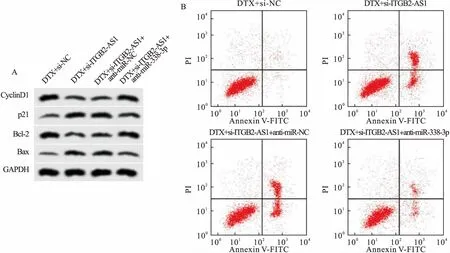
图3 下调miR-338-3p表达逆转了抑制lncRNA ITGB2-AS1对A549/DTX细胞多西他赛耐药性的影响注:A.增殖、凋亡相关蛋白表达;B.细胞凋亡流式图

表5 下调miR-338-3p表达逆转了抑制lncRNA ITGB2-AS1对A549/DTX细胞多西他赛耐药性的作用
3 讨论
研究表明,lncRNA在肺癌、乳腺癌和胃癌等多种肿瘤组织中出现差异表达,可能通过对多种靶点和途径的失调导致耐药的发生[7]。最近研究报道,lncRNA ITGB2-AS1在乳腺癌细胞中被骨形态发生蛋白9(BMP9)下调,其可通过上调ITGB2促进乳腺癌细胞的迁移和侵袭[8]。lncRNA ITGB2-AS1在胰腺导管腺癌(PDAC)中表达上调,可能是PDAC的诊断生物标志物[9],在体内敲低其表达,可靶向miR-4319/RAF1轴抑制PDAC细胞的增殖、迁移侵袭,促进细胞凋亡[3]。还有研究通过采用加权基因共表达网络分析(WGCNA)方法构建共表达基因模块,发现lncRNA ITGB2-AS1与与卵巢癌患者的总生存率显著相关[10],但其在肺癌中的表达情况和作用尚不清楚。本研究通过建立肺癌多西他赛耐药细胞系A549/DTX,检测不同浓度(6.25 μg/L、12.5 μg/L、25 μg/L、50 μg/L、100 μg/L、200 μg/L)的DTX对肺癌A549和A549/DTX细胞的抑制率和IC50,发现DTX对A549/DTX的抑制率显著低于A549细胞,IC50高于A549细胞,lncRNA ITGB2-AS1在A549/DTX细胞中表达显著上调,与其他研究者的结论[3-4,9]类似,在A549/DTX细胞中转染si-ITGB2-AS1联合DTX处理可促进A549/DTX细胞的抑制率及细胞凋亡,上调p21和Bax含量,下调CyclinD1和Bcl-2蛋白含量,说明lncRNA ITGB2-AS1可能是肺癌潜在的化疗增敏靶点。
本研究通过LncBase v.2预测发现,miR-338-3p与lncRNA ITGB2-AS1存在结合位点。miR-338-3p在多种癌症中发挥肿瘤抑制因子的作用,在前列腺癌[11]、乳腺癌[12]、胃癌[13]和结直肠癌[14]中表达下调,上调其表达可靶向不同的基因抑制癌细胞的增殖和进展。miR-338-3p在高转移非小细胞肺癌(NSCLC)细胞株和临床转移组织中显著下调,其通过靶向参与EMT过程的Sox4,在体内外均能抑制NSCLC细胞的迁移和侵袭[15]。miR-338-3p也可通过靶向鞘氨醇激酶2(SphK2)或胰岛素受体底物2(IRS2)在NSCLC中发挥抑癌作用[16-17]。miR-338-3p还可通过下调WNT2B,增强卵巢癌细胞对顺铂的敏感性[18],通过靶向缺氧诱导因子1α(HIF-1α),抑制肝癌细胞并增强其对索拉非尼敏感性[19]。上述研究均表明miR-338-3p与肿瘤细胞的进展及耐药性有关。本研究结果发现,miR-338-3p在A549/DTX中含量显著低于A549细胞,与Li等人[15]的研究结论类似。双荧光素酶报告实验和qRT-PCR结果表明,lncRNA ITGB2-AS1靶向负调控miR-338-3p的表达;进一步实验还发现,下调miR-338-3p可逆转抑制lncRNA ITGB2-AS1对A549/DTX细胞增殖、凋亡和多西他赛耐药性的作用,验证了在肺癌中两者之间存在靶向调控关系。
本研究阐述了与肺癌A549细胞相比,在肺癌DTX耐药细胞A549/DTX中,lncRNA ITGB2-AS1表达上调,miR-338-3p表达下调,lncRNA ITGB2-AS1靶向miR-338-3p调控A549/DTX细胞增殖、凋亡和多西他赛耐药性。LncRNA ITGB2-AS1可能是肺癌潜在的化疗增敏靶点。
