奥希替尼治疗不同中性粒细胞/淋巴细胞比值的T790M基因突变肺腺癌骨转移患者的疗效比较
2021-02-25陈珑王翠英王琳何冬雷冯军
陈珑 王翠英 王琳 何冬雷 冯军
肺癌是全球最常见的恶性肿瘤之一,其中骨转移在酪氨酸激酶抑制剂(TKI)治疗后耐药的T790M基因突变的肺腺癌等晚期非小细胞肺癌中的发生率非常高[1-2]。奥希替尼是近年来证据级别最高的对第1、2代TKI耐药的携带T790M耐药基因突变肺癌的一线靶向药物[3-4]。血常规检查中与炎症相关的细胞成分尤其是中性粒细胞/淋巴细胞比值(NLR)可能影响肺癌患者的复发、转移和生存,NLR对肺癌等多种恶性肿瘤的预后有预测价值。有研究发现,NLR与肺癌预后可能呈负相关[5-6]。我们通过对50例接受奥希替尼靶向药物治疗的肺腺癌骨转移T790M基因突变患者进行随访,旨在比较奥希替尼治疗不同NLR的T790M基因突变肺腺癌骨转移患者的疗效是否存在差异。
对象与方法
1.对象:2015年2月~2018年8月海南省三亚中心医院收治的肺腺癌骨转移患者50例。纳入标准:(1)经组织病理检查确诊为肺腺癌;(2)经高通量测序检测T790M基因状态为耐药型突变型阳性;(3)经同位素全身骨扫描(ECT)、MRI、CT、正电子发射断层显像/X线计算机体层成像(PET/CT)或病理活检等检查排除其他骨骼疾病;(4)在奥希替尼治疗前1个月内接受血常规检查;(5)无骨转移灶手术、放疗或局部治疗指征或拒绝骨转移灶手术、放疗或局部治疗;(6)符合靶向药物治疗适应证。排除标准:(1)严重心、肺、肝、肾功能不全;(2)骨髓抑制;(3)间质性肺疾病;(4)美国东部肿瘤协作组(ECOG)体力状态评分结果显示体力状态极差无法耐受靶向治疗、唑来膦酸等药物过敏;(5)患者本人拒绝使用靶向分子药物等。
2.方法
(1)治疗方法:所有患者均口服奥希替尼80 mg每日1次,均联合静脉滴注唑来膦酸4mg治疗骨转移,每月1次。一直使用至肿瘤进展,不能耐受不良反应者予以减量或暂停用药。口服奥希替尼腹泻者予蒙脱石散、盐酸洛哌丁胺止泻,静脉滴注唑来膦酸发热者予退热对症处理。
(2)NLR检测:奥希替尼治疗前1个月内检查血常规,如果多次检查则选取最接近奥希替尼开始治疗日期者计算NLR。
(3)疗效及不良反应评价:所有患者均随访至2019年2月,随访率为98.7%,若有失访患者则按删失计算。按照WHO实体瘤评估标准[2]对肺癌治疗疗效进行评价,分为完全缓解(CR)、部分缓解(PR)、病变稳定(SD)和疾病进展(PD),客观有效率(ORR,%)=(CR+PR)/总例数×100%,疾病控制率(DCR,%)=(CR+PR+SD)/总例数×100%。化疗2周期后复查评价疗效。每个治疗周期开始前进行病史询问、体格检查及血常规、肝肾功能、甲胎蛋白(AFP)、心电图、CT或MRI、超声检查,观察Karnofsky卡氏评分变化。随访评估中位生存时间。观察不良反应,按WHO抗癌药物不良反应标准评价,分为0~Ⅳ度。

结 果
1.高NLR组和低NLR组患者临床资料比较:50例患者接受奥希替尼靶向治疗前的中位NLR为2.34,平均NLR为2.74。ROC曲线分析结果显示,以奥希替尼治疗前NLR判断患者接受治疗后的生存状态,ROC曲线下面积为0.572(P=0.006),约登指数最大时的NLR为2.1,因此以奥希替尼治疗前NLR为2.1作为界值,将50例患者分为高NLR组(>2.1,27例)和低NLR组(≤2.1,23例)。两组性别、年龄及ECOG评分为0分、有吸烟史、原发灶行手术治疗、N分期为N1期、有恶性胸腔积液、转移器官数量>1个、有接受1、2代表皮生长因子受体(EGFR)-酪氨酸激酶抑制剂(TKIs)治疗史患者比例及使用奥希替尼治疗时长比较差异均无统计学意义(P>0.05)。见表1。
2.高NLR组与低NLR组患者疗效比较:高NLR组无CR患者,PR 6例(22.2%),SD 6例(22.2%),PD 8例(29.6%),ORR为22.2%,DCR为44.4%。低NLR组无CR患者,PR 12例(52.2%),SD 5例(21.7%),PD 6例(26.1%),ORR为52.2%,DCR为73.9%。低NLR组患者的ORR和DCR均高于高NLR组(P<0.05)。
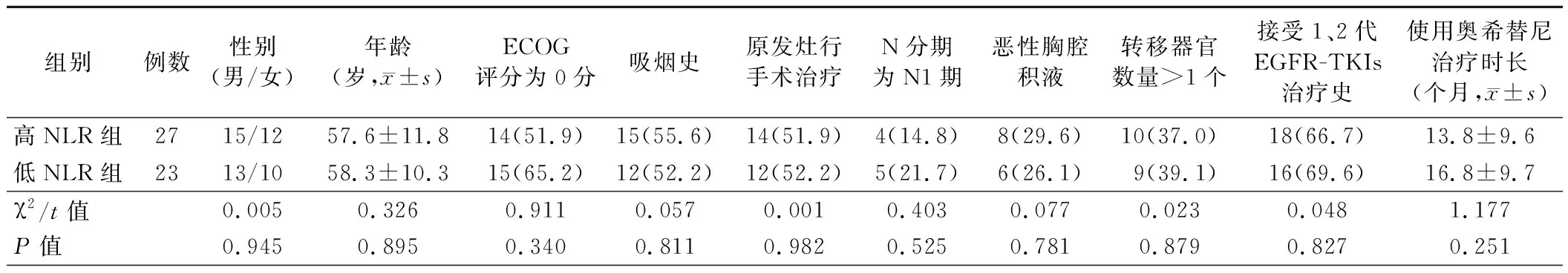
表1 高NLR组和低NLR组患者临床资料比较[例,(%)]
3.高NLR组与低NLR组患者生存分析结果比较:Kaplan-Meier曲线分析结果显示,高NLR组患者的中位生存期为13.0个月,生存期最短者为7.0个月,生存期最长者为47.0个月,现已死亡;低NLR组患者的中位生存期为29.0个月,生存期最短者为13.0个月,生存期最长者为42.0月,现肿瘤评价稳定,带瘤生存。低NLR组患者的总生存率高于高NLR组(P<0.05)。见图1。

图1 高NLR组和低NLR组患者生存率比较
4.高NLR组与低NLR组患者不良反应比较:服用奥希替尼的主要不良反应包括胃肠道反应、皮肤毒性、疲乏、骨髓抑制。两组患者均未出现Ⅲ~Ⅳ级的严重不良反应,均无因不良反应减量或停药退出本研究。高NLR组和低NLR组患者不良反应的总发生率比较差异无统计学意义(77.8%比78.2%,P>0.05),以上不良反应均较轻微,经护胃止吐、止泻、抗皮肤毒性等对症支持治疗可缓解。见表2。
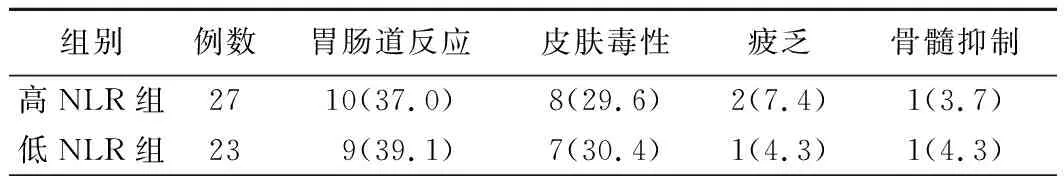
表2 高NLR组与低NLR组患者不良反应发生情况比较[例,(%)]
讨 论
目前T790M耐药基因突变的肺腺癌骨转移治疗方法主要为应用第3代TKIs奥希替尼或含铂双药化疗、骨转移灶的放疗、局部治疗及双膦酸盐治疗。奥希替尼耐药后体力状态较好的患者仍推荐继续维持奥希替尼治疗和骨转移灶进展后的局部治疗[6]。国内外研究发现包括肺癌在内恶性肿瘤患者的NLR与肿瘤微环境中免疫细胞密度呈负相关,且即使接受过抗肿瘤治疗,NLR>2.18的肺腺癌患者多预后不良;治疗前低NLR患者的生存时间及疗效均优于高NLR患者[7-9]。
国外有回顾性研究结果显示,恶性肿瘤患者分期越晚、细胞分化越差,病理恶性程度越高,NLR则越高[10]。而本研究结果显示,高NLR组和低NLR组性别、年龄及ECOG评分为0分、有吸烟史、原发灶行手术治疗、N分期为N1期、有恶性胸腔积液、转移器官数量>1个、有接受1、2代EGFR-TKIs治疗史患者比例比较,差异均无统计学意义,表明高NLR组和低NLR组患者的临床特征并无明显差别。可能原因为NLR与患者临床病理特征无关,也可能与样本量较小相关。
本研究中,低NLR组患者的ORR和DCR均高于高NLR组,可能由于NLR升高的肺腺癌骨转移患者存在众多炎症因子如IL-8、IL-17等过表达,使肿瘤的侵袭转移等恶性生物学行为加强[11],故高NLR组靶向药物治疗效果不如低NLR组理想。另外,本研究中无论是高NLR组还是低NLR组的ORR均远低于Mok等[12]进行的一项随机、国际化、非盲、Ⅲ期临床试验结果中口服奥希替尼治疗的晚期非小细胞肺癌患者的ORR(71%,95%CI65%~76%),可能与本研究入组的均为肺腺癌骨转移且接受过各线治疗的晚期患者疗效较差或样本量偏小有关。
本研究中Kaplan-Meier曲线分析结果显示,高NLR组和低NLR组患者中位生存期均较长,佐证了一项国际多中心、开放、Ⅲ期随机对照的临床试验AURA3研究结果,奥希替尼在延长T790M耐药基因突变的肺腺癌患者生存期方面具有显著优势[13]。2015年已有研究表明,在接受立体定向放疗的非小细胞肺癌患者中,低NLR组患者的预后优于高NLR组患者[14]。对于非小细胞肺癌患者,NLR与预后关系的相关研究现主要集中在手术和放疗中,对于靶向药物治疗方面的报道较少。本研究中,低NLR组的总生存率高于高NLR组,低NLR组、高NLR组患者中位生存期分别为29.0个月、13.0个月,而国外Scilla等[9]的研究结果提示,对于接受了包括手术和放化疗等综合治疗后的非小细胞肺癌患者,低NLR组、高NLR组患者的中位生存期分别为25.0个月、21.0个月。本研究中高NLR组患者中位生存期明显低于国外研究中接受手术等综合治疗后的高NLR组患者,提示可能与Scilla等[9]研究纳入的患者均为有手术机会的Ⅲ期肺癌患者预后较好相关。目前国内外尚缺乏靶向药物治疗不同NLR的非小细胞肺癌患者的相关资料,需要进一步进行多地区大样本的相关研究来佐证。
奥希替尼的主要不良反应为胃肠道反应、皮肤毒性、过敏、疲乏、骨髓抑制[15]。本研究中两组患者总体不良反应较轻,且高NLR组和低NLR组患者不良反应的总发生率比较差异无统计学意义,全部患者均可耐受不良反应,提示靶向药物治疗肺腺癌骨转移患者的不良反应可能与NLR无关。
综上所述,奥希替尼治疗T790M耐药基因突变的晚期肺腺癌骨转移效果好,不良反应轻微,较为安全。奥希替尼治疗低NLR的T790M耐药基因突变的晚期肺腺癌骨转移患者的疗效优于高NLR患者。对高NLR的非小细胞肺癌患者治疗前,进行有效的降低NLR干预可能有望提高疗效[16]。
