50种中药煎煮类饮片微生物检查方法研究及污染情况分析*
2021-02-24石春红胡亚英任丽君顾芙蓉
张 平,石春红,胡亚英,任丽君,顾芙蓉
(1.上海市松江食品药品检验所,上海 201600;2.上海余天成中药饮片有限公司,上海 201600;3.上海市松江区市场监督管理局,上海 201600)
中药饮片是指药材经炮制后可直接用于临床或制剂生产使用的处方药品[1],大多来源于天然植物、动物或矿物,自身带有大量微生物[2],其质量备受关注。2015年版《中国药典(一部)》增订农药残留、重金属、黄曲霉等危害性大的理化项目[3],除了直接入口的中药提取物、中药研粉口服用贵细饮片、直接口服及泡服饮片规定了微生物检查项目外,作为临床应用最广的煎煮类饮片却未规定微生物限度标准,也无针对性的检查方法[4]。因中药饮片来源的多样性,以及加工、运输和贮存的随意性,使中药饮片极易受到微生物污染,并影响饮片和其下游中成药产品的质量和安全性[5-8]。《美国药典(42版)》(USP 42)[9]、《欧洲药典(10.0 版)》(EP10.0)[10]和《日本药典(17 版)》(JP17)[11]均明确收载了使用前经沸水处理的中草药(天然药物)的微生物限度检查法和限度标准。2018年2月,国家药典委员会网站发布了《关于对<中国药典>2020年版微生物通则草案(一)公开征求意见的通知》[12](以下简称《草案》),并对中药饮片增加微生物检验进行说明[13]。但《<中国药典>2020年版四部通则(草案)》[14]只收载了中药饮片微生物限度检查法。2019年8月,国家药典委员会发布第二次征求意见的通知,对煎煮类中药饮片暂不进行微生物限度控制,但应关注风险大的煎煮类中药饮片。本研究中通过分析50种中药煎煮类饮片的微生物检查方法,建立了需氧菌总数、霉菌和酵母菌总数、耐热菌数、耐胆盐革兰阴性菌[衡释培养测试(MPN)法]、大肠埃希菌和沙门菌的检验方法,并分析微生物污染情况,初步掌握了微生物污染的负载水平,以期为中药饮片微生物污染水平积累数据和限度标准的制订提供技术支持,为中药饮片生产企业的规范管理和炮制过程中微生物的控制提供依据。现报道如下。
1 仪器与材料
1.1 仪器
SW-CJ-2FD型超净工作台(苏州净化设备有限公司);KS12型生物安全柜(美国Thermo Fisher公司);BA410E 型显微镜(香港 Motic公司);BD400(E2)型微生物培养箱(德国Binder公司);MLS-3781L-PC型高压蒸汽灭菌锅(日本Panasonic公司)。
1.2 试药
中药饮片均购自上海某中药饮片有限公司,来源于不同产地,类别涉及植物药、动物药和矿物药,药用部位涉及根类、茎类、全草类等,共收集50个品种,每个品种3批,共计150批次,详见表1。每批次样品量不少于200g,一半用于辐射灭菌后方法适用性试验,一半用于微生物样品检测。pH7.0无菌氯化钠-蛋白胨缓冲液、胰酪大豆胨琼脂培养基、胰酪大豆胨液体培养基(TSB)、沙氏葡萄糖琼脂培养基(含氯霉素)、RV沙门菌增菌液体培养基、木糖赖氨酸脱氧胆酸盐琼脂培养基、麦康凯液体培养基、麦康凯琼脂培养基、肠道菌增菌液体培养基、紫红胆盐葡萄糖琼脂培养基,均为干粉培养基,购自北京三药科技开发公司,按2015年版《中国药典(四部)》通则[4]要求配制、灭菌,并经培养基适用性验证合格。
1.3 菌种
金黄色葡萄球菌[CMCC(B)26003]、铜绿假单胞菌[CMCC(B)10104]、枯草芽孢杆菌[CMCC(B)63501]、白色 念 珠 菌 [CMCC(F)98001]、黑 曲 霉 菌 [CMCC(F)98003]、大肠埃希菌[CMCC(B)44102]、乙型副伤寒沙门菌[CMCC(B)50094],均为定量质控菌,购自浙江泰林生物技术股份有限公司,经菌种确认验收合格。

表1 50种煎煮类中药饮片信息Tab.1 Information of 50 varieties of Chinese medicine decoction pieces
2 方法与结果
2.1 计数方法适用性试验
计数方法:根据《草案》的方法,取供试品25 g,置适量胰酪大豆胨液体培养基中,制成1∶10(g/mL)备用液,充分振摇荡洗(不少于15 min),取其液体作为供试液;用同一稀释液将供试液10倍系列稀释。检查需氧菌总数计数(TAMC),将供试液连续4次10倍梯度稀释;检查霉菌和酵母菌总数计数(TYMC),将供试液连续3次10倍梯度稀释;检查耐热菌数,取供试液10 mL,100℃水浴30 min后迅速冷却,连续2次10倍梯度稀释,按TAMC检查方法测定。
适用性试验:按2015年版《中国药典(四部)》通则1105微生物计数法适用性试验方法进行验证。取5种试验菌(铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉菌),以平皿倾注法、增加稀释液或培养基体积法、薄膜过滤法依次检测。按公式[回收率比值=(试验组菌落数-供试品对照组菌落数)/菌液对照组菌落数]计算回收率。结果试验组和相应菌液对照组的菌落数比值均应在0.5~2.0范围内,可用于需氧菌、霉菌和酵母菌的总数计数。
试验结果:根据回收率试验结果,调整检验方法。其中,黄连具有抑菌性,采用1∶10的供试品溶液、薄膜过滤法(冲洗量100 mL/膜)测定TAMC,采用1∶100的供试品溶液、平皿倾注法测定TYMC;磁石具有抑菌性,采用1∶100的供试品溶液、平皿倾注法测定TAMC和TYMC;丹参和山楂可抑制需氧菌,采用1∶100的供试品溶液、平皿倾注法测定 TAMC,采用1∶10的供试品溶液、平皿倾注法测定TYMC;其余46个品种均采用1∶10的供试品溶液、平皿倾注法测定TAMC和TYMC。150批次中药饮片的方法适用性试验回收率比值均应在0.5~2.0范围内。耐热菌数测定参考TAMC计数方法。
2.2 控制菌检查方法适用性试验
检查方法:耐胆盐革兰阴性菌、大肠埃希菌、沙门菌检查方法采用2015年版《中国药典(四部)》通则1106非无菌产品微生物限度检查法。
适用性试验:确认耐胆盐革兰阴性菌检查方法时,以大肠埃希菌和铜绿假单胞菌为试验菌;确认沙门菌和大肠埃希菌检查方法时,分别以沙门菌和大肠埃希菌为试验菌,以常规法、增加培养基体积法和薄膜过滤法依次检测。在规定的温度和最短时间下培养,应能检出所加试验菌相应的反应特征。
试验结果:耐胆盐革兰阴性菌检查,黄连采用1∶10的供试品溶液,取相当于0.1,0.01,0.001 g的供试品预培养物接种至20 mL肠道增菌液中,其余品种均使用10 mL肠道增菌液;沙门菌检查,马齿苋、牡丹皮采用200 mL TSB作为增菌液,山楂采用500 mL TSB作为增菌液,其余品种均使用100mLTSB作为增菌液;大肠埃希菌检查,均采用100mLTSB作为增菌液。按以上方法控制菌的试验组均应能检出所加试验菌相应的反应特征。
2.3 微生物限度检查结果
2.3.1 菌落计数结果
中药饮片是非无菌产品,在炮制加工过程中微生物控制措施不严格,菌落计数检出的概率很高。本试验中的150批次中药材饮片中,TAMC检出率为98.67%,计数范围为10~107cfu/g;TYMC检出率为86.67%,计数范围为 10~105cfu/g;耐热菌计数检出率为50.67%,计数范围为10~104cfu/g。菌落总数计数分布图见图1。不同炮制方法对微生物的污染情况也不同,切制的检出菌落最高,煮制和炒制最少;从药材类别来看,矿物药的微生物污染情况最少,植物药和动物药次之。菌落总数分布图见图2。
2.3.2 控制菌检查结果

A.需氧菌[N 为 lg(cfu/g)]B.霉菌、酵母菌[N 为 lg(cfu/g)]C.耐热菌[N 为 lg(cfu/g)]D.耐胆盐革兰阴性菌[N为lg(MPN/g)]图1 菌落总数计数分布图A.Aerobic bacteria[N is lg(cfu/g)]B.Mold and yeast[N is lg(cfu/g)]C.Heat-resistant bacteria[N is lg(cfu/g)]D.Bile-tolerant Gram-negative bacteria[N is lg(MPN/g)]Fig.1 Distribution of total bacterial count
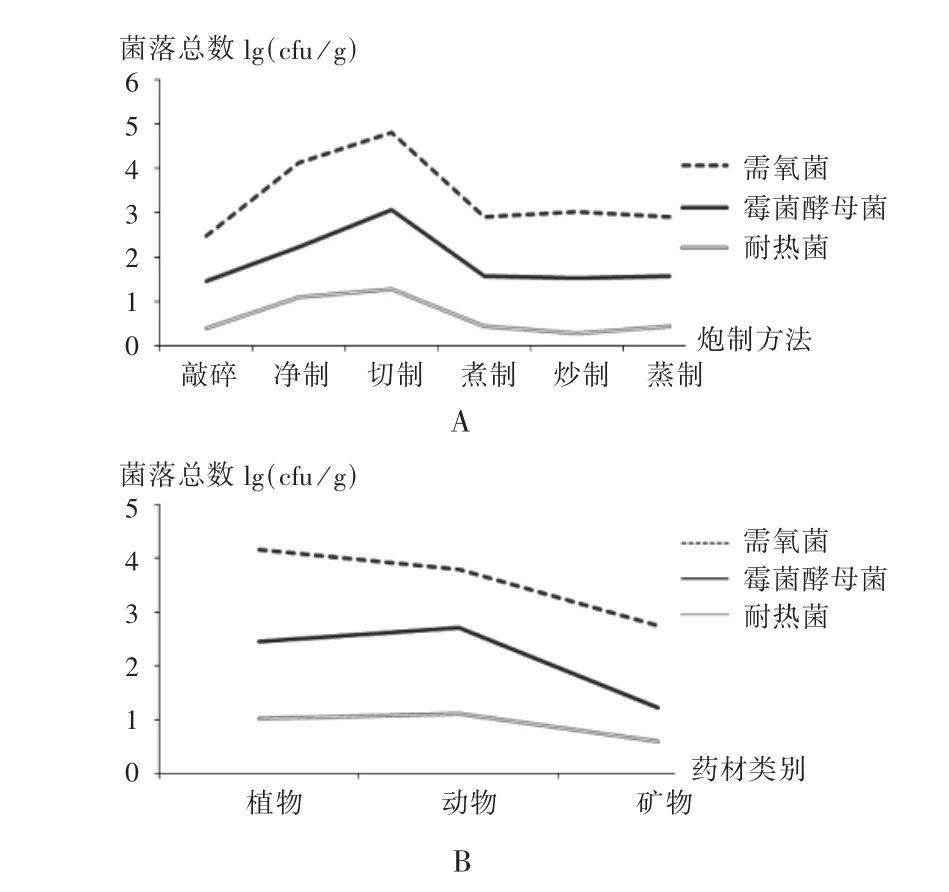
A.按炮制方法分类 B.按药材类别分类图2 不同炮制方法和药材类别菌落总数分布图A.Classification by processing method B.Classification by varieties of Chinese medicine decoction piecesFig.2 Distribution of total bacterial count of Chinese medicine decoction pieces with different processing methods and varieties
检测耐胆盐革兰阴性菌采用衡释培养测试(MPN),样本检出率为50.67%,大于104MPN/g的样本率为19.33%,菌落总数计数分布图见图1 D。与文献[15-16]报道耐胆盐革兰阴性菌的检出率基本一致,其中全草植物类污染最严重,矿物类最不利于耐胆盐革兰阴性菌污染。未检出沙门菌和大肠埃希菌。
2.4 微生物限度标准判定
将150批次中药饮片微生物的检验结果分别与USP42,EP10.0,JP17中与煎煮类中药饮片使用方法相同的微生物限度标准(详见表2)进行比较。按USP42标准评价本试验中药煎煮类饮片样品的不合格率为6.0%,按EP10.0和JP17标准评价均为合格。其中,USP42中耐胆盐革兰阴性菌限量的检测方法与《中国药典》不同,故未按USP42作评价。
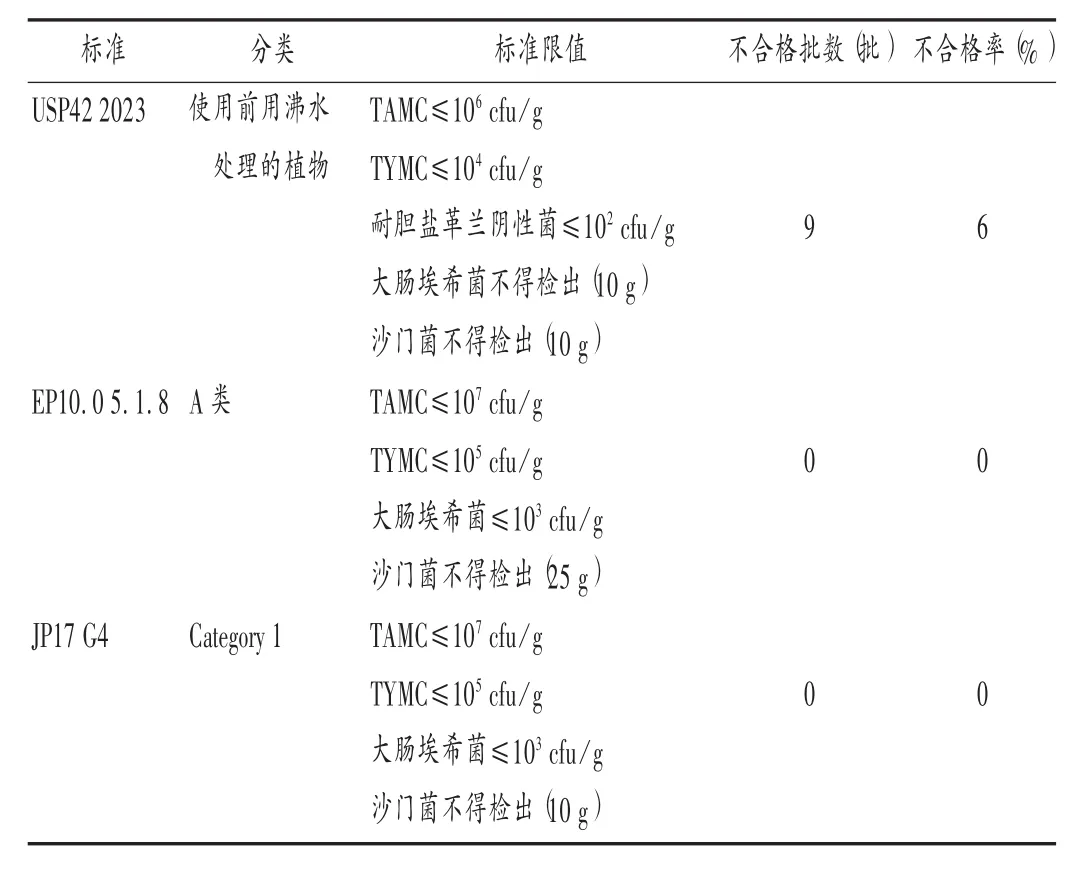
表2 美国、欧洲和日本药典中草药(天然药物)相关微生物限度标准比较Tab.2 Comparison of the related microbial limit standards of Chinese herbal medicine(natural medicine)in USP,EP and JP
3 讨论
3.1 辐射灭菌法选择
因中药饮片本身微生物负载高,如果样本不去除本底菌则无法进行方法适用性试验。比较本实验室的紫外灯杀菌与上海辐照中心提供的辐射灭菌法,后者灭菌效果更佳[17-19],能完全杀灭样本负载的表面微生物,且对有效成分无明显影响[1]。在辐射过程中,γ射线穿透力强,作用于微生物,直接或间接破坏微生物的核糖核酸、蛋白质和酶,从而杀死微生物,起到消毒灭菌作用。与上海辐照中心联合试验,以黄芪和白术(需氧菌负载106cfu/g,霉菌和酵母菌负载 104cfu/g)为试样,用60Co-γ射线辐射,吸收剂量为10~30 kGy。在15 kGy吸收剂量时能杀灭黄芪和白术负载的所有表面微生物(<10 cfu/g),为了确保所有样本能达到无菌状态,选择25 kGy吸收剂量,与2015年版《中国药典(四部)》通则1421灭菌法中辐射灭菌法一致。因此,确定辐射方案为60Co-γ射线,吸收剂量为25 kGy。
3.2 微生物对炮制方法和药材类别的选择特异性
根据《上海市中药饮片炮制规范2018年版》附录炮制通则[20],有39种中药饮片炮制方法。中药炮制是遵循中医药理论,根据药材性质,按药材炮制操作工序,制成一定规格的饮片。不同的炮制方法对微生物的负载情况也不同,经过热加工处理的炮制方法如煮制、炒制、蒸制能有效降低中药饮片的细菌类污染,但药材炮制过程和辅料的引入会使饮片微生物负载更复杂[1]。根据统计学 t检验分析,非热加工方式切制净制饮片的微生物负载最高,热加工方式的煮制、炒制、蒸制饮片次之,热加工与非热加工的炮制方式对TAMC与TYMC有显著差异(P <0.05),对耐热菌无显著差异(P >0.05)。从药材类别来看,植物药和动物药的微生物负载最多,矿物药次之,植物药和动物药的微生物负载分布情况无显著差异(P>0.05),动物药和矿物药的微生物负载分布情况有显著差异(P<0.05)。矿物药的微生物负载比植物药和动物药低,这和微生物在生长过程中受药材成分的影响有关,不同种类的微生物对药材种类有选择特异性[15]。
3.3 耐热菌检查项目选定是中药质量安全的关键风险控制指标
针对煎煮类中药饮片的使用特点,建立耐热菌计数检查项目,拟用于评估煎煮类饮片在加热处理后残留微生物的情况。耐热菌测定时加热温度和沸水浴时间对检测数据影响大,若加热温度不到100℃,耐热菌的检出率会呈数量级增加。因此,必须保持检测条件一致,用温度计随时监测沸水浴温度在100℃,并用秒表控制30 min。根据检测结果,即使经过100℃沸水浴30 min,耐热菌计数最高可达104cfu/g。
3.4 50种中药饮片微生物污染情况分析
本试验中通过购买50种中药煎煮类饮片考察流通领域样品的微生物污染情况,与某生产企业提供的150批次样品的微生物负载分布情况基本一致(P>0.05),说明中药饮片在流通环节能保证微生物污染情况与出厂时一致。150批次样品检出需氧菌总数计数结果介于10~107cfu/g;霉菌、酵母菌总数计数结果介于10~105cfu/g;耐热菌数检出率为49.5%,计数结果介于10~104cfu/g;耐胆盐革兰阴性菌检出率为48.5%;均未检出大肠埃希菌和沙门菌。以USP42的规定进行评价,不合格率为6.0%;以EP10.0,JP17的规定进行评价,全部合格。美国对使用前用沸水处理的植物产品工艺的要求不同,故USP42制订的标准限度比EP10.0和JP17低了一个数量级,不作为主要评价依据。虽然本试验研究结果显示微生物负载水平较高,但检测数据结果基本满足国外药典规定限度要求。从生产质量管理体系上看,我国中药饮片生产企业的整体质量管理水平较低,过程控制和风险控制体系目前无法达到国际水平,这也是我国药典无法推进中药饮片微生物限度标准规定的实际原因[2]。
3.5 努力方向
我国中药饮片品种繁多,《上海市中药饮片炮制规范2018年版》收载973种,2015年版《中国药典(一部)》收载中药材662种,且微生物污染菌情况复杂。本研究中以中药饮片的表面微生物为检查重点,但部分具有抑菌性的品种需采用消除抑菌性的方法才能完成方法适用性验证。我国中药饮片生产企业大部分缺乏微生物检验能力,如果方法验证工作投放到国家专业技术机构,会因样本工作量大而影响标准的推行。因此,建议国家专业技术机构联合中药饮片生产企业进一步开展中药饮片,特别是煎煮类中药饮片微生物污染数据的积累和微生物危害的风险评估工作,根据中药饮片的品种特点制订相应的个性化标准,这是中药标准引领国际发展的关键[21]。中药饮片微生物相关标准的制订势在必行,须进一步强化中药饮片生产企业的过程管理控制和微生物检验能力的储备,保障中药饮片的使用安全。
