局部晚期宫颈癌患者同步放化疗后机体成分变化CT定量分析与预后的关系
2021-02-18张秀芹徐凯
张秀芹 徐凯
宫颈癌是妇科常见肿瘤,其发病率居妇科恶性肿瘤的第二位,超过50%的宫颈癌就诊时已是局部晚期[1]。同步放化疗(concurrent chemoradiotherapy,CCRT)是提高局部晚期宫颈癌患者生存率的有效治疗方法,但其治疗效果及预后受多种因素影响,以往关于宫颈癌预后方面的研究主要集中在肿瘤特异性因素和治疗方式。
近年来,人们对机体成分与肿瘤患者预后的关系越来越感兴趣。大多数恶性肿瘤,在其发展和治疗过程中都会发生机体成分的变化。例如,乳腺癌和前列腺癌患者在治疗后出现脂肪增加和骨骼肌减少[2],而肺癌和消化道癌患者在治疗后出现肌肉和脂肪组织同时减少的恶病质表现[3],这些变化与肿瘤不良预后独立有关。
随着体成分定量CT技术的发展和应用[4],腹部CT单层容积分析技术被认为是测量肌肉和脂肪的“金标准”,且以L3水平与机体相关性最好[5]。鉴于宫颈癌同步放化疗后机体参数的变化和预后研究较少,且通过CT定量分析机体脂肪变化探讨对宫颈癌预后的影响尚未见报道,本研究拟通过CT测量局部晚期同步放化疗患者治疗后机体成分变化,评估其与预后的关系。
方 法
1.研究对象
收集徐州医科大学附属医院2012年2月—2017年2月所有因宫颈癌(ⅡB~ⅣA期)住院患者共318例。研究对象纳入标准:①符合国际妇产科联盟(FIGO)宫颈癌相关诊断标准,并经病理学确诊;②均首次接受治疗;③有完整的放化疗前后CT图像可供分析;④没有经历手术治疗;⑤患者或家属知情同意。排除标准:①合并其他恶性肿瘤;②合并心、肝、肾脏功能异常等放化疗禁忌证;③病例和生存资料不完整;④接受过激素等影响机体成分的药物治疗。
最终127例患者纳入研究(图1)。通过病历收集纳入患者基础信息,包括年龄、更年期状态、身高、体重、肿瘤大小、组织学分型和分化程度等,以及放化疗类型、周期和时间,并记录患者无进展生存期和总生存时间(表1)。

图1 患者纳入流程图

表1 127例患者基本信息和肿瘤特征
2.治疗方法
所有患者均接受了联合体外照射治疗(总剂量48~60 Gy,分22~25组,部分患者后5次采用缩野推量,范围包括病灶和盆腔淋巴结引流区)和高剂量率腔内近距离放射治疗(A点剂量达32~45 Gy,B点剂量维持在10 Gy,分4~6次),所有放疗7~8周内完成。放疗同时配合TP方案(紫杉醇135~175 mg/m2,第1天和第8天静脉滴注,顺铂75 mg/m2,第1~3天静脉滴注)或FP方案(奈达铂50 mg/m2,第1~2天静脉滴注,替加氟1 000 g/m2,第1~5天静脉滴注,或顺铂40 mg/m2,第1~3天静脉滴注,替加氟1 000 g/m2,第1~4天静脉滴注)化疗,28 d天为1个周期,至少2个周期。血红蛋白低于80 g/L给予红细胞混悬液补血,患者出现Ⅱ级及以上不良反应给予暂停放化疗,同时给予对症处理,待患者恢复后继续治疗,如果2周内不能恢复或Ⅲ级以上放化疗反应出现2次以上则给予停止治疗(不能按计划完成放化疗周期患者排除在外)。
3.CT图像分析
由影像存储与传输系统(picture archive and communication system,PACS)调取患者治疗前后1周内的腹部CT增强图像进行评价。扫描参数:管电压120 kV,管电流380 mA,层厚5 mm,层间距5 mm,2次扫描间隔8~16周。使用GE公司AW图像工作站图像分析软件,通过手动勾画感兴趣区(ROI),利用不同组织放射衰减系数(CT图像的Hounsfield单位HU)设置(内脏脂肪-50~-150 HU,皮 下 脂 肪-30~-190 HU,肌 肉 组 织-29~150 HU)[6],半自动采集同一层面内脏脂肪体积、皮下脂肪体积和肌肉体积(包括腰大肌、椎旁肌,腹直肌、腹横肌和内外斜肌),除以层厚换算成面积值,即内脏脂肪面积(visceral fat area,VFA)、皮下脂肪面积(subcutaneous fat area,SFA)和肌肉面积(skeletal muscle area,SMA),计算总脂肪面积(total fat area,TAF)=VFA+SFA,并计算出内脏脂肪与皮下脂肪面积比VFA/SFA。所有测量由2名放射科医生对临床资料在双盲情况下进行,取两者测量的平均数,计算化疗前后机体成分变化,治疗前后差值(ΔCT)=治疗后(CT2)-治疗前(CT1),增加记录为正(+),减少记录为负(-)。
4.统计学分析
采用SPSS统计软件进行数据分析。计数资料以例数和百分比表示。治疗前后差值比较采用t检验。采用单因素生存分析(Kaplan-Meier法和Log-rank检验)评估各因素对无进展生存期、总生存率的影响,有显著性差异的因素再纳入多因素Cox回归风险模型进行分析,以确定哪些因素对患者预后有影响。P<0.05表示差异有统计学意义。
结 果
1.同步放化疗前后机体成分的变化
共127例患者纳入研究,同步放化疗后VFA、TFA和VFA/SFA均值分别增加13.05 cm2(P<0.001)、11.87 cm2(P=0.035)和0.08 cm2(P<0.001),其中37例VFA减少,49例TFA减少和36例出现VFA/SFA减少。治疗后SFA、SMA和BMI均值分别减少1.53 cm2(P=0.895)、7.24 cm2(P<0.001)和0.38 kg/m2(P<0.001)。对SMA按照减少比例分组,其中45例减少比例<5%,49例减少5%~10%,33例减少≥10%;对BMI变化以减少均数分组,其中42例BMI丢 失≥0.38 kg/m2,85例BMI丢 失<0.38 kg/m2或 维持(表2)。
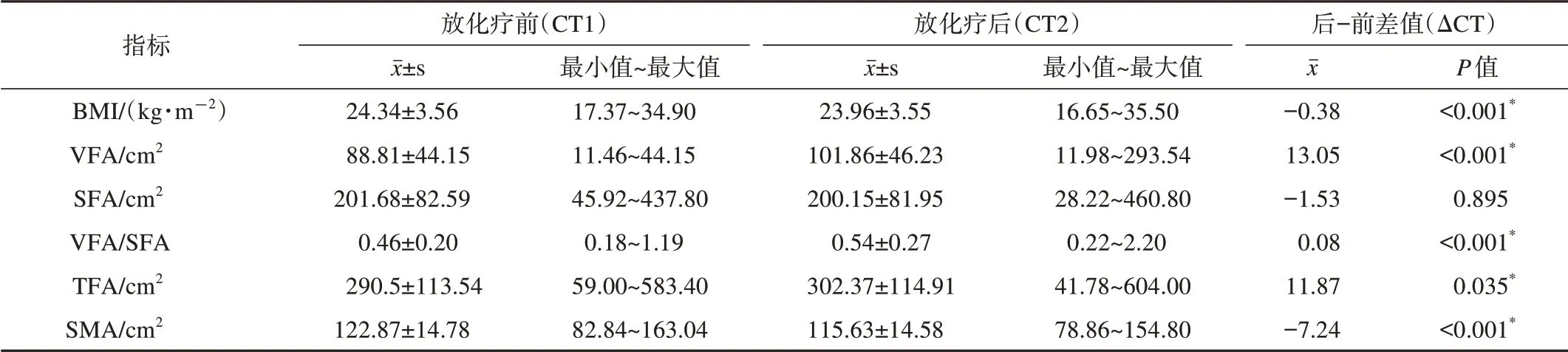
表2 局部晚期宫颈癌同步放化疗前后身体成分的变化
2.机体参数变化与疾病预后的关系
单因素分析显示,肿瘤最大径≥5 cm、中低分化、治疗后VFA降低、VFA/SFA降低、TFA减降低、SMA减少≥10%和BMI减少≥0.38 kg/m2与无进展生存期短显著相关(P=0.001、P=0.007、P<0.001、P<0.001、P=0.034、P<0.001和P=0.025);与较低总生存率显著相关的因素是分期≥ⅢA、肿瘤最大径≥5 cm、腺癌、治疗后VFA降低、VFA/SFA降低和SMA减少≥10%(P=0.009、P<0.001、P=0.012、P<0.001、P<0.001和P<0.001)。其中SMA减少≥10%与肿瘤无进展生存期(HR=3.334,95%CI 1.150~9.666,P=0.027)和总生存率(HR=3.334,95%CI 1.241~6.082,P=0.017)独立相关,VFA/SFA降低与肿瘤无进展生存期(HR=3.142,95%CI 1.725~5.723,P<0.001)和总生存率(HR=2.725,95%CI 1.276~5.822,P=0.010)独立相关(表3),Kaplan-Meier曲线(图2)也显示同样的结果,SFA变化与无进展生存期和总生存率均无显著关联。

表3 各指标对局部晚期宫颈癌无进展生存期(PFS)和总生存率(OS)影响的单因素和多因素COX分析
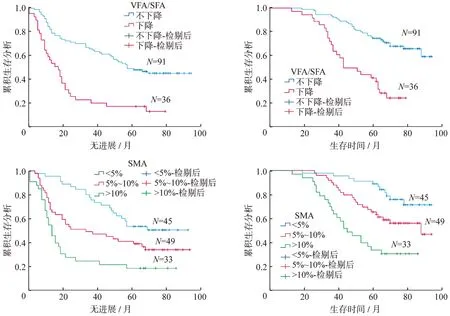
图2 Kaplan-Meier法分析同步放化疗前后机体参数变化对无进展生存期(PFS)和总生存率(OS)的影响
讨 论
国际妇产科联盟(FIGO)对局部晚期宫颈癌(locally advanced cervical cancer,LACC)的定义是指分期为ⅡB~ⅣA期宫颈癌,ⅡB期以前患者以手术治疗为主,同步放化疗是ⅡB~ⅣA期宫颈癌首选治疗方法,本组病例纳入的是ⅡB~ⅣA期同步放化疗患者。
在临床工作中,时常发现相同的治疗方案对同一分期的宫颈癌,预后相差很大,这提示目前的分期系统也还不能完全解释宫颈癌的预后。随着影像技术的发展,机体成分分析对肿瘤预后的研究日益受到重视。肌肉和脂肪含量可反映患者的营养和机能状况,严重的营养不良常与肿瘤晚期患者的化疗不耐受和生存率低有关,甚至导致癌症恶病质。放化疗在治疗肿瘤的同时,放射损伤、药物毒性、代谢异常等[7]都会加重机体营养丢失和促进肿瘤恶病质进程。鉴于放化疗期间机体参数变化与宫颈癌预后关系还缺乏数据支持,已有文献主要关注肌少症对宫颈癌预后的影响,本研究综合评估同步放化疗后肌肉和脂肪变化与宫颈癌预后的相关性。研究结果显示:同步放化疗患者VFA、SFA、VFA/SFA、TFA和BMI均值在治疗结束后均有不同程度的变化,且VFA/SFA下降和SMA减少≥10%与肿瘤预后独立相关,VFA、SFA、TFA、BMI在多因素COX分析中对无进展生存期和总生存率均未见显著意义。
肌肉减少作为恶病质的核心,在肿瘤发展和治疗过程中非常常见,且与肿瘤不良预后有关。导致治疗过程中肌肉减少主要原因是代谢异常和药物毒性,研究[8]表明化疗药物可以通过诱导NF-κB激活和上调肌肉生成抑制剂导致肌萎缩。本研究发现治疗后SMA减少比例越多,无进展生存期和总生存率越差,而多因素分析显示SMA减少≥10%与肿瘤无进展生存期短独立相关。本研究结果得到了其他相关文献的支持,如Kiyotoki等[9]曾纳入60例小样本研究了晚期宫颈癌患者同步放化疗过程中腰大肌减少对预后影响,提出腰大肌减少≥15%与肿瘤早期复发和总生存率低独立相关,而Lee等[10]发现局部晚期宫颈癌同步放化疗后肌少症比例明显增多且预后不良,导致研究结果略有差异的原因可能是对肌肉减少采用参考标准不同,因此寻找一个合适的分界标准,可能更有利于肌评估肉减少程度与宫颈癌预后关系。
机体脂肪按照分布主要分为内脏脂肪和皮下脂肪,不同部位脂肪具有不同的功能,内脏脂肪因具有更多的生物活性,被以为是免疫器官的一部分。脂肪丢失作为营养不良的一部分,同样与多种肿瘤的不良预后相关[3,11]。本研究发现治疗后VFA/SFA降低与肿瘤无进展生存期短和总生存率低独立相关。而VFA/SFA值反映的是内脏脂肪和皮下脂肪分布比例,常用来评估肥胖的类型。国内外多篇文献报道,肥胖,尤其是高VFA/SFA的内脏肥胖不仅与各种代谢性疾病有关,而且会增加多种肿瘤的发病率,包括宫颈癌[12]。本研究显示,治疗后VFA/SFA增加,对宫颈癌来说却是一种保护因素,而VFA/SFA下降患者预后不良。在33例VFA/SFA下降患者中24例伴有VFA减少(占VFA减少患者65%),鉴于SFA在治疗过程中均值减少且与预后无明显关联,我们推测VFA/SFA降低主要由VFA减少比例更多导致。至于为何VFA减少更多患者预后差,West-Eberhard[13]提出的内脏脂肪优先假说可以对此作出解释:即内脏脂肪作为免疫器官的一部分,在病理状态下保持一定数量内脏脂肪细胞可以通过提供必要时的不饱和脂肪酸来支持免疫活动,提高治疗效果,当内脏脂肪出现较多消耗,常标志着严重营养不良和更容易发展成恶病质,抗癌治疗反应差。此外,皮下脂肪可以吸收一些内脏脂肪产生的炎性产物,VFA/SFA被以为是内脏和皮下脂肪相互作用的指标。因此我们推测,虽然VFA减少在VFA/SFA下降中起主要作用,VFA/SFA下降可能代表严重营养不良或恶病质前期,有可能是肿瘤预后不良更有用的评估指标。关于VFA减少对恶性肿瘤预后不良已见于多篇报道,包括鼻咽癌、消化道癌和胰腺癌等[10,14],但治疗过程中VFA/SFA变化对肿瘤预后的报道极少,VFA/SFA减少机制尚不能确定,需要更多的研究来验证。
综上所述,同步放化疗过程中VFA/SFA下降,SMA丢失对局部晚期宫颈癌预后具有重要参考价值,其中同步放化疗后SMA减少≥10%、VFA/SFA比值降低是无进展生存期短和总生存率低的独立预后因素。CT具有较高的密度和空间分辨率及可靠的重复性,已经成为肌肉及脂肪组织定量定性测量的常用方法,可以给临床医师分析患者的预后、优化癌症治疗方案提供参考依据。
