自噬/苄氯素1调节因子1在自噬与凋亡中作用的研究进展*
2021-02-05尚画雨马穰桂
尚画雨, 付 玉, 马穰桂, 夏 志
(1成都体育学院运动医学与健康学院,四川成都610041;2井冈山大学体育学院,江西吉安343009)
细胞凋亡(Ⅰ型程序性死亡)和自噬性细胞死亡(Ⅱ型程序性死亡)这2 种细胞死亡方式可通过一些蛋白的相互作用而介导形成平衡对立状态。一方面,细胞凋亡由胱天蛋白酶(caspase,CASP)依赖性通路经内源性、外源性或内质网应激诱导途径予以控制,而死亡信号则可经这3 种途径介导受损或感染细胞的清除[1-2]。另一方面,细胞自噬由被称为货物受体或自噬受体的特定分子调控,并通过此类受体与特定底物相互作用,介导自噬体形成。现已证实,在响应低氧、饥饿等多种应激刺激时,细胞将启动自噬机制降解受损细胞器(如线粒体),从而防止触发凋亡途径,避免细胞凋亡或坏死[3]。
自噬/苄氯素 1 调节因子 1(autophagy/beclin-1 regulator 1,AMBRA1)是同时参与介导自噬和凋亡的受体蛋白之一。首先,AMBRA1 作为自噬早期阶段的调节子和自噬体膜标志物[如微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)]的关键募集蛋白而介导自噬发生,同时在自噬过程与凋亡、增殖、分化、发育及病理改变等诸多细胞活动之间建立联系[4-7]。此外,抗凋亡B 细胞淋巴瘤/白血病 2(B-cell lymphoma/leukemia 2,Bcl-2)家族成员如 Bcl-xL/BCL2L1(Bcl-2-like 1)[8]、Bcl-2[9]和髓样细胞白血病1(myeloid cell leukemia-1,Mcl-1)[10]可有效抑制自噬的生理性活化,且三者均为与AMBRA1 相互作用的分子。基于此,本文拟对近年来AMBRA1 蛋白的相关研究进行梳理,并归纳其对自噬及凋亡的调控作用,以期为AMBRA1 相关疾病(如癌症和神经退行性疾病等)的新药研发提供参考资料。
1 AMBRA1概述
AMBRA1 由 1 300 个氨基酸组成,在脑、肺、肾脏和心脏等组织广泛高表达[11]。ambra1基因由 18 个外显子组成,位于人类11 号染色体和小鼠2 号染色体上,而斑马鱼的ambra1基因则包含19 个外显子,并编码两个同源基因ambra1a和ambra1b[7]。哺乳动物和斑马鱼ambra1外显子数目和长度的差异与低序列同源性的C 末端区域相对应;相反,其N 末端区域高度保守,包含3 个WD40 结构域,在蛋白相互作用中行使支架功能。除上述已知结构域之外,AMBRA1 还被定义为一种本质上无序的蛋白,这种可塑性决定了其具有多重互作功能[12]。目前已知AMBRA1 具有多个一致序列,从而可与cullin 4(CUL4)/损 伤 特 异 性 DNA 结 合 蛋 白 1(damagespecific DNA-binding protein 1,DDB1)、CUL5[13]、蛋白 磷 酸 酶 2A(protein phosphatase 2A,PP2A)[5]、LC3B[14]、肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)[15]、动力蛋白轻链LC8 type 1(dynein light chain LC8 type 1,DYNLL1)、DYNLL2[16]和 Bcl-2[6]等多种蛋白之间产生相互作用。
AMBRA1 复杂而未知的结构使其得以参与多个关键的生理和病理过程。例如,AMBRA1 可参与调节自噬(包括选择性自噬),并介导线粒体选择性自噬过程[14,17]。再如,它可参与包括诱导肌细胞生成在内的多种调节机制[7],负性调节人类免疫缺陷病毒 1 型(human immunodeficiency virus-1,HIV-1)感染,但在未知机制下又被病毒拮抗[18]。又如,它可与PP2A 相互作用,一方面在上游哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)被抑制的情况下,通过诱导c-Myc去磷酸化和降解以抑制癌细胞增殖[5];另一方面则增加叉头框蛋白O3(forkhead box O3,FOXO3)的稳定性,从而促进FOXP3基因表达和调节T 细胞的正常发育[19]。此外,它亦可与Bcl-2 家族成员Bcl-2 及Mcl-1 相结合,从而调节细胞凋亡[6]。
2 AMBRA1参与调节自噬
细胞自噬是一种由囊泡自噬体介导的细胞自我消化方式,除随机降解一些蛋白底物之外,还可选择性降解特定的细胞成分(如细胞器)。其中,选择性自噬包括线粒体自噬、内质网自噬和核糖体自噬等途径,主要用于保护细胞结构,通常行使着大扫除的功能[20]。
2.1 细胞自噬 在基础条件下,胞质内AMBRA1可与自噬关键分子beclin-1[4]和Ⅲ型磷脂酰肌醇3-激酶(class Ⅲ phosphatidylinositol 3-kinase,PI3KⅢ/VPS34)相互作用,在由DYNLL1与DYNLL2组成的马达复合物轻链上形成PI3KⅢ复合物。随后,在Unc-51 样自噬活化激酶1(Unc-51-like autophagy-activating kinase 1,ULK1)依赖性AMBRA1 磷酸化作用下[21],该复合物转运至内质网并被激活,最终诱导自噬体的形成[22]。因此,AMBRA1 被视为自噬的正性调节因子[23]。研究表明,AMBRA1 通过以下 2 种机制介导自噬途径的正反馈回路:一方面,通过E3 泛素连接酶TRAF6 介导的K63 泛素化而增加ULK1 稳定性并诱 导 ULK1 磷 酸 化[15];另 一方面 ,则通 过 TCEB2[transcription elongation factor B(SⅢ),polypeptide 2(18 kDa,elongin B)]与CUL5 相互作用,抑制CUL5的E3 泛素连接酶活性,致使包含DEP 域的与mTOR相互作用的蛋白(DEP-domain-containing mTOR-interacting protein,DEPTOR)这一CUL5 接头蛋白得以稳定并进而抑制mTOR功能表达[13,24]。
AMBRA1 也是其它E3 泛素连接酶在自噬过程中的重要辅助因子。例如,Antonioli 等[13,24]证实,AMBRA1 通过与E3 泛素连接酶CUL4 动态互作而调节自噬的发生和终止:在基础条件下,二者可相互结合,进而募集DDB1 以稳定AMBRA1 并促使其泛素化,诱导自噬发生;在应激性条件下,DDB1 则迅速释放AMBRA1,导致CUL4-AMBRA1 分离,从而增加AMBRA1 池,但是三者之间的分离极为短暂,随后即可再次结合并进一步降解AMBRA1,导致自噬过程终止。
除对TRAF6、CUL5 和CUL4 的协同作用之外,AMBRA1亦可作为E3泛素连接酶DDB1和环指蛋白2(ring finger protein 2,RNF2)的直接底物,参与调控泛素介导的蛋白酶体降解:如前所述,CUL4-DDB1复合物在基础条件下诱导AMBRA1泛素化及其降解以抑制自噬;而在应激性自噬诱导条件下,beclin-1的互作蛋白WASH(Wiskott-Aldrich syndrome protein and SCAR homolog)则可招募RNF2 并与之结合,后者通过Lys48 连接链诱导AMBRA1 的Lys45 位点泛素化,进而抑制自噬[25]。以上结果提示,AMBRA1可与 beclin-1、VPS34 及 E3 泛素连接酶 TRAF6、CUL4和CUL5 相互作用,从而诱发细胞自噬(图1)。近期Miki 等[26-27]首次证实,AMBRA1 是α-突触核蛋白(αsynuclein,α-Syn)的中枢结合蛋白,该研究组观察到AMBRA1 过表达与异常α-Syn 减少之间存在显著关联,而利用自噬溶酶体抑制剂巴甫洛霉素和siRNA干扰AMBRA1表达则会引起小鼠原代培养神经元胞质中α-Syn 异常聚集,同时可见α-Syn 与自噬体标志物LC3 明显共定位;此外还观察到,帕金森病(Parkinson disease,PD)、路易体痴呆(dementia with Lewy bodies,DLB)和多系统萎缩(multiple system atrophy,MSA)患者脑内自噬上游蛋白beclin-1 和VPS34 表达较健康被试者显著上调,而TRAF6 表达则显著下调。以上结果提示,AMBRA1 可能通过两种机制参与内源性α-Syn的转换:一是作为互作蛋白直接识别异常的α-Syn;二是作为降解蛋白通过介导自噬而降解异常的α-Syn。

Figure 1.AMBRA1 as a proautophagic protein involved in the regulation of autophagy.图1 AMBRA1作为促自噬因子参与调节细胞自噬
2.2 线粒体自噬 作为一种典型的选择性细胞自噬,线粒体自噬在线粒体质量控制中的清除作用较非特异性细胞自噬更为显著,其导致的线粒体选择性减少可与线粒体生物发生协同作用,使得线粒体数量保持稳定。Van Humbeeck 等[17]指出,在线粒体去极化过程中,AMBRA1 与线粒体自噬受体PARKIN(PARK2)的相互作用显著增强,其被PARKIN等蛋白招募至细胞核周聚集的线粒体上,形成线粒体聚集体。且此过程可与PI3KⅢ复合物的内质网转位活化协同配合,诱导线粒体自噬体形成。Strappazzon 等[14,28]和 D′Acunzo 等[29]报道指出,在 PARKIN 依赖的情况下,AMBRA1 可通过其LC3 互作域(LC3-interacting region,LIR)与LC3B 相互作用,且这一过程对于增强PINK1(PTEN-induced putative kinase protein 1)/PARKIN 途径介导的线粒体自噬是必需的;然而,在不依赖于PARKIN 和p62/sequestosome 1的情况下,线粒体外膜(outer mitochondrial membrane,OMM)上的AMBRA1 定位(AMBRA1-ActA)增加亦可通过其LIR 氨基酸序列与LC3B 蛋白相互作用,使受损线粒体被自噬体包裹进而降解清除,表明存在AMBRA1 依赖性线粒体自噬途径(图2)。此外,Di Rita 等[30]利用生物信息学分析技术观察到AMBRA1 的自噬诱导作用依赖于E3 泛素连接酶HUWE1 的活化,后者可激活其LIR 氨基酸序列附近的S1014 磷酸化位点,进而促进该序列与LC3B 相互作用,为后续氨基酸信号转导相关分子机制的研究提供了线索,说明HUWE1 可能是AMBRA1 介导线粒体自噬的协同因子。

Figure 2.AMBRA1 as a receptor protein to mediate mitophagy.图2 AMBRA1作为受体蛋白介导线粒体自噬
目前,已明确Bcl-2 家族成员对不同线粒体自噬途径均有抑制作用。例如,Bcl-xL 可抑制FUNDC1(FUN14 domain containing 1)介导的线粒体自噬[8],而 Bcl-2 则抑制 PARKIN 介导的线粒体自噬[31]。此外,Strappazzon 等[9]证实,定位于线粒体的 Bcl-2 可结合AMBRA1-ActA 并抑制其促自噬活性,但是Bcl-2 能否抑制AMBRA1 介导的线粒体自噬尚需进一步研究确认。Strappazzon 等[32]最近的研究结果显示,Bcl-2 同源物Mcl-1 过表达可显著抑制HUWE1 的线粒体转位,且其表达在AMBRA1 依赖性线粒体自噬过程中显著下调。抑制糖原合成酶激酶3β(glucogen synthase kinase-3β,GSK-3β)可使 Mcl-1 表达再次上调,随即削弱HUWE1 的协同作用进而延迟AMBRA1介导的线粒体自噬。这一结果提示,Mcl-1可能作为上游应激敏感蛋白,在AMBRA1 依赖性线粒体自噬中发挥负性调节作用,但其具体作用机制尚有待进一步研究予以阐明。
AMBRA1 亦可能通过介导线粒体自噬而参与C2C12 和 SH-SY5Y 细胞内稳态的调节[33-34]。它与目前已知的线粒体自噬受体FUNDC1、Nix/Bnip3L(BCL-2/adenovirus E1B protein-interacting protein 3-like)和 Bnip3 均呈现出如下共同特征:(1)定位于OMM;(2)存在LIR 氨基酸序列;(3)具备在线粒体过表达而诱导线粒体自噬的能力。但是,迄今尚未明确AMBRA1 作为线粒体自噬受体究竟如何被激活,亦不清楚其与自噬相关蛋白NDP52、optineurin、TAX1BP1、NBR1 和p62 等泛素化底物是否存在相互作用。此外,Strappazzon 等[14]观察到,AMBRA1 和LC3B 的共定位作用在羰基氰对三氟甲氧基苯腙(carbonyl cyanidep-trifluoromethoxyphenylhydrazone,FCCP)处理后可显著增强,而FCCP 如何诱导AMBRA1 与LC3B 发生明显共定位亦是有待探明的问题之一。
3 AMBRA1参与调节细胞凋亡
细胞凋亡是由基因和细胞因子调控的细胞程序性死亡,该过程的紊乱会导致诸如退行性疾病、自免疫疾病和癌症等多种疾病的发生。AMBRA1 通过与包括Bcl-2、Mcl-1 等凋亡蛋白在内的各种因子互作而调节细胞凋亡。其中,Bcl-2的抗凋亡作用与其线粒体定位密切相关[35],但其定位至线粒体的分子机制尚不明确。在HEK293 细胞内AMBRA1 可通过其线粒体池与Bcl-2 之间动态互作,诱导线粒体依赖性细胞凋亡[6]。尽管以上线索提示AMBRA1 可能具有促凋亡活性,但学界亦有不同研究结果。Fimia 等[11]报道,ambra1基因缺陷小鼠在出生后不久即因神经管闭合缺陷而死亡,并推测可能是由过度的细胞凋亡所致。Pagliarini 等[36]的研究结果显示,在人成纤维2FTGH 细胞凋亡过程中仅见AMBRA1 被降解,而其互作分子beclin-1 和自噬相关蛋白5(autophagyrelated protein 5,Atg5)则无显著变化,提示AMBRA1可能是细胞凋亡诱导蛋白水解的优先靶点。通过给予AMBRA1siRNA 或过表达处理,可分别促进细胞凋亡和提升细胞抗凋亡能力,而与野生型AMBRA1(AMBRA1WT)相比,抗CASP 突变体(AMBRA1D482A)则可致细胞凋亡率显著下降。由此可见,AMBRA1 可作为凋亡诱导因子CASP的作用底物而被裂解,最终抑制细胞凋亡[36]。因此,AMBRA1 在细胞凋亡中的作用可能具有细胞类型特异性,但其具体作用(促进或抑制)迄今仍不明确。
目前研究证实,随着OMM 通透性的增加,释放入胞质的细胞色素C(cytochrome C,Cyt C)可激活凋亡蛋白酶CASP 和CAPN,二者剪切一些促自噬蛋白(如AMBRA1、beclin-1、Atg4D 和Atg5),使其以裂解的形式转位至线粒体,并由于其促存活活性被抑制而加剧细胞凋亡[6,36-38]。需注意的是,AMBRA1被CASP 剪 切 后 产 生 的 C 末 端片 段(483-1300 aa,AMBRA1CT)可分别与Bcl-2家族的抗凋亡蛋白Bcl-2、Mcl-1 和 Bcl-xL 相互作用[6]。其中,与 Bcl-2 的相互作用是通过位于AMBRA1CT的BH3 一致序列而实现[6,36]。简言之,被剪切后的AMBRA1作为一种仅含BH3 序列的蛋白,可通过上述方式与Bcl-2 互作并抑制其抗凋亡活性,最终促进细胞凋亡。以上研究结果均提示了促自噬因子AMBRA1参与细胞(线粒体)凋亡途径的可能机制(图3)。
此外,需要指出的是,AMBRA1 必须被剪切才能阻断Bcl-2 的抗凋亡功能。全长的AMBRA1 可能呈现出BH3 序列在其C 末端被掩盖的构象状态,因而无法发挥对Bcl-2 的负性调节作用[22]。由于AMBRA1 被认为是一种无序蛋白,迄今尚未探明其三维结构,故AMBRA1 三维结构解析将有助于评价其在多种互作调控中的重要性。而且,AMBRA1 和Bcl-2 家族蛋白由于在内质网和线粒体上均同时参与自噬与凋亡过程[35],因此探明 AMBRA1 的分子构象亦将有助于更好地理解其在细胞生存与死亡交互影响过程中的生物学功能。总体而言,AMBRA1 不仅参与介导细胞自噬和线粒体自噬,同时还具有促凋亡或抗凋亡活性。首先,胞质内AMBRA1可与beclin-1、VPS34 及 E3 泛 素 连 接 酶 TRAF6、CUL4 和CUL5 相互作用,从而诱发细胞自噬;其次,在PARKIN 依赖或未知情况下,AMBRA1 可转位至线粒体(AMBRA1-ActA),并通过其LIR 氨基酸序列与LC3B相互作用,增强PINK1/PARKIN 介导的线粒体自噬和(或)诱发AMBRA1 依赖性线粒体自噬[14,28-29]。然而,AMBRA1 的促自噬活性在凋亡过程中受到了CASP 的严格调控:一方面,由CASP 剪切而产生的裂解形式AMBRA1CT可通过其BH3序列与Bcl-2相互作用,致使Bcl-2 的促存活活性丧失,最终诱导线粒体依赖的细胞凋亡[6];另一方面,AMBRA1D482A使细胞凋亡率较 AMBRA1WT显著下降[36],均提示 AMBRA1裂解对诱导细胞凋亡的重要贡献。如前所述,从AMBRA1 的全长或分裂形式进行考量,该蛋白可能处于自噬与凋亡调节的交叉点(图4)。
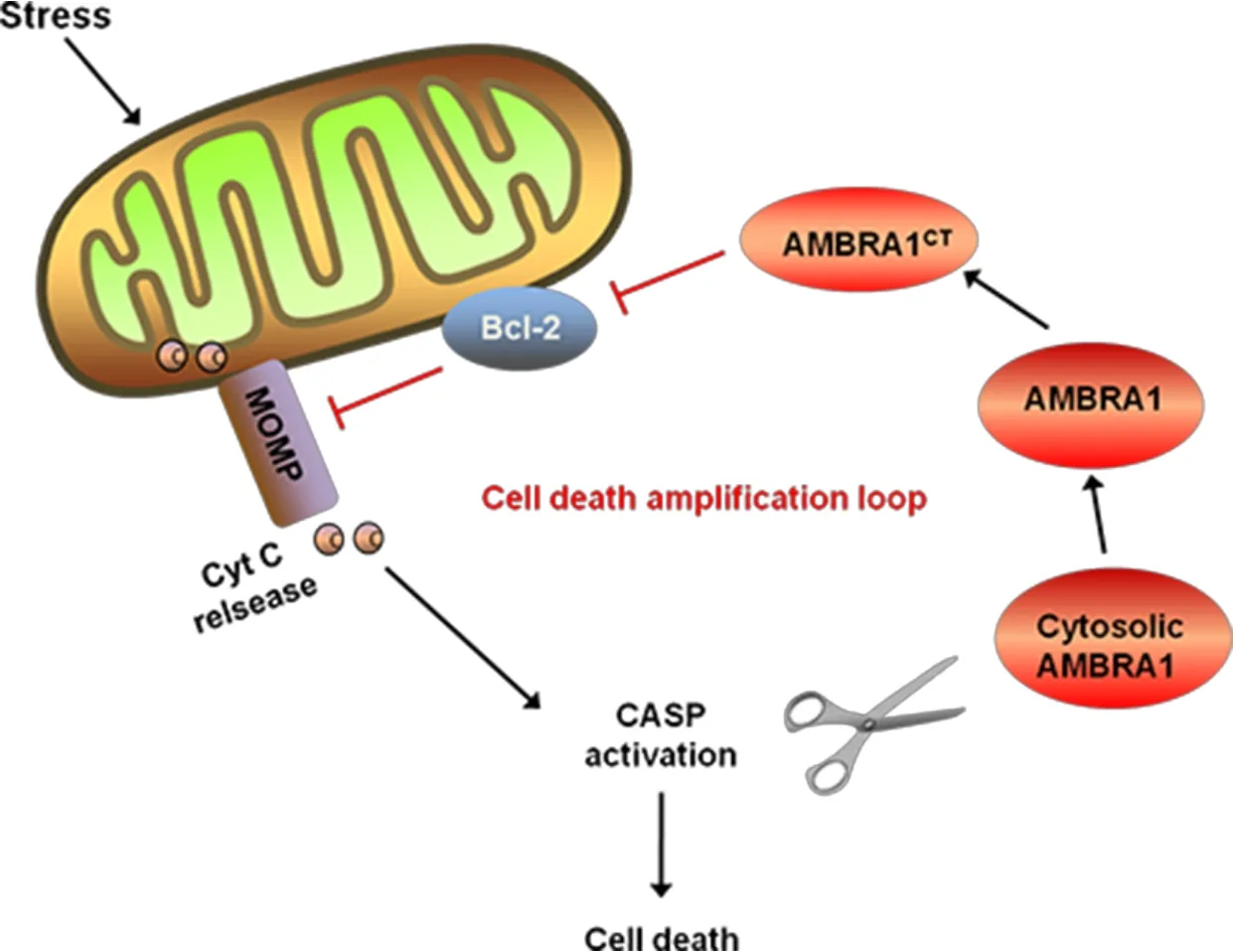
Figure 3.AMBRA1 is involved in the regulation of(mitochondrial)apoptosis.MOMP:mitochondrial outer membrane permeabilization.图3 AMBRA1参与调节细胞(线粒体)凋亡
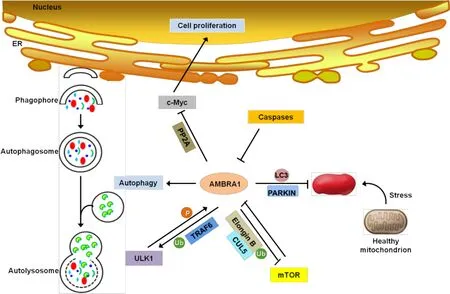
Figure 4.Regulatory effect of AMBRA1 on(mitochondrial)autophagy and apoptosis.图4 AMBRA1对细胞(线粒体)自噬与凋亡的调节作用
另外,抗凋亡因子Bcl-2 过表达是人类肿瘤发生发展过程中的常见现象,Bcl-2 可通过与beclin-1 直接联系[39]或介导隔离促自噬因子 AMBRA1[9]进而抑制细胞自噬。随后,AMBRA1 被阻断并裂解为AMBRA1CT,再通过BH3 序列与Bcl-2 结合以抑制Bcl-2 表达,但其是否促进癌细胞凋亡则仍有待进一步研究确认。近期大量研究结果表明,多种肿瘤的发生发展均伴随着ambra1基因突变和(或)蛋白表达变化,AMBRA1 不仅是癌症易感性[40]和预后机制[41]中不可或缺的关键环节,还可通过与beclin-1、动力蛋白激活蛋白1(dynactin 1,Dctn1)、干扰素诱导跨膜蛋白3(interferon-induced transmembrane protein 3,IFITM3)、Atg12 及促凋亡蛋白 Bim/BCL2L11等因子相互作用,介导自噬和(或)正性/负性调控多种化疗药物(如表柔比星、顺铂、紫杉醇等)诱导的自噬或凋亡过程,从而促进或抑制癌细胞存活、增殖和侵袭(表1)[42-50]。由此可见,AMBRA1可能是维持癌细胞自噬和凋亡之间平衡的调节子:一方面,自噬可能是癌细胞的一种保护机制,可降低化疗药物敏感性,导致癌细胞耐药,因而AMBRA1介导的自噬对癌细胞可能具有保护作用,是癌细胞耐药的潜在机制;另一方面,AMBRA1 亦可能通过调控其他信号通路(如AMBRA1-Bcl-2 的相互作用)而发挥抗癌作用。AMBRA1 的靶向促进或抑制可能是调控癌细胞化疗药物敏感性的有效方法,但其具体作用及相关机制仍有待深入研究[22]。

表1 AMBRA1在多类癌症中的调节作用Table 1.The regulatory role of AMBRA1 in multiple types of cancer
4 小结与展望
AMBRA1 作为一种多功能蛋白,参与多种信号通路介导的病理生理调控。通过与Bcl-2、beclin-1、PP2A、c-Myc、Dctn1、IFITM3、Atg12 及 Bim 等因子相互作用,它不仅具有促凋亡或抗凋亡活性,且能介导细胞(线粒体)自噬的发生,亦可促进或抑制癌细胞存活、增殖和侵袭。而由于AMBRA1 的全长或裂解形式之间存在一定转换,因此它可能处于自噬与凋亡的交叉点并在其中发挥重要作用。目前,有如下关键问题尚待阐明:(1)AMBRA1 介导线粒体自噬的分子机制尚不清楚,需探明是否还有更多的自噬相关蛋白参与其中;(2)为维持细胞内稳态,是否存在某些特定因子参与调控AMBRA1-Bcl-2 的结合或解离;(3)在体内、体外不同应激状态下或癌症模型中,AMBRA1是否与其它E3泛素连接酶及促凋亡因子存在相互作用,它在自噬和凋亡等过程中的不同调节作用究竟如何整合至协调反应之中;(4)可否利用AMBRA1 在癌症发生发展过程中的双重作用。厘清上述问题将为AMBRA1作为癌症辅助诊疗及预后评估潜在靶点在临床转化医学领域的应用提供理论与实验基础。
