大鼠肝纤维化与microRNA-181a调控肝星状细胞自噬的关系*
2021-02-05赖瑞敏朱月永
陈 靖, 郑 琦, 陈 薇, 赖瑞敏, 朱月永
(福建医科大学第一附属医院肝病中心,福建医科大学肝病研究所,福建福州350005)
肝纤维化(hepatic fibrosis,HF)是肝脏受到各种致病因素(包括病毒、酒精、代谢及免疫等)持续刺激,引起细胞外基质(extracellular matrix,ECM)弥漫性过度沉积的一种“创伤愈合”修复过程。HF 是各种慢性肝病进展为肝硬化甚至肝癌的关键步骤,也是影响预后的重要环节。HF 的形成机制复杂,除了针对某些肝病的病因治疗以外,迄今仍无有效或公认的抗HF 治疗方法用于临床。研究显示,HF 及少部分肝硬化加以干预后从组织学上是可逆转的[1]。
肌成纤维细胞(myofibroblast,MFB)是各种慢性肝损伤过程中产生ECM 的主要细胞,目前肝星状细胞(hepatic stellate cells,HSCs)仍是各种临床和实验性 HF 模型中 MFB 的主要来源[2]。HSCs 活化后转化为具有纤维性和明显收缩性的MFB,并分泌大量趋化因子和细胞因子,这一病理生理变化被认为是HF发生与发展的中心环节[3]。细胞自噬是一种细胞自我吞噬的程序性死亡,在许多纤维化疾病及肿瘤的病理过程中起着关键作用。异常的自噬活动会导致HF 的发生,其主要途径是促进HSCs 的活化和增殖[4],但目前尚不清楚HSCs 自噬是如何被触发的。微小RNA(microRNAs)是一类内源性非编码RNA,具有调控靶基因表达的功能,参与生命过程中一系列重要进程(如细胞分化、增殖、死亡等)[5]。表达异常的microRNAs 可以通过RNA 干扰途径影响自噬水平,使microRNAs成为近年来自噬研究的新动向[6]。
microRNAs 对HF 的发病过程也起着重要的调节作用,若干microRNAs 可调控参与HF 形成的细胞因子,或通过调控HSCs 的活化、增殖和凋亡等,促进或减缓HF进程[7-8]。我们前期研究显示,慢性乙型肝炎患者血清与肝组织中microRNA-181a 表达水平随HF程度加重而逐渐增高,高峰出现在III期HF(肝硬化前期)患者中[9]。因此,本研究通过四氯化碳(carbon tetrachloride,CCl4)建立大鼠 HF 模型,并在体外诱导自噬以及在细胞水平进行干预实验,探讨microRNA-181a 是否通过调控自噬而活化HSCs,以期为早期评估HF 提供潜在的生物标志物,并为以microRNA-181a为靶点的抗纤维化治疗提供参考资料。
材 料 和 方 法
1 动物和细胞
SPF 级雄性 Wistar 大 鼠 40 只,8 周龄,体重(200±10)g,购自上海斯莱克实验动物有限公司,许可证号为SCXK(沪)2017-0005。大鼠肝星状细胞系HSC-T6(ATCC细胞库,货号Y-01626)。
2 主要试剂
CCl4、转化生长因子β1(transforming growth factor-β1,TGF-β1)、3-甲基腺嘌呤(3-methyladenine,3-MA)、MTT 和DTT(Sigma);逆转录试剂盒和SYBR Premix EX Taq 试剂盒(TaKaRa);兔抗鼠β-actin 单克隆抗体(Santa Cruz);辣根过氧化物酶标记的羊抗兔II 抗和羊抗鼠 II 抗及TGF-β1 ELISA 试剂盒(北京中杉金桥公司);PVDF 膜(Millipore);Protein Molecular Weight Marker 和 Trizol 试剂盒(Thermo);蛋白定量检测试剂盒和 Protease Inhibitor Cocktail(Life);RPMI-1640 培养基、Lipofectamine 3000(Invitrogen);LC3-I、LC3-II、beclin-1 和 α-平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)单克隆抗体(Abcam);I型胶原(collagen type I,Col I)及Ⅲ型胶原(collagen type Ⅲ,Col Ⅲ)单克隆抗体(Santa Cruz);其他生化试剂均为国产分析纯。microRNA-181a inhibitor(microRNA-181a-i)和 inhibitor negative control(NC-i)由中国上海吉凯公司提供;microRNA-181a 和U6 引物的设计与合成由中国上海博尚公司完成,见表1。
3 主要方法
3.1 动物分组及HF 模型制备 以单纯CCl4法诱导大鼠 HF 模型[10]。40 只大鼠适应性喂养 1 周后,随机分为空白对照(control)组和 CCl4诱导 HF 模型 2 周(W2)、4 周(W4)、6 周(W6)及 8 周(W8)组,每组 8只。control 组皮下注射3 mL/kg 的橄榄油;W2、W4、W6 及 W8 组皮下注射 3 mL/kg 的 40%CCl4(4∶6 混合橄榄油),每周2 次,分别连续作用2、4、6 及8 周;各组于饲养周期末处死存活大鼠,经腹主动脉取血,分离血清后-70℃冰箱保存;取肝左叶相同部位组织,经4%多聚甲醛固定送病理及免疫组化检查,另取肝右叶相同部位组织,液氮冷冻后-70℃冰箱保存。

表1 RT-qPCR引物序列Table 1.Sequences of the primers for RT-qPCR
3.2 肝组织Masson 染色及纤维化评估 大鼠肝组织石蜡包埋后常规脱蜡至水,加Masson 复合液5 min,流水洗2~5 min,加0.2%醋酸处理1 min×2,流水洗1 min,加1%磷钨酸5~10 min,流水洗1 min,加亮绿染色液复染15 min,流水洗2~3 min,0.2%醋酸处理1 min×2,流水洗1~2 min,常规脱水透明,中性树胶封片,镜下观察:肝细胞胞浆呈红色,胶原呈蓝绿色。取Masson 染色切片,每个切片随机取5 个视野(物镜×10),以蓝色胶原沉积为阳性信号,用Image-Pro Plus 5.0 图像分析软件计算胶原容积分数(collagen volume fraction,CVF)。
3.3 ELISA 检测血清及肝组织中TGF-β1 水平 根据ELISA 试剂盒说明书检测大鼠血清及肝组织中TGF-β1含量。
3.4 RT-qPCR 检测血清及肝组织中microRNA-181a的表达 参照Trizol 试剂盒说明书提取大鼠血清及肝组织总RNA,按照说明书逆转录合成cDNA;参照SYBR Premix EX Taq 试剂盒操作说明进行qPCR,总反应体积为20 μL,扩增参数为:95℃ 5 min;95℃15 s,60℃ 30 s,72℃ 30 s。以 U6 为内参照,以 2-ΔΔCt法计算microRNA-181a的相对表达水平。
3.5 Western blot 法检测肝组织 LC3-II/-I、beclin-1、α-SMA、Col I 和Col III 蛋白表达 取大鼠肝组织加组织裂解液进行匀浆,加等体积2× SDS,充分振摇15 s,沸水浴中加热 10 min,4℃、12 000×g离心 10 min,取上清液,10% SDS-PAGE 分离 2~3 h,半干式转膜 1 h,将 PVDF 膜置于含 3%BSA 的 TBST 中,室温放置30 min;按说明书加抗LC3-II、LC3-I、beclin-1、α-SMA、Col I 和Col III 抗体,4℃孵育过夜,次日用TBST洗膜5 min×3 次,加相应的II 抗(1∶5 000),37℃孵育1.5 h,TBST 洗膜5 min×3 次,曝光,凝胶成像分析系统分析。以β-actin为内参照,以目的蛋白吸光度(A)值/β-actinA值表示目的蛋白水平。
3.6 不同浓度TGF-β1 诱导HSC-T6 细胞自噬 以TGF-β1诱导HSC-T6细胞自噬[11]。HSC-T6细胞接种于 6 孔培养板(2×104cells/well),第 2 天更换无血清RPMI-1640 培养液,置于37℃、5%CO2培养箱中培养24 h,予TGF-β1 梯度处理,终浓度依次为0、1、2、5 和10 μg/L,每个浓度设5 个复孔,继续孵育24 h 后收集细胞,进行后续检测。
3.7 细胞分组及培养 HSC-T6 细胞接种于6 孔培养板(2 ×104cells/well),至细胞达40%~60%汇合度时分为5 组:(1)control 组,采用正常细胞培养;(2)microRNA-181a-i组及NC-i组,按脂质体转染试剂Lipofectamine 3000 操作说明书并参考文献[12],分别转染浓度为 50 nmol/L 的 microRNA-181a-i 和 NC-i 4 h;(3)TGF-β1组,更换无血清RPMI-1640培养液;(4)3-MA 组,参考文献[13]加浓度为 10 mmol/L 的 3-MA 孵育45 min。除control组外,其余各组均加TGF-β1(根据3.6 筛选的最佳浓度)继续孵育24 h。每组设5 个复孔,同步收集细胞进行后续检测。
3.8 RT-qPCR 检 测 HSC-T6 细 胞 microRNA-181a 表达 参照Trizol 试剂盒说明书提取HSC-T6 细胞总RNA,其他步骤参见血清及肝组织RT-qPCR检测法。
3.9 Western blot 法检测 HSC-T6 细胞 LC3-II/-I、beclin-1、α-SMA、Col I 和 Col Ⅲ蛋白表达 HSC-T6 细胞干预完成后,弃细胞培养基,加TBS(2 mL/well)漂洗1 次,将6 孔培养板于滤纸上轻拍2~3 次后置于冰板上,加入热裂解缓冲液1× SDS(300 μL/well),细胞刷刮动数次,将细胞裂解液移至1.5 mL 的EP 管,沸水浴中加热10 min,12 000×g离心10 min,取上清液至新的EP 管,-70℃保存待测。其他步骤参见肝组织Western blot法检测。
4 统计学处理
采用SPSS 17.0 软件进行统计分析。数据均以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析,两两比较采用LSD 法;两变量间相关分析采用Spearman 相关分析。以P<0.05 为差异有统计学意义。
结 果
1 CCl4诱导建立大鼠HF模型
Masson染色显示,control组肝小叶结构规则,肝细胞以中央静脉为中心呈放射状规则排列,组织间隙中未见到蓝绿色组织;W2 组肝小叶结构较规则,肝细胞以中央静脉为中心呈放射状较规则排列,组织间隙中可见少量蓝绿色组织;W4 和W6 组肝小叶结构不规则,肝细胞于中央静脉周围不呈放射状排列,组织间隙中可见中等量蓝绿色组织;W8 组肝小叶结构紊乱,组织间隙中可见大量蓝绿色组织,见图1A。肝组织胶原分析结果显示,CCl4可呈时间依赖性促进肝组织胶原沉积,与control 组相比,W2 组肝组织CVF 显著增加(P<0.05),W4、W6 和W 8 组肝组织CVF进一步增加(P<0.01),见图1B。

Figure 1.Liver pathological changes induced by CCl4 for 2~8 weeks in rats.Masson staining method was used to show the collagen fibrils in liver tissue(scale bar=25 μm),and the volume fraction of collagen was analyzed.a:control group;b:W2 group;c:W4 group;d:W6 group;e:W8 group.Mean±SD. n=8. *P<0.05,**P<0.01 vs control group.图1 CCl4诱导的大鼠肝脏组织病理学改变
2 CCl4对大鼠血清及肝组织TGF-β1水平的影响
ELISA 结果显示,CCl4呈时间依赖性地促进大鼠血清及肝组织中TGF-β1 含量增加。与control 组相比,W2 组大鼠血清及肝组织中TGF-β1 水平均显著增加(P<0.05);W4、W6 和W8 组进一步增加(P<0.01),见表2。
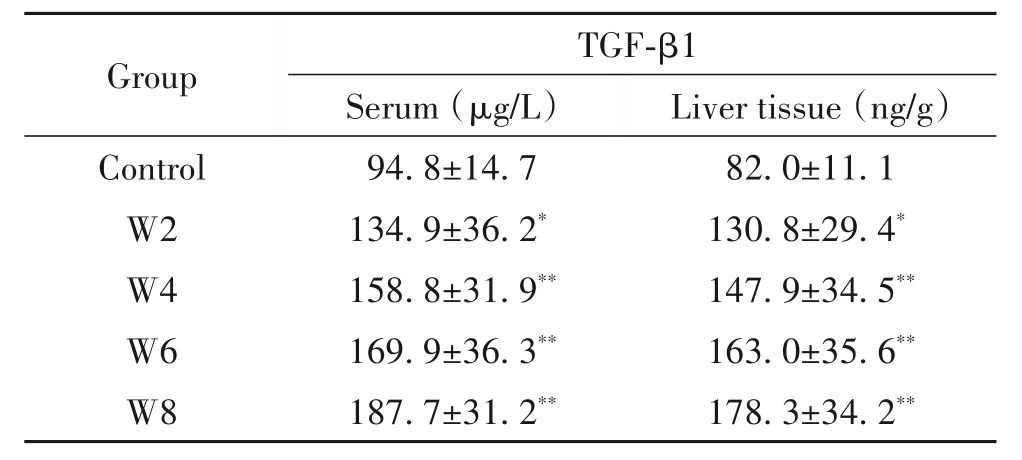
表2 CCl4对大鼠血清及肝组织中TGF-β1水平的影响Table 2.The effects of CCl4 on the protein levels of TGF-β1 in serum and liver tissue of rats(Mean±SD. n=8)
3 CCl4对大鼠肝组织中microRNA-181a 表达水平及 LC3-II/-I、beclin-1、α-SMA、Col I 和Col Ⅲ蛋白水平的影响
RT-qPCR 与 Western blot 结果显示,CCl4呈时间依赖性地上调大鼠肝组织microRNA-181a 表达水平以及LC3-II/-I 比值、beclin-1、α-SMA、Col I 和Col III 蛋白水平。与control组相比,W2组肝脏组织中microRNA-181a 表达水平及LC3-II/-I 比值、beclin-1、α-SMA、Col I 和Col III 水平均显著增加(P<0.05);W8 组 microRNA-181a 表达水平较W6 组下降,但并无显著差异;W8 组 LC3-II/-I 比值及 beclin-1 水平较 W6 组显著下降(P<0.01),见图2。大鼠肝组织microRNA-181a表达水平与 LC3-II/-I 比值、beclin-1、α-SMA、Col I 和Col Ⅲ水平呈显著正相关(P<0.01),r值分别为0.748、0.539、0.724、0.829及0.836。
4 不同浓度TGF-β1 对HSC-T6 细胞自噬及microRNA-181a表达水平的影响
Western blot 与RT-qPCR 检测结果分别显示:TGF-β1 呈浓度依赖性地促进HSC-T6 细胞自噬相关蛋白LC3-II/-I 比值、beclin-1 水平以及microRNA-181a 表达水平上调;与 TGF-β1 0 μg/L 处理组相比,TGF-β1 1、2、5 和 10 μg/L 处理组LC3-II/-I 比值和beclin-1水平以及microRNA-181a表达水平均显著增加(P<0.05);与 TGF-β1 5 μg/L 处理组相比,TGF-β1 10 μg/L 处理组 LC3-II/-I 比值和 beclin-1(P<0.05)水平显著下降,但microRNA-181a 表达水平并无显著性差异,见图3。因此,本研究以5 μg/L 为TGF-β1诱导HSC-T6细胞自噬的最佳浓度进行后续实验。

Figure 2.The effects of CCl4 on the expression of microRNA-181a,LC3-II/-I,beclin-1,α-SMA,Col I and Col III in rat liver tissue.A:RT-qPCR was used to measure the microRNA-181a level;B:Western blot was used to measure the expression levels of LC3-II/-I,beclin-1,α-SMA,Col I and Col III.Mean±SD. n=8. *P<0.05 vs control group;▲▲P<0.01 vs W6 group.图2 CCl4对大鼠肝脏组织中microRNA-181a表达水平及LC3-II/-I、beclin-1、α-SMA、Col I和Col Ⅲ蛋白水平的影响
5 microRNA-181a-i 对 TGF-β1 诱导 HSC-T6 细胞自噬和microRNA-181a表达水平的影响
RT-qPCR 检测结果显示,与control 组相比,TGF-β1 组和 NC-i 组 HSC-T6 细胞 microRNA-181a 表达水平均显著升高(P<0.01),microRNA-181a-i 组microRNA-181a 水平较 NC-i 组显著下降(P<0.01),NC-i 组和 3-MA 组较 TGF-β1 组并无显著差异,见图4A。Western blot 检测结果显示,与control 组相比,TGF-β1组和NC-i组HSC-T6细胞LC3-II/-I比值和beclin-1水平均显著升高(P<0.01),NC-i组LC3-II/-I比值和beclin-1 水平较TGF-β1 组并无显著差异,microRNA-181a-i 组 LC3-II/-I 比值和 beclin-1 水平均较NC-i 组显著下降(P<0.01),microRNA-181a-i 组LC3-II/-I 比值较 3-MA 组显著下降(P<0.05),但 beclin-1水平并无显著差异,见图4B。
6 microRNA-181a-i 对 TGF-β1 诱导 HSC-T6 细胞活化的影响
Western blot 检测结果显示,与control 组相比,TGF-β1 组和 NC-i 组 HSC-T6 细胞 α-SMA、Col I 及 ColⅢ水平均显著升高(P<0.01),但 TGF-β1 组与 NC-i组间均无显著差异;与NC-i组相比,microRNA-181a-i组及 3-MA 组 HSC-T6 细胞 α-SMA、Col I 及 Col Ⅲ水平均显著下降(P<0.01),但microRNA-181a-i 组与3-MA组间并无显著差异,见图5。
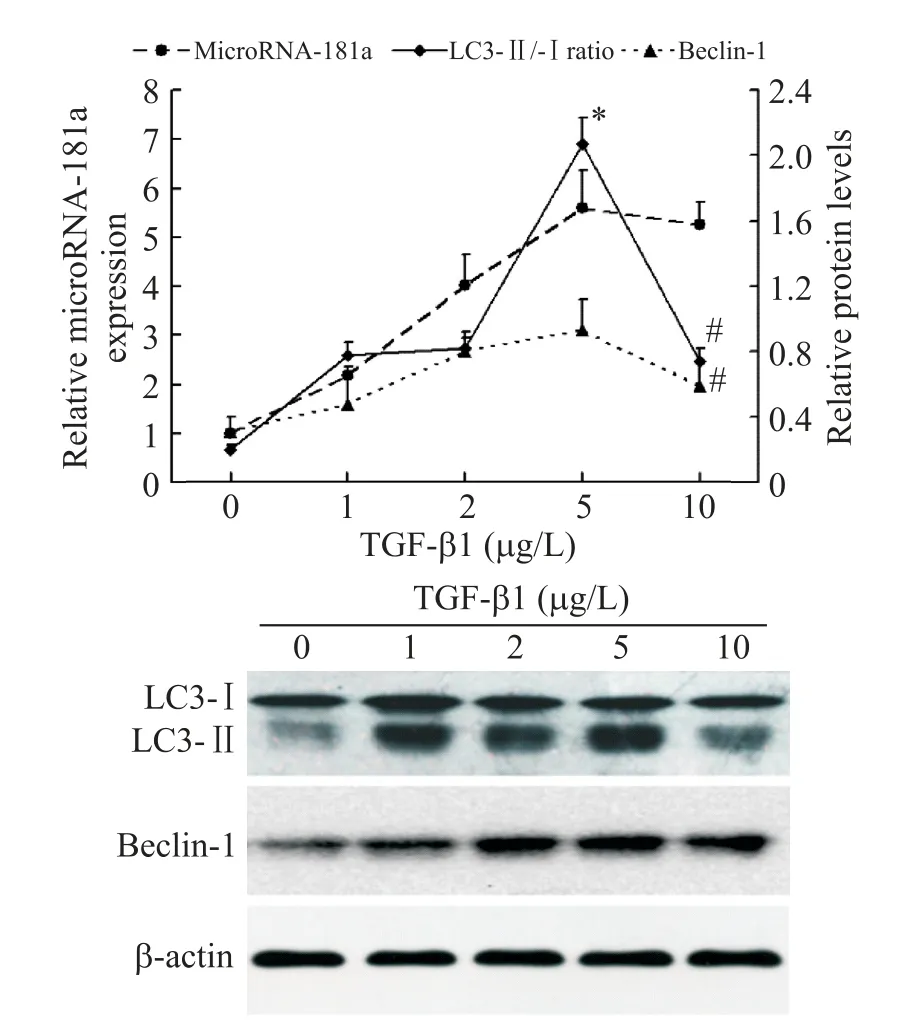
Figure 3.The effects of different concentrations of TGF-β1 on the expression of LC3-II/-I,beclin-1 and microRNA-181a in HSC-T6 cells detected by Western blot and RT-qPCR.Mean±SD. n=5. *P<0.05 vs 0 μg/L group;#P<0.05 vs 5 μg/L group.图3 不同浓度 TGF-β1 对HSC-T6 细胞LC3-II/-I 和 beclin-1蛋白水平及microRNA-181a表达水平的影响

Figure 4.The effect of microRNA-181a-i on the expression of LC3-II/-I,beclin-1 and microRNA-181a in HSC-T6 cells treated with TGF-β1(5 μg/L).A:RT-qPCR was used to measure microRNA-181a expression;B:Western blot was used to measure the protein levels of LC3-II/-I and beclin-1.Mean±SD. n=5.**P<0.01 vs control group;△△P<0.01 vs NC-i group;☆P<0.05 vs microRNA-181a-i group.图4 microRNA-181a-i对TGF-β1诱导HSC-T6细胞自噬和microRNA-181a表达水平的影响
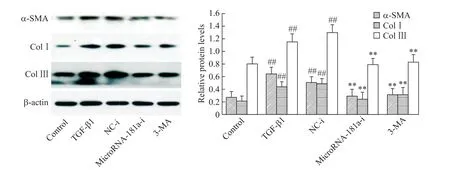
Figure 5.The effects of microRNA-181a-i on activation of HSC-T6 cells treated with TGF-β1(5 μg/L).Western blot was used to measure the protein levels of α-SMA,Col I and Col Ⅲ.Mean±SD. n=5.##P<0.01 vs control group;**P<0.01 vs NC-i group.图5 microRNA-181a-i对TGF-β1诱导HSC-T6细胞活化的影响
讨 论
HF 的形成是一个多因素影响、多细胞因子参与的极为复杂的病理生理过程,个体化差异也较大,临床针对病因治疗并不能完全抑制肝脏炎症和治疗HF。近年来研究表明,碧萝芷通过下调ERK 磷酸化介导的细胞自噬,可抑制TGF-β1 诱导的HSCs 活化[14]。在CCl4和胆管结扎诱导小鼠HF 模型的研究中表明,槲皮素[15]与红景天甙[16]可通过抑制TGF-β1/Smads 信号通路,抑制HSCs 自噬及活化,减轻小鼠HF。然而,在以抑制HSCs 活化为中心的抗HF 治疗方面,除了经典的致HF 信号转导途径外,包括自噬和表观遗传在内新的机制与通路的研究并不多。
本研究通过皮下注射CCl4构建大鼠HF 模型,病理组织学检查结果显示模型组大鼠肝组织均出现不同程度HF,并与造模时间呈正相关,提示大鼠HF 模型成功复制。此外,模型组大鼠肝组织TGF-β1 和microRNA-181a 的表达水平、自噬标志性蛋白LC3-II/-I 的比值及beclin-1 的水平均随HF 程度加重而呈上升趋势,且microRNA-181a 表达水平与细胞自噬呈正相关,提示在HF启动及进展过程中,TGF-β1和microRNA-181a 表达与肝细胞自噬之间可能存在某种病理、生理上相关联的机制,值得进一步探讨。
目前普遍认为,TGF-β 是强效的致纤维化细胞因子,在纤维化的启动和进展中起关键作用[17]。人体内 TGF-β1 为 TGF-β 超家族主要成员,可在肝脏炎症前期、炎症及炎症后阶段通过“三步级联反应”刺激HSCs活化并转化成MFB[18],后者能大量合成ECM并逐渐沉积,启动HF 进程。在此进程中涉及多条信号通路并相互影响。以往研究显示,TGF-β/Smads信号转导为 TGF-β1 刺激 HSCs 活化的主要通路[19]。近年来有研究显示,HSCs 活化依赖于自噬活性,活化的HSCs 大量增殖并产生大量胶原纤维时,也需要通过自噬降解过程来提供能量[20]。另有报道,TGF-β通过不同途径参与了肝癌细胞、乳腺癌细胞、肾小球基底膜细胞及成骨细胞等的自噬调控[21]。然而,TGF-β1 是否基于自噬促进HSCs 活化少有报道。本研究体外实验显示,TGF-β1 呈浓度依赖性地促进HSC-T6 自噬标志性蛋白LC3-II/-I 比值及beclin-1 水平增高,α-SMA、Col I和Col Ⅲ蛋白水平也显著增高,提示TGF-β1 能体外诱导HSCs 自噬及活化,这一结果与王冰莹等[22]报道结论较为一致。本研究显示,TGF-β1 体外诱导 HSCs 自噬最佳浓度为 5 μg/L,当TGF-β1 浓度增加至 10 μg/L 时 HSCs 自噬相对下降,提示TGF-β1 仅在一定浓度范围诱导HSCs 自噬,这与 Fu 等[11]报道的现象较为一致,但 TGF-β1 体外诱导HSCs 自噬的最佳浓度有差异,推测这可能与本研究以LC3-II/-I 比值而非LC3-II 抗体表达水平作为评估细胞自噬强弱有关。此外,本研究显示,在CCl4诱导大鼠严重HF 时TGF-β1 表达进一步升高,但细胞自噬有所减少,而高峰出现在严重HF 前期,提示在肝脏炎症前期与炎症期针对细胞自噬的调控可能为防治HF进展的合适时间窗。
研究显示,HSC-T6 细胞经 TGF-β1 处理后 microRNA-181a 表达显著上调,进而诱导HSC-T6 细胞活化[12]。以往有报道显示,microRNA-181a能减弱饥饿和雷帕霉素在乳腺癌MCF-7细胞、人类肝癌Huh-7细胞及慢性髓原白血病K562 细胞中诱导的自噬[23];还能调控NR8383 大鼠肺泡巨噬细胞自噬紊乱与促炎因子生成[24]。然而,不同类型细胞的自噬在肝损伤及HF 过程中扮演不同角色,microRNA-181a 是否通过调控HSC自噬进而诱导其活化尚未见报道。本研究显示,TGF-β1 体外诱导 HSC-T6 自噬及活化时伴有microRNA-181a 表达显著上调;在转染microRNA-181a-i 后 microRNA-181a 表达显著下降,HSC-T6自噬及活化显著受到抑制,这一现象与自噬抑制剂3-MA 作用结果相似。据此,我们推测microRNA-181a 为 TGF-β1 下游信号分子,介导了 HSCs 自噬及活化,这可能是TGF-β1 促进HSCs 活化在表观遗传的一种调控机制。
综上所述,随着CCl4诱导模型大鼠HF 的进展,大鼠肝组织中TGF-β1和microRNA-181a表达及自噬水平呈同步增高;下调HSC-T6 细胞microRNA-181a表达水平可抑制TGF-β1 诱导HSC-T6 细胞自噬与活化;大鼠 HF 与 microRNA-181a 调控 HSCs 自噬有关。本研究可能为基于microRNA-181a水平调控HSCs自噬和活化,以及抗HF靶点治疗提供实验基础。
