CaSR抑制剂Calhex231通过PTH-AR途径参与创伤失血性休克大鼠血管低反应性的调节*
2021-02-05彭小勇薛明英刘良明杨光明
彭小勇, 胡 弋, 薛明英, 李 涛, 刘良明, 杨光明
(陆军特色医学中心野战外科研究部战伤休克与输血研究室,创伤、烧伤与复合伤国家重点实验室,重庆400042)
创伤失血性休克在临床上的发生率和死亡率均较高,其中一个引起患者死亡的重要原因是创伤失血性休克后的血管低反应性,即复苏后血管对血管活性药物反应减弱甚至不反应[1-3]。因此,深入研究血管低反应性的发生机制并寻找有效的治疗措施具有重要意义。钙敏感性受体(calcium-sensing receptor,CaSR)首先由 Brown 等[4]克隆发现,属于 G 蛋白偶联受体C 家族成员,主要分布于甲状旁腺、骨骼、肾脏等器官,其基本功能是维持机体钙稳态,还可调控细胞增殖和分化。有研究表明,CaSR 在血管舒缩功能调节中也有重要作用[5-6]。我们前期的研究证实CaSR 抑制剂Calhex231(Cal)可通过改善休克后血管低反应性发挥对创伤失血性休克动物的保护作用[7]。但我们也发现Cal 不是通过影响全身或血管平滑肌细胞(vascular smooth muscle cells,VSMC)内外的钙水平来发挥作用,提示有其它机制参与。
作为最先在甲状旁腺被发现的分子,CaSR 对甲状旁腺素(parathyroid hormone,PTH)的合成和分泌有重要调节作用[8-9]。PTH 是调节钙磷代谢的重要激素,它可以通过不同的途径来调节血压[10],且对成骨样细胞和心肌细胞中的β-肾上腺素受体(adrenergic receptor,AR)均有调节作用[11-12]。AR 属于G 蛋白偶联受体,是一类介导儿茶酚胺作用的组织受体。大量研究证实,AR失敏是血管低反应性的重要机制之一[13]。那么,CaSR 抑制剂 Cal 改善休克后血管低反应性是否与PTH和AR途径有关呢?为此,本研究采用创伤失血性休克大鼠模型及大鼠原代VSMC,观察Cal 对休克大鼠血PTH 水平、肠系膜上动脉(superior mesenteric artery,SMA)中2 种AR 亚型(α1-AR 和β1-AR)蛋白表达和肌球蛋白轻链(myosin light chain,MLC;VSMC 收缩的关键元件)磷酸化的影响,同时进一步观察外源给予PTH 对大鼠血压和原代VSMC中α1-AR 和β1-AR 蛋白表达的影响,初步探讨CaSR抑制剂Cal 通过PTH-AR 途径改善大鼠血管低反应性的机制。
材 料 和 方 法
1 动物和细胞
健康成年SD 大鼠,由陆军特色医学中心实验动物中心提供[动物使用许可证号为SYXK(军)2017-0058],雌雄各半,体重(220±20)g。组织贴块法培养大鼠原代VSMC。
2 主要试剂
平滑肌细胞专用培养基购自ScienCell;胎牛血清购自 Gibco;Cal 购自 TOCRIS;重组 PTH 购自上海碧云天生物技术有限公司;牛血清白蛋白购自Life Science;大鼠PTH ELISA 试剂盒购自上海江莱生物科技有限公司;抗α1-AR 和β1-AR 抗体购自Abcam;抗 MLC 和 p-MLC 抗体购自 Cell Signaling Technology;抗β-actin 抗体购自Invitrogen;山羊抗兔和抗小鼠荧光Ⅱ抗购自Jackson。
3 主要方法
3.1 创伤失血性休克动物模型的建立、复苏及样品采集 大鼠于实验前12 h 禁食、自由饮水。实验时用30 g/L 戊巴比妥钠(30 mg/kg)腹腔注射麻醉。32只大鼠随机分为正常(normal)组、休克(shock)组、休克+乳酸林格氏液(lactated Ringer′s solution,LR)复苏组(LR 组)和休克+LR+Cal(1 mg/kg)复苏组(LR+Cal 组),行左侧股动、静脉插管以监测平均动脉压(mean arterial pressure,MAP)、放血和复苏给药。插管结束后行右侧股骨骨折,从股动脉抽血使血压降至30 mmHg(1 mmHg=0.133 kPa)并维持2 h。模型完成后按照实验分组进行复苏:shock组不予液体复苏;LR 组用注射泵按20 mL/h 的速度输注2 倍失血量的LR;LR+Cal组先给予1倍失血量的LR 输注,然后把相应剂量的Cal 加入另外1 倍失血量的LR 中输注。复苏2 h后通过股动脉抽取全血1 mL,用于检测血 PTH 水平,然后取 SMA 用于检测 α1-AR、β1-AR、MLC及p-MLC蛋白水平。
3.2 血PTH 浓度的检测 全血于4℃、3 000 r/min离心10 min,取上清。预先取出样品和试剂盒,平衡至室温。取出试剂盒板条,设置样品孔、标准品孔及空白孔并设置1 个复孔,分别加入50 μL 样品、标准品和样品稀释液至各孔,然后每孔加入100 μL 辣根过氧化物酶标记的抗体,用封板膜封好后置于37℃恒温箱孵育1 h。倒掉各孔液体并在滤纸上拍干,每孔加入300 μL 洗涤液,静置1 min 后倒掉洗涤液,继续在滤纸上拍干,重复洗板5 次。每孔先后加入50 μL试剂盒底物A、B,37℃恒温箱孵育15 min,然后加入 50 μL 终止液,15 min 内在 450 nm 波长处检测A值。绘制标准曲线,计算样品浓度值。
3.3 外源性PTH 对大鼠血压的影响 12 只大鼠随机分为正常组和休克组。同前插管用于监测平均动脉血压和给予外源性PTH。模型完成后将PTH 按照2 μg/kg 的剂量加入0.2 mL 生理盐水中静推,观察外源给予PTH对正常和休克大鼠血压的影响。
3.4 大鼠原代VSMC 的提取与培养 大鼠麻醉后,用碘伏消毒大鼠胸腹部皮肤,取SMA,用无菌PBS 清洗5 次。剖开血管,刮除内皮层,剪碎后把组织平铺在25 cm2培养瓶中,加入5 mL含10%胎牛血清和1%双抗的平滑肌细胞专用培养基,先倒置放于37℃、5% CO2培养箱中30 min,然后翻转培养瓶培养。5~7 d 后去组织块,长满后继续传代培养。选择3~5 代的VSMC 接种至6 孔板,随机分为正常组、PTH 组及PTH+Cal 组,待细胞融合度80%左右时,PTH 组用10 nmol/L 的 PTH 处理 2 h,PTH+Cal 组先用 10 nmol/L 的PTH处理2 h,再用10 μmol/L的Cal处理4 h。收集细胞用于检测α1-AR和β1-AR的蛋白表达水平。
3.5 Western blot 检测 SMA 和 VSMC 中蛋白表达取各组SMA 和VSMC,加入预冷的含蛋白酶抑制剂的 RIPA 在冰上裂解 40 min 后于 4℃、12 000 r/min 离心15 min,取上清,用BCA 法测定蛋白浓度。取20 μg 总蛋白,加入loading buffer,干浴(100℃)5 min 使蛋白变性,然后行SDS-PAGE,350 mA 恒流转膜1.5 h,5%脱脂奶粉室温封闭2 h,加入I 抗(α1-AR,1∶400;β1-AR,1∶800;MLC,1∶1 000;p-MLC,1∶500;β-actin,1∶7 000),4℃孵育过夜,TBST 洗5 min×3次,加入荧光标记的II 抗(1∶20 000)室温孵育 1 h,TBST 洗10 min×3 次,用双色红外成像激光系统扫描成像。利用Quantity One 分析软件读取各组灰度值,并以β-actin作为内参照计算灰度比值。
4 统计学处理
用SPSS 18.0 软件进行统计分析。实验数据均以均数±标准差(mean±SD)表示。两组间比较采用配对样本t检验;多组间比较采用单因素方差分析,两两比较采用Bonferroni 校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 Cal对创伤失血性休克大鼠血PTH浓度的影响
根据标准曲线(图1A)计算出各组大鼠血PTH浓度,结果显示,创伤失血性休克后大鼠血PTH 浓度显著升高(P<0.01),LR 组血PTH 浓度继续升高,输注Cal能显著降低血PTH浓度(P<0.01),见图1B。

Figure 1.The effect of Cal on blood level of PTH after traumatic hemorrhagic shock in rats.A:linear regression equation;B:blood PTH levels in the rats.Mean±SD. n=8.**P<0.01 vs normal group;##P<0.05 vs LR group.图1 Cal对创伤失血性休克大鼠血PTH浓度的影响
2 Cal 对创伤失血性休克大鼠SMA 中α1-AR 和β1-AR蛋白表达的影响
Western blot 结果显示,休克组大鼠SMA 中α1-AR 蛋白表达水平显著降低(P<0.05),LR 组大鼠SMA 中α1-AR 蛋白表达水平与休克组比较差异无统计学显著性,Cal治疗后SMA中α1-AR蛋白表达水平与LR 组比较显著升高(P<0.05),见图2A。各组β1-AR蛋白表达水平的差异无统计学显著性,见图2B。
3 Cal对创伤失血性休克大鼠SMA中MLC磷酸化水平的影响
休克组大鼠SMA 中p-MLC 水平显著降低(P<0.01),LR 组大鼠 SMA 中 p-MLC 水平与休克组比较差异无统计学显著性,Cal 组SMA 中p-MLC 水平与LR组比较显著升高(P<0.01);各组MLC蛋白水平的差异无统计学显著性,见图3。
4 外源给予PTH 对正常和创伤失血性休克大鼠MAP的影响
为了进一步明确PTH 对大鼠血压的影响,我们观察了外源给予PTH 对正常和休克大鼠血压的影响。静脉推注PTH(2 μg/kg)后,正常组大鼠MAP 显著降低,降低幅度达到45.1%,而休克组大鼠血压也有所降低,降低幅度约为8.8%,见图4。
5 外源给予PTH 对大鼠原代VSMC 中α1-AR 和β1-AR蛋白表达的影响
PTH 处理大鼠原代 VSMC 使 α1-AR 蛋白表达水平显著降低(P<0.01);而Cal 能拮抗PTH 降低α1-AR蛋白表达的作用,使α1-AR 表达水平升高,与PTH 组比较差异具有统计学意义(P<0.05),见图5A。各组β1-AR 蛋白表达水平的差异无统计学显著性,见图5B。
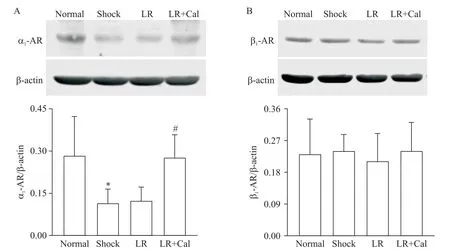
Figure 2.The effect of Cal on the protein expression of α1-AR(A)and β1-AR(B)in the SMA of rats after traumatic hemorrhagic shock.Mean±SD. n=3.**P<0.01 vs normal group;#P<0.05 vs LR group.图2 Cal对创伤失血性休克大鼠SMA中α1-AR和β1-AR蛋白表达的影响

Figure 3.The effect of Cal on the phosphorylation level of MLC in the SMA of rats after traumatic hemorrhagic shock.Mean±SD. n=3.**P<0.01 vs normal group;#P<0.05 vs LR group.图3 Cal对创伤失血性休克大鼠SMA中MLC磷酸化水平的影响

Figure 4.The effect of exogenous PTH on mean arterial blood pressure(MAP)in normal and traumatic hemorrhagic shock rats.Mean±SD. n=6.**P<0.01 vs before transfusion.图4 外源给予PTH对正常和创伤失血性休克大鼠平均动脉压的影响
讨 论
休克后血管低反应性的发生机制主要有受体失敏机制和VSMC 膜超极化机制。受体失敏包括AR失敏和血管紧张素受体失敏等。AR 失敏是由缺血等因素引起的受体数目减少或下调、亲和力降低及与腺苷酸环化酶偶联障碍[14]。AR 主要分为 2 个亚型,包括α-AR(α1-AR 和α2-AR)和β-AR(β1-AR、β2-AR 及β3-AR),其中在心血管系统中分布的主要是α1-AR 和β1-AR。以往研究表明,在人和大鼠外周动脉中均有 α1-AR 和 β1-AR 的 mRNA 和蛋白表达,并且在血管收缩过程中发挥重要作用[15-16]。AR 是调节VSMC收缩舒张的重要靶点,在失血性休克和脓毒症休克中都证实α1-AR 失敏会导致血管低反应性[17-18]。VSMC 收缩主要由MLC 激酶和MLC 磷酸酶对MLC磷酸化和去磷酸化来调节[19]。MLC 磷酸化水平是VSMC 中收缩力生成的决定因素,AR 可通过调节MLC 激酶进而影响 MLC 磷酸化水平[20]。那么 Cal 改善创伤失血性休克后血管低反应性的机制是否通过AR调节MLC磷酸化水平而发挥作用,且通过哪个亚型呢?我们的实验结果显示,创伤失血性休克后大鼠SMA 中α1-AR 表达显著降低,Cal 能显著提高α1-AR 蛋白表达水平,而各组大鼠SMA 中β1-AR 蛋白表达水平无显著差异。同时,创伤失血性休克后血管组织的MLC 磷酸化水平显著降低,而Cal 可显著提高MLC 磷酸化水平,提示Cal可能通过上调α1-AR 表达、增加MLC 磷酸化水平来改善血管低反应性。那么,Cal是如何调节α1-AR呢?

Figure 5.The effect of exogenous PTH on the expression of α1-AR(A)and β1-AR(B)in rat primary VSMC.Mean±SD. n=3.**P<0.01 vs normal group;#P<0.05 vs PTH group.图5 外源给予PTH对大鼠原代VSMC中α1-AR和β1-AR蛋白表达的影响
CaSR 首先在甲状旁腺中被克隆,PTH 是由甲状旁腺分泌的一种重要的钙磷调节激素[21],其基本作用是通过骨化三醇调节胞外Ca2+浓度。CaSR 可通过感受血钙浓度作用于甲状旁腺,对血PTH 水平的调控起关键作用[9]。现有研究表明,PTH 与血压和血管收缩舒张有重要的关联,并在不同的疾病模型中发挥不同的作用。例如,它在原发性甲状旁腺功能亢进患者中可以增加血钙浓度而升高血压;在慢性肾病患者中,它可以通过激活肾素-血管紧张素-醛固酮信号途径促进水钠重吸收来增加血容量进而升高血压[22-23]。此外,也有文献报道,间歇性地给予小鼠注射PTH 可刺激骨皮质并引起血管舒张[24];外源性PTH 还可以拮抗血管对去甲肾上腺素和血管紧张素的升血压效应[25]。一项对46 名创伤患者的研究显示,创伤失血性休克病人血中PTH 水平显著提高[21]。我们在实验中也观察到创伤失血性休克大鼠血PTH水平显著增高,那么PTH 是否与休克后的低血压有关?为此,我们观察了给予外源性PTH 对正常和休克大鼠血压的影响,结果显示,外源性PTH 能显著降低正常大鼠血压,也使休克大鼠血压轻度降低。我们推测这种现象可能与休克后大鼠血压本身较低和血PTH浓度本身较高有关。考虑到文献报道PTH可通过β-AR 调节心肌的收缩功能[12]。我们进一步观察了外源性 PTH 对 Cal 调节 VSMC 中 AR 作用的影响。结果发现,PTH 处理大鼠原代VSMC 使α1-AR蛋白表达降低,Cal 能够拮抗PTH 的这种作用,提示Cal可能通过PTH来调节AR表达。
综上所述,本实验结果显示,创伤失血性休克后Cal 可通过降低血PTH 浓度、上调血管α1-AR 蛋白表达水平、升高VSMC 中MLC 磷酸化水平而发挥改善休克后血管低反应性的作用。
