肝细胞内质网应激对tsRNA表达谱的影响及其功能研究
2021-02-05李涵潘勤
李 涵 潘 勤
内质网是真核细胞内一类膜性细胞器,有脂质合成、蛋白质加工及钙离子稳态调节等重要功能。当细胞受到损伤刺激时,可发生以内质网腔内错误折叠或未折叠蛋白积聚、钙离子平衡紊乱为特征的内质网应激(endoplasmic reticulum stress, ERS)[1]。适度的ERS有助于内质网稳态的恢复,持续的ERS则可能诱导细胞凋亡。
近年来伴随肥胖的全球流行和生活方式的逐渐西化,以肝细胞脂肪变性、气球样变、小叶内炎症等为主要病理表现的非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)日益高发,已经成为公共卫生的重要负担[2]。有研究表明,ERS既能够诱导脂肪生成,又可参与胰岛素抵抗和自噬来驱动肝脏脂肪变性,从而在NAFLD的发生、发展过程中发挥着重要作用[3]。然而,ERS介导NAFLD的病理生理机制尚未完全阐明。
据近年来相关文献报道,应激可诱导一类tRNA衍生性小RNA(tRNA derived small RNA, tsRNA)的产生。tsRNA是由成熟tRNA或tRNA前体经酶切产生的非编码RNA[4]。研究显示,tsRNA在肥胖症、酒精性脂肪性肝病等代谢性疾病的发病机制中发挥重要作用[5~7]。因此,本研究采用棕榈酸钠诱导肝细胞脂肪变,从而建立ERS模型,以此为基础探讨tsRNA在肝脂肪变中的表达情况及其潜在功能。
材料与方法
1.材料:小鼠肝细胞株AML12由中国科学院细胞库提供; ITS液体培养基补充剂(100×,ITS liquid media supplement)、棕榈酸(palmitic acid, PA)及油红O粉末均购自美国Simga-Aldrich公司;胎牛血清(fetal bovine serum, FBS)、DMEM/F12培养基购自美国Gibco公司;RT-qPCR试剂盒购自日本TaKaRa公司;葡萄糖调节蛋白78(glucose regulated protein78,GRP7) 兔单克隆抗体、CCAAT增强子结合蛋白同源蛋白(C/EBP homologous protein C/EBP,CHOP)兔单克隆抗体购自美国CST公司;β-tubulin兔单克隆抗体及山羊抗兔二抗购自上海优宁维公司;RT-qPCR引物购自生工生物工程(上海)股份有限公司。
2.细胞培养及ERS模型的建立:采用含ITS、40ng/ml地塞米松及10%FBS的DMEM/F12完全培养基,于37℃、5%CO2条件下培养AML12细胞。取对数生长期的AML12细胞,随机分为对照组和高脂组,每组设3个重复。待细胞融合度达50%~60% 时,高脂组给予200μmol/L PA干预24h以建立ERS模型,对照组予不含PA的完全培养基培养24h。
3.RT-qPCR检测mRNA的表达:收集各组AML12细胞,采用Trizol法提取细胞总RNA,测定浓度及纯度后反转录为cDNA。然后以cDNA为模板,GAPDH为内参照进行qPCR反应,并采用2-ΔΔCt法计算GRP78、CHOP的相对表达量。GRP78的上游引物序列为:5′-GTGTGTGAGACCAGAACCGT-3′,下游引物序列为:5′-TAGGTGGTCCCCAAGTCGAT-3′;CHOP的上游引物序列为:5′-CCACCACACCTGAAAGCAGAA-3′,下游引物序列为:5′-AGGTGAAAGGCAGGGACTCA-3′。
4.Western blot法检测蛋白的表达:收集各组AML12细胞,加入RIPA裂解液,冰上静置30min,收集裂解液,离心后取上清,用BCA法测定蛋白浓度。采用10%SDS-PAGE胶行蛋白电泳分离,并转移至PVDF膜。以5%脱脂牛奶室温封闭2h后,分别加入抗GRP78(1∶1000)和CHOP(1∶1000)抗体4℃孵育过夜。TBST清洗后加入二抗,室温孵育1h。采用化学发光液进行显影。以β-tubulin作为内参,分析蛋白的相对表达量。
5.油红O染色:将各组细胞以4%多聚甲醛固定30min,PBS漂洗两次,随后根据试剂盒说明书进行油红O染色。
6.tsRNA测序:收集各组细胞,以Trizol法提取总RNA,测定其浓度及纯度后采用以下步骤制备文库:①3′接头连接;②5′接头连接;③cDNA合成;④PCR扩增;⑤回收0~150bp的PCR扩增片段。使用Agilent 2100 Bioanalyzer仪器检测文库质量,并根据供应商操作说明,在Illumina HiSeq 4000测序仪上进行50个循环测序。
7.差异tsRNA的鉴定:使用Q30进行质控分析,保留Q30>80%的测序结果。采用Cutadapt软件(v1.9.3)去除接头和低质量reads,得到长度≥16nt的trimmed reads。依据tsRNA数据库(MINTbase v2.0)的注释,统计每个tsRNA在每个样品trimmed reads中的计数,将其作为该tsRNA的原始表达量。然后使用edgeR软件(v3.16.5)计算各tsRNA的变化倍数和P值。采用倍数变化>2.0和P<0.05为标准,筛选显著差异表达的tsRNA。
8.生物信息学分析:使用基于TargetScan(http:∥www.targetscan.org)和miRanda(http:∥www.microrna.org)的miRNA靶基因预测工具,预测tsRNA在小鼠mRNA 3′非翻译区的结合位点。在此基础上进行基于Geneontology (http:∥www.geneontology.org/)的功能分析,以及基于KEGG(Kyoto Encyclopedia of Genes and Genomes )数据库(http:∥www.kegg.jp/)的信号通路分析。

结 果
1.肝细胞ERS模型的构建:经200μmol/L 的PA干预24h后,采用RT-qPCR和Western blot法分别检测内质网应激标志物GRP78、CHOP的表达变化。结果显示,高脂组GRP78及CHOP的mRNA和蛋白表达水平较对照组显著上调(P<0.01),详见图1。
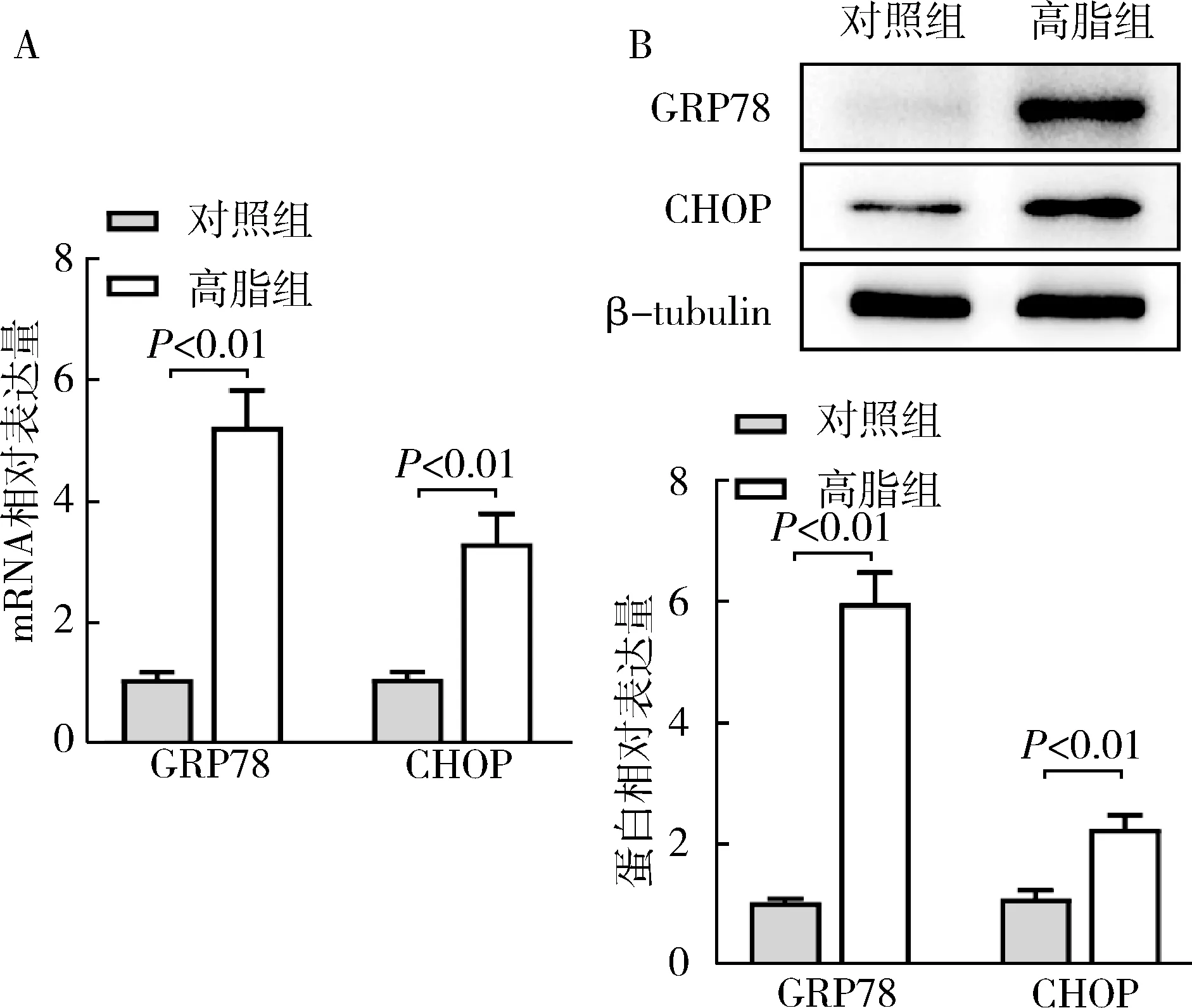
图1 棕榈酸诱导肝细胞ERS A.GRP78和CHOP mRNA表达水平; B.GRP78和CHOP蛋白表达水平
2.肝细胞ERS对脂肪变性的影响:经油红O染色,对照组AML12细胞内未见明显的脂滴沉积,而高脂组的细胞质内存在大量红色脂滴,详见图2。

图2 肝细胞油红O染色(×100) A.对照组;B.高脂组
3.肝细胞ERS对tsRNA表达谱的影响及差异tsRNA的靶基因预测:对高脂组(n=3)和对照组(n=3)的细胞进行tsRNA测序,在两组中共鉴定出193条tsRNA。以倍数变化>2及P<0.05为标准,进一步筛选得到10条显著上调的tsRNA和28条显著下调的tsRNA,详见图3。上调的前5位tsRNA包括:tsRNA-Ser-AGA、tsRNA-Met-CAT、tsRNA-Arg-TCG、tsRNA-Ile-AAT、tsRNA-Ser-GCT;下调的前5位tsRNA包括:tsRNA-Glu-CTC、tsRNA-pre-Val-TAC-1、tsRNA-pre- Val-TAC-2、tsRNA-Lys-CTT、tsRNA-pre-Val-TAC-3。使用基于TargetScan和miRanda的预测工具对tsRNA作用的靶基因进行预测,共得到4973个靶基因。
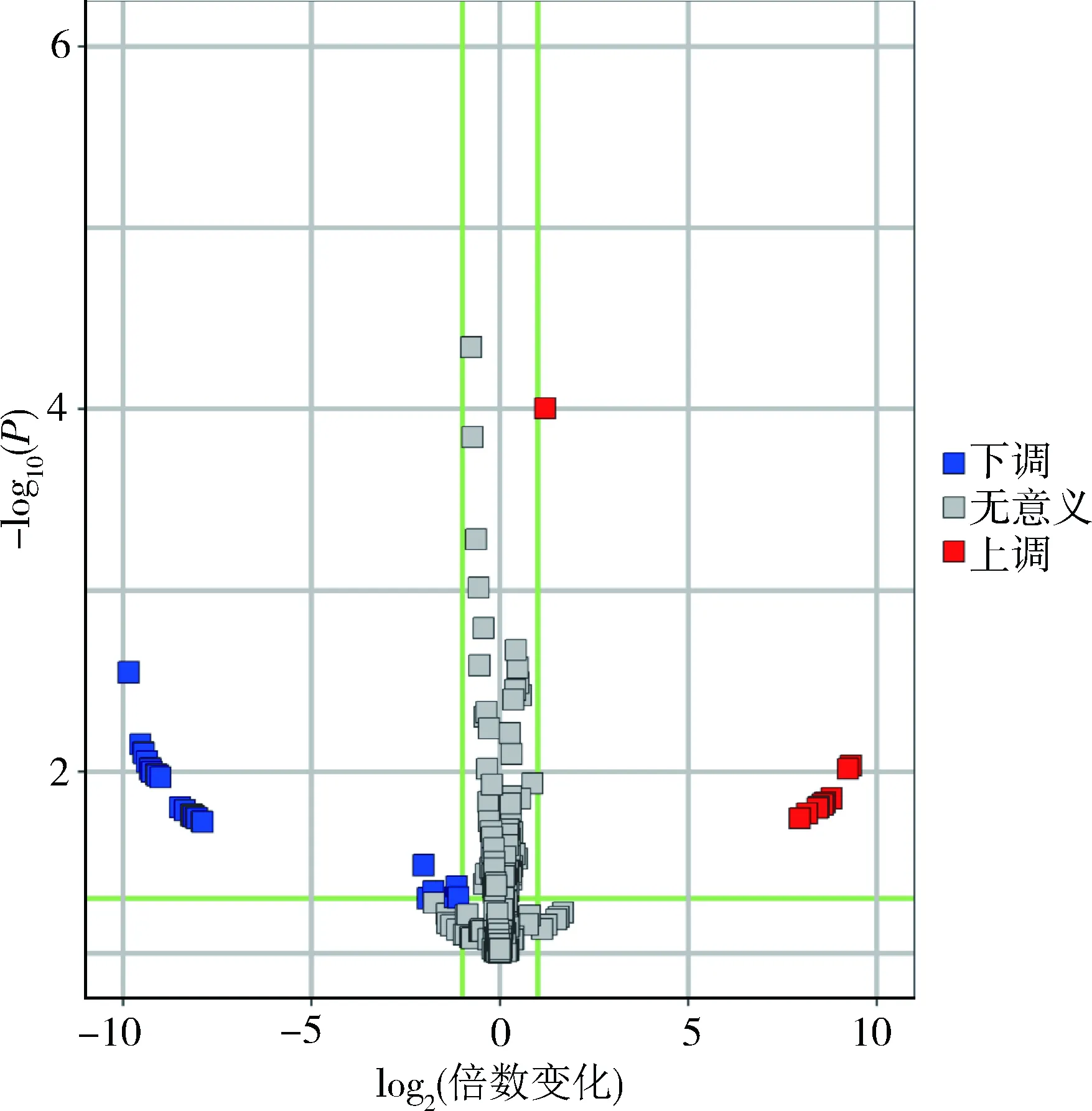
图3 肝细胞ERS对tsRNA表达谱的影响
4.差异tsRNA靶基因的信号通路分析:针对差异tsRNA的预测靶基因进行KEGG分析。上调的差异tsRNA调控的靶基因在cAMP信号通路、坏血酸和藻酸盐代谢、戊糖和葡萄糖醛酸酯的相互转化、淀粉和蔗糖代谢等肝细胞代谢相关的信号通路中高度富集,详见图4。下调的差异tsRNA的靶基因则主要富集于Rap1信号通路、Ras信号通路、VEGF信号通路、甘油磷脂代谢等信号通路,详见图5。

图4 上调的差异tsRNA靶基因的KEGG分析

图5 下调的差异tsRNA靶基因的KEGG分析
5.差异tsRNA预测靶基因的功能分析:针对差异tsRNA的预测靶基因进行GO分析,并列出前10位的功能富集类别,详见表1。可见上调的差异tsRNA所调控的靶基因主要干预类黄酮代谢、细胞葡萄糖醛酸化、葡萄糖醛酸代谢、糖醛酸代谢等生物学过程。而下调的差异tsRNA所调控的靶基因主要影响肝细胞的代谢功能,如细胞对固醇耗竭的反应、岩藻糖基化等。
讨 论
tsRNA作为新兴的非编码RNA,其异常表达已在多种疾病中得到证实,并通过调节生物过程和基因表达发挥重要作用[8]。本研究通过测序,发现ERS能够导致5.2%的肝细胞tsRNA显著上调,而14.5% tsRNA显著下调。在高度差异表达(倍数变化>3)的tsRNA中,上调和下调tsRNA的数量分别为 2条和11条,提示ERS主要抑制肝细胞tsRNA的表达。业已证实,tsRNA具有与miRNA相似的功能,可能与特定靶基因的mRNA结合并使其直接降解或抑制其转录后翻译,提示tsRNA可通过类miRNA样作用调控下游靶基因,进而发挥生物学功能[9]。

表1 肝细胞ERS相关差异tsRNA靶基因的GO功能分析
笔者联合使用基于TargetScan和miRanda的预测工具来预测ERS相关差异tsRNA的靶基因。结果发现,上调tsRNA的靶基因显著富集于抗坏血酸和藻酸盐代谢、淀粉和蔗糖代谢、戊糖和葡萄糖醛酸酯相互转化等碳水化合物代谢途径。目前研究表明,酒精性脂肪性肝病可导致淀粉和蔗糖代谢、戊糖和葡萄糖醛酸酯相互转化等糖代谢通路发生显著改变[10]。Zhong等[6]研究发现,以Gly-tRF为代表的tsRNA参与了补体C3激活所致的肝脂肪变性。因此,笔者推测肝细胞在ERS条件下可通过上调tsRNA表达,抑制糖代谢相关基因的表达。
此外,下调tsRNA的靶基因显著富集于Rap1及Ras信号通路,表明ERS诱导的tsRNA下调可能增强Rap1及Ras信号通路活性。Rap1是Ras超家族的一个小G蛋白,参与细胞黏附和运动、细胞增殖、血管生成和细胞骨架重塑等多种生理过程[11]。在Ras信号通路中,Ras参与细胞增殖、分化和细胞周期等细胞过程的调控[12]。两者可能通过影响细胞骨架,参与上皮间质转换(epithelial-to-mesenchymal transition,EMT)[13]。EMT则与细胞代谢重编程密切相关,可能导致糖酵解增强,脂肪生成增强和分解下降,从而系统影响肝细胞的代谢表型[14,15]。
在GO功能分析中,笔者发现上调的tsRNA靶基因主要涉及类黄酮代谢过程、葡萄糖醛酸代谢过程及糖醛酸代谢过程。多种类黄酮均具有对抗细胞氧化应激和调节脂质代谢的作用。Zheng等[16]研究发现,黄芩苷可通过抑制ERS和TXNIP/NLRP3炎性体的激活,保护AML12细胞免于PA诱导的脂毒性损伤。结合笔者的研究结果,提示tsRNA表达上调可能通过抑制类黄酮代谢功能加剧ERS介导的细胞损伤。另外,糖醛酸途径的中间产物——尿苷二磷酸葡糖醛酸是重要的解毒物质,并在肝内生物转化过程参与多种结合反应。上调的tsRNA可能抑制葡萄糖醛酸代谢及糖醛酸代谢等肝脏生物转化过程,影响肝脏解毒功能,从而导致肝细胞受损。
在下调tsRNA的靶基因功能分析中,笔者发现靶基因主要涉及岩藻糖基化过程。岩藻糖基化是肝病中最常见的聚糖改变之一,有研究证实IgG的岩藻糖基化水平与NAFLD呈正相关,并且岩藻糖基化与细胞EMT过程密切相关[17,18]。这些研究结果提示,ERS介导的tsRNA下调可能通过促进细胞岩藻糖基化过程参与NAFLD的发生、发展。
综上所述,脂肪酸刺激诱导的ERS可显著改变肝细胞tsRNA表达谱。差异表达的tsRNA通过调控与碳水化合物代谢、EMT相关的信号通路,可能影响肝细胞的糖代谢、氧化应激和生物转化等功能。这些发现提出了一种肝细胞ERS参与NAFLD的新型病理生理机制,有望为NAFLD的诊断和治疗提供全新思路。但tsRNA的确切作用仍有待更深入的体内外研究加以阐释。
