一株分离自水稻种子的真菌的鉴定及系统进化分析
2021-02-03李云飞华陈意宗凯孙娟娟盛旋余晓峰王满满陈雨姚剑
李云飞 华陈意 宗凯 孙娟娟 盛旋 余晓峰 王满满 陈雨 姚剑
摘要:真菌病害是制约水稻高产稳产的重要障碍因素之一。为了研究水稻种子中真菌发生情况,对分离自水稻种子中的一株真菌进行系统发育分析及功能评价。在形态学鉴定基础上,以通用引物ITS1/ ITS4对目标真菌序列进行PCR扩增、序列对比分析、邻接法(NJ)构建系统发育树。通过菌落培养特征、孢子形态特征观察,分离菌株S-51的形态特征与文献中雪霉叶枯病菌(Microdochium nivale)的描述极为相似;序列比对结果表明,目标真菌与雪霉叶枯病菌(M. nivale)相近,相似率为100%;系统发育树显示,其与雪霉叶枯病菌株在同一条分支上,雪霉叶枯病菌M. nivale和M. musae的亲缘关系最近。利用ITS片段开展的序列分析和系统进化树构建,结合形态特征,能够确定分离自水稻种子中的S-51菌株为雪霉叶枯病菌(M. nivale)。
关键词:水稻种子;雪霉叶枯病菌;ITS;分类地位;物种鉴定
中图分类号:S412文献标志码:A论文编号:cjas20190500034
A Fungus from Rice: Species Identification and Phylogenetic Analysis Li Yunfei1, Hua Chenyi1, Zong Kai1, Sun Juanjuan1, Sheng Xuan1, Yu Xiaofeng1, Wang Manman1, Chen Yu2, Yao Jian1
(1Technical Center of Hefei Customs, Hefei 230022, Anhui, China; 2Institute of Plant Protection and Agro-Products Safety, Anhui Academy of Agricultural Sciences, Hefei 230031, Anhui, China)
Abstract: Fungal disease is one of the important obstacles for high and stable yield of rice. In order to study the occurrence of fungi in rice seeds, the phylogenetic analysis and functional evaluation of a fungus isolated from rice seeds were carried out. On the basis of morphological identification, the target fungal sequence was amplified by PCR with ITS1/ITS4, and the phylogenetic tree was constructed by neighbor-joining (NJ) and analyzing the sequence. The morphological characteristics of strain S- 51 were very similar to those of Microdochium nivale in the literature, and the sequence alignment showed that the target fungi were similar to M. nivale, and the similarity rate was 100%. M. nivale and M. musae had the closest genetic relationship on the same branch as the strain of snow mold leaf blight. Sequence analysis and phylogenetic tree construction based on ITS fragments and combined with morphological characteristics could identify S-51 strain isolated from rice seeds as M. nivale.
Keywords: Rice Seed; Microdochium nivale; ITS; Taxonomic Status; Species Identification
0引言
水稻屬于禾本科(Gramineae)稻属(Oyrzae),广泛分布于热带和亚热带地区。水稻是世界上最重要的粮食作物之一,世界一半以上的人口以稻米为主要粮食来源[1]。据统计,全世界有122个国家种植水稻,栽培面积在1.40亿~1.57亿hm2。中国水稻的种植面积约占全国耕地面积的1/4,年产量约占全国粮食总产量的一半。在水稻生产过程中,病害问题是制约水稻高产稳产的重要障碍因素之一,全世界水稻病害种类近百种,其中真菌病约50种[2-3]。水稻病害发生后防治与否,对产量损失影响极大,水稻病害经综合防治后可挽回损失80%以上。不同病害的流行规律各不相同,防治方法亦不一样,因此病原物的准确分类鉴定显得尤为重要。
形态学分类法,是基于细胞形态、大小、菌落形态、培养基上的生长状态等指标进行分类鉴定的一种方法[4],各种生物的分类鉴定都是以形态特征为基础发展起来的[5]。宋镇庆等[6]根据形态特征对辽宁地区引起水稻苗绵腐病的真菌进行了分类鉴定。代丽婷[7]根据病菌形态特征对黑龙江省9个地区的冬小麦分离真菌进行了鉴定。贾菊生等[8]对分离于棉花、茄和苍耳的6个菌株进行了形态学鉴定,确定其为大丽轮枝菌。但真菌形态特征复杂、种类繁多,缺乏统一标准的描述,主观性较强,且形态特征指标易受多种因素的影响而不稳定[9-10]。另外,真菌形态学研究不能应用于人工培养的真菌中[11]。因此,形态学分类法只有结合分子生物学方法才能使分类鉴定效果更佳。胡渤洋等[12]对分离自杨柳科杨属毛白杨的BUA-01菌株子实体形态特征进行了鉴定,同时基于ITS的系统发育树对该菌株进行了分析,最终结合形态特征和ITS鉴定,确定BUA-01菌株为毛栓菌(Trametes hirsute)。张铉哲等[13]从东北三省采集的26份水稻等谷物类样品中分离获得254株病原真菌,通过形态学方法鉴定,包括6种属的病原菌,以分子生物学手段继续进行了鉴定,保证了鉴定结果的准确性,分离获得的病原菌分别为镰孢菌属、平脐蠕孢属、根霉属、曲霉属、链格孢菌属和枝孢属。陈洪亮等[14]从大田感病水稻叶片上分离了病原真菌,随后对病原菌的形态特征和分子生物学特征分别进行了研究,明确了该病原菌的分类地位,确定其为稻平脐蠕孢(Bipolaris oryzae)。
本研究先用传统形态学方法对分离菌株进行分类研究,再对ITS基因进行扩增和序列测定,利用邻接法neighbor-joining (NJ)进行系统发育树的构建,建立了目标真菌的鉴定体系。将形态学鉴定和分子生物学鉴定相结合,对其分类地位进行确定。随着现代分子生物学技术手段的不断改进和创新,越来越多的学者重视真菌的分类研究,能够解决真菌属、种间系统发育关系问题,也能为指导田间防治提供可靠依据。
1材料与方法
1.1材料
1.1.1供试菌株供试菌株S-51为本实验室自水稻种子中分离纯化获得。
1.1.2试剂耗材引物由南京金斯瑞生物科技有限公司合成;2×PCR Taq Master Mix,购自天根生化科技(北京)有限公司;马铃薯葡萄糖琼脂培养基(PDA),购自青岛海博生物技术有限公司。
1.2实验方法
1.2.1菌株的分离取50 g水稻种子置于无菌水中室温浸泡处理1天,转入-20℃下冷冻处理1天,1%次氯酸钠消毒60 s,无菌水洗涤3次后,用灭菌滤纸吸干水分按10粒/皿置于PDA培养基上,在25~28℃,12 h黑暗/ 12 h光照(12 h光暗交替)条件下培养,第3天开始观察,根据种子周围新生菌落的形态和颜色进行分离。病原菌纯化采用单孢子分离法[15]。
1.2.2培养性状和形态学观察观察培养基上菌落的颜色、形态和大小等,采用十字交叉法测量菌落直径。插片法取样[16],染色后光学显微镜下观察菌丝、分生孢子等。另,保存菌株于CTAB缓冲液的Eppendorf管中用于DNA提取。
1.2.3分子生物学鉴定CTAB法提取菌株总DNA,使用真菌通用引物(ITS1/ITS4)进行PCR扩增。PCR扩增引物为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。PCR反应体系50μL:模板2μL,2×PCR Taq Master Mix 25μL,10μmol/L正向引物和反向引物各1μL,灭菌双蒸水补足至50μL。PCR反应程序:94℃5 min;94℃45 s,55℃45 s,72℃1 min,35个循环;72℃7 min。PCR扩增产物进行DNA纯化、测序,由南京金斯瑞生物科技有限公司完成。
1.2.4系统发育树的建立将测得的ITS序列在GenBank中进行Blast比对分析,比对和查找亲源关系较近菌株的基因序列,并下载。使用MEGA7软件构建系统发育树,从而确定菌株的分类地位[17]。
2结果与分析
2.1形态学特征
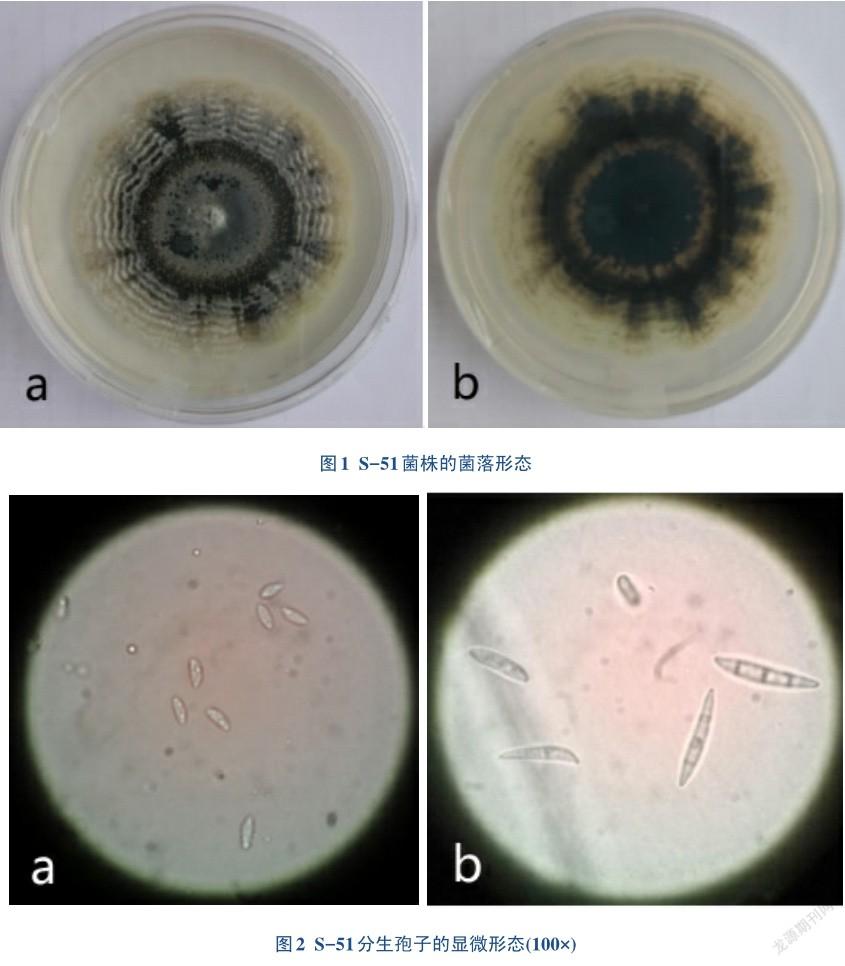
在PDA培养基上,初生菌落白色、后期菌落中间褐色,初生菌落背面淡黄色,气生菌丝稀疏,呈薄绒状,菌落生长速度略慢,培养7天的菌落直径为4.5 cm,平均6.4 mm/d。菌落边缘整齐,形成同心环,在每天光照12 h的条件下培养,菌落上最终形成颜色深浅程度不同的同心环,从内到外颜色逐渐变浅(图1)。培养7天开始产生分生孢子,可产生橙色孢子团。显微镜下观察小型分生孢子长椭圆,无色;大型分生孢子新月形,两端钝圆,无色,以1个和3个隔膜居多。产孢细胞瓶形或倒梨形,顶端较细(图2)。分离菌株S-51的形态特征与文献中[7,18-19]雪霉叶枯病菌(Microdochium nivale)的描述极为相似。
2.2基因序列分析结果
应用ITS通用引物進行PCR扩增,S-51菌株获得了500 bp左右的清晰条带,电泳结果见图3,将纯化的PCR产物直接测序,获得了506 bp的序列。
2.3系统进化树构建

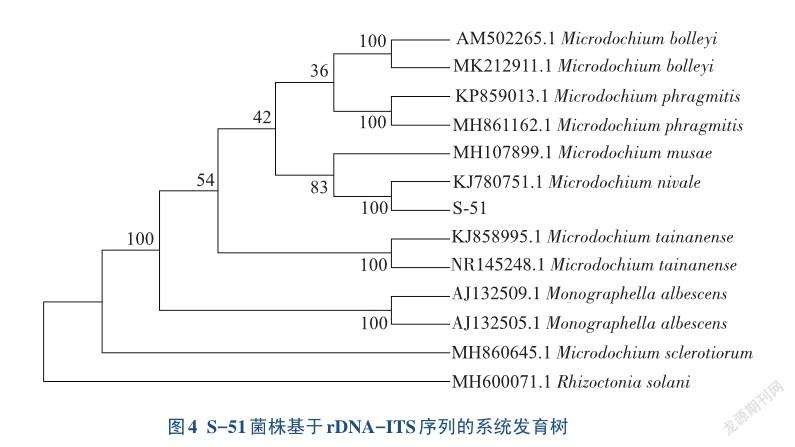
将测序所得的ITS序列(506 bp),通过NCBI上GenBank数据库进行序列比对,比对发现菌株S-51序列与NCBI上Query coverage值超过95%、Max idenl值超过97%的序列比对结果中,除了雪霉叶枯病菌(M. nivale)外其他的结果均为Microdochium sp.信息。下载亲源关系较近或同属菌株的基因序列及其相关信息,使用Mega7中的邻接法(NJ)构建系统发育树。选取了11个与本试验菌株相似性较高或关系较近的ITS区段序列,进行系统进化树的构建,外类群(Outgroup)使用引起水稻纹枯病的立枯丝核菌(Rhizoctonia solani)。从进化树(图4)上可以看出,本研究菌株S-51与Genbank编号为KJ780751.1的雪霉叶枯病菌(M. nivale)单独聚为1枝,两者的亲缘关系非常近,支持率达100%,与外类群相距较远。结果表明,S-51菌株与雪霉叶枯病菌(KJ780751.1)相似度极高,雪霉叶枯病菌M. nivale和M. musae的亲缘关系最近。
3讨论与结论
关于雪霉叶枯病菌开展的相关研究中,其寄主均为小麦[7,18-19],仅Broggi等[25]于1997—1998年之间在阿根廷恩特雷里奥斯省稻米主产区进行了一次真菌学调查,发现M. nivale为Microdochium属在水稻种子中的优势种,其他关于水稻中分离到该菌的相关报道很少。本研究对一株水稻种子中分离的真菌进行鉴定,确定其为雪霉叶枯病菌(M. nivale)。
由于某些真菌的属或种在形态学特征方面差异极不明显,给传统的分类鉴定方法增加了难度,从分子水平来分析真菌的遗传结构已成为传统分离鉴定的有效补充[20]。ITS区受到的选择压力较小,进化速率较快,在绝大多数真核生物中表现出了极为广泛的序列多态性[21- 23],可广泛用于种间、种内群体间的系统学研究[24]。笔者利用真菌通用引物ITS1和ITS4扩增了分离所获菌株的部分rDNA-ITS序列,长度为506 bp,包括18S rDNA部分序列、ITS1-5.8S-ITS2全序列和28S rDNA部分序列。利用这个片段开展的序列分析和系统进化树构建,结合形态特征,能够确定分离自水稻种子中的S-51菌株为雪霉叶枯病菌(M. nivale)。
研究中未见该菌在水稻上的危害症状,其是否能引起田间水稻发病,有待今后进一步调查研究。鉴于水稻种植目前在中国的重要地位,积极研究其潜在病害的发生情况,对预防病害的发生有着重要意义,也为生产中防控该病害提供了理论依据。
参考文献
[1]刘海,赵欢,何桂芳,等.稻米营养品质影响因素研究进展[J].贵州农业科学,2013,41(6):85-89.
[2]程式华,李建.现代中国水稻[M].北京:金盾出版社,2007.
[3]侯明生,黄俊斌.农业植物病理学[M].北京:科学出版社,2011.
[4]郝芳,周国英,李河.经济林植物病原真菌分类鉴定方法研究进展[J].经济林研究,2009,27(1):112-116.
[5]朱研研,王耀耀,付美红,等.真菌分类鉴定研究进展[J].河北化工, 2010,33(4):37-39.
[6]宋镇庆,张际中.辽宁省水稻棉腐病菌的分类调查研究[J].沈阳农学院学报,1983,1:69-80.
[7]代丽婷.黑龙江省冬小麦雪腐病的病原鉴定及其综合防治[D].哈尔滨:东北农业大学,2013.
[8]贾菊生,郭辉.新疆几株黄萎轮枝菌株的形态鉴定与生物学特征比较研究[J].新疆农业大学学报,2006,29(3):73-77.
[9]仇萌,邹先彪.rDNA-ITS序列鉴定深部真菌菌种的研究进展[J].中国真菌学杂志,2011,6(2):122-125.
[10]朱洪庆,王盼盼,张萌,等.rDNA-ITS序列分析法与传统分类法相结合在真菌鉴定中的应用[J].西华师范大学学报:自然科学版, 2016,37(3):264-269.
[11]缪承杜,洪葵.真菌分类技术的研究进展[J].安徽农业科学,2007, 35(22):6695-6697,6700.
[12]胡渤洋,王寿南,陈青君,等.一种白腐真菌的分离、鉴定、培养及产漆酶條件[J].应用与环境生物学报,2018,24(2):367-373.
[13]张铉哲,李微,郝璐,等.东北三省禾谷类作物真菌分离鉴定及污染率调查[J].东北农业科学,2016,41(1):68-72.
[14]陈洪亮,彭陈,王俊伟,等.水稻胡麻叶斑病病原菌的分离及鉴定[J].西北农林科技大学学报,2012,40(8):83-88.
[15]张书建,何月秋.介绍一种简单的真菌单孢子分离法[J].云南农业大学学报,2003,18(3):315-316.
[16]李平兰,贺稚非.食品微生物学实验原理与技术[M].北京:中国农业出版社,2005:50-52.
[17]杨韧,张好强,唐明.陕北地区油松根际真菌资源初步调查及其与土壤理化性质的关系[J].西北林学院学报,2016,31(5):203-210.
[18]王翠玲,杨雪莲,席永士,等.小麦雪霉叶枯病病原菌分离鉴定与发病规律初探[J].西藏科技,2002,113(9):7-8.
[19]牛永春,商鸿生,王树权,等.中国小麦雪霉叶枯病菌种的鉴定[J].真菌学报,1992,11(1):43-48.
[20]Broggi L E, MoltóG A. Fungi associated with rice at entre rios province, Argentina. toxigenic capacity of fusarium graminearum and Microdochium nivale isolates[J].Mycotoxin Research,2001,17(2):96-107.
[21]曹永军,程萍,喻国辉,等.利用ITS1和ITS4通用引物扩增香蕉枯萎病菌核酸片段鉴定其生理小种[J].热带作物学报,2010,31(7): 1098-1102.
[22]Brunstd G. Community structure of ectomycorrhizal fungi in a Pinus muricata forest:above-and below-ground views[J].Canadian Journal of Botany,1996,74(10):1572-1583.
[23]Smith E, Veenman C, Baar J. Molecular analysis of ectomycorrhizal basidiomycete communities in a Pinus sylvestris L. stand reveals long- term increased diversity after removal of litter and humus layers[J].Fems Microbiology Ecology,2003,45(1):49-57.
[24]HortonTR,BrunsTD.Themolecularrevolutionin ectomycorrhizal ecology: peeking into the black-box[J].Molecular Ecology,2001,10(8):1855-1871.
[25]陈剑山,郑服丛,张欣,等.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007,35(13):3785-3786,3792.
