不同品种及产地木耳中多糖含量比较研究
2021-02-03李振陈结梅刘贤钊谭丽容孙红梅
李振 陈结梅 刘贤钊 谭丽容 孙红梅
摘要:建立木耳多糖新的测定方法,比较不同品种及产地木耳多糖含量的差异,为木耳的质量评价提供依据。采用蒽酮-硫酸法分别测定黑木耳、毛木耳不同产地的多糖含量,并进行方法学考察。葡聚糖在3.27~23.61μg/mL范围内,其浓度与对应的吸光度呈良好的线性关系(R2=0.9993),平均回收率为101.2%,RSD为3.5%(n=9)。浙江江山、辽宁本溪、福建漳州产黑木耳中多糖含量分别为4.1%、3.0%和3.5%;浙江江山和江苏徐州产毛木耳中多糖含量分别为4.1%和3.6%。蒽酮-硫酸法简便可行、重复性好,适用于木耳中多糖含量的测定。不同产地的黑木耳多糖含量有一定的差异,不同产地的毛木耳多糖含量差异不明显,同产地或地域位置相近的不同产地黑木耳与毛木耳品种间的多糖含量无明显差异。
关键词:黑木耳;毛木耳;多糖;蒽酮-硫酸法;产地
中图分类号:S184文献标志码:A论文编号:cjas2020-0155
Auricularia of Different Varieties and Habitats: A Comparative Study on the Polysaccharides Content
Li Zhen1, Chen Jiemei1, Liu Xianzhao1, Tan Lirong2, Sun Hongmei1
(1Infinitus (China) Co., Ltd., Jiangmen 529100, Guangdong, China; 2Hongzhengdao (China) Traditional Chinese Medicine Research Company Ltd., Guangzhou 510665, Guangdong, China)
Abstract: The paper aims to establish a method for the determination of polysaccharides in Auricularia and compare the polysaccharide content of Auricularia in different varieties and regions. Anthrone-sulfuric acid method was used to determine the content of polysaccharides in Auricularia auricula and Auricularia polytricha from different habitats, and the methodological investigation was conducted. The results showed that: the concentration of dextran had a good linear relationship with its absorbance in the range of 3.27-23.61μg/mL(R2=0.9993), with an average recovery rate of 101.2% and RSD of 3.5% (n=9). The polysaccharides content of A. auricula from Jiangshan, Benxi and Zhangzhou was 4.1%, 3.0% and 3.5%, respectively; the polysaccharides content of A. polytricha from Jiangshan and Xuzhou was 4.1% and 3.6%, respectively. The method is suitable for the determination of polysaccharides in Auricularia. There was certain difference in the polysaccharides content of A. auricula from different habitats, but not for the A. polytricha. The overall difference in the polysaccharides content between the two varieties was not obvious.
Keywords: Auricularia auricular; Auricularia polytricha; Polysaccharides; Anthrone-sulfuric Acid Method; Region
0引言
木耳(Auricularia)屬担子菌纲木耳目木耳科,是一种主产于中国的大型食用真菌,营养价值丰富[1],有“素中之荤”的美誉。木耳的种类多样,常见的有黑木耳(Auriculariaauricula)和毛木耳(Auricularia polytricha),也是目前在黑龙江、辽宁、吉林、福建、江苏、浙江、湖北、四川、云南、广西等地广泛栽培种类[2-3]。木耳多糖是木耳子实体的重要活性物质,具有抗氧化[4-5]、抗辐射[6]、抗病毒[7]、抗肿瘤[8-9]、降血糖[10-11]、降血脂[12-13]、增强机体免疫[14]等多种有益于人体健康的功能作用。作为原料,木耳已被应用于功能食品、保健品及药品等领域。
目前,行业内尚未制定木耳多糖含量检测方法的国家标准,国内大多数食用菌企业采用农业标准《食用菌中粗多糖含量的测定(NY/T 1676—2008)》,即苯酚-硫酸法对食用菌多糖进行检测质控[15],文献报道的木耳多糖含量测定方法也主要为苯酚-硫酸法[16-17]。但苯酚-硫酸法使用的苯酚有一定的毒性,不利于检测操作的安全。而蒽酮-硫酸法是多糖含量测定的常用方法,此法不仅简便、快速、灵敏,而且重现性好[18]。另外,关于不同产地、不同品种间木耳多糖含量比较的研究尚未见文献报道。本研究采用蒽酮-硫酸法测定木耳中多糖含量,并比较不同产地木耳多糖的含量差异,以期为木耳的质量控制、企业原料采购及相关食品研发利用等提供理论依据。
1材料與方法
1.1仪器与试剂
Evolution 300紫外可见分光光度计(ThermoFisher公司);MS204S 1/10000电子天平(瑞士Mettler公司);ST16R离心机(Thermo Fisher公司);WBK-4B水浴锅(HKM公司);涡旋振荡器(ThermoFisher公司);葡聚糖标准品(分子量4万,Sigma);无水葡萄糖标准品(中国食品药品检定研究院);浓硫酸(分析纯,广州化学试剂厂);无水乙醇(分析纯,广州化学试剂厂);蒽酮(分析纯,国药集团化学试剂有限公司)。
1.2材料
供试黑木耳(浙江江山、福建漳州、辽宁本溪3个产地)、毛木耳(江苏徐州、浙江江山2个产地)购于天方健(中国)药业有限公司,均为干制品。
1.3实验方法
1.3.1多糖样品的制备取木耳适量,粉碎过40目筛,取粉末0.5 g,精密称定,置于500 mL锥形瓶中。加200 mL蒸馏水于100℃水浴浸提2 h,提取2次。浸提完后,冷却至室温,置50 mL离心管中进行离心(5000 r/min,10 min),上清液用快速滤纸进行抽滤。合并上述滤液置蒸发皿中,于100℃水浴中蒸至约30 mL,转移到100 mL容量瓶中,并用少量热水多次润洗蒸发皿,合并洗液置上述容量瓶中,定容,摇匀,备用。精密量取上述溶液2 mL,置50 mL离心管中,加入8 mL无水乙醇,离心(5000 r/min,10 min),倾去上清液,沉淀用10 mL无水乙醇洗涤1次,振摇、离心。沸水浴中蒸至无醇味,用蒸馏水定容于10 mL容量瓶中,摇匀,即为供试液。
1.3.2标准曲线的绘制精密量取0.1 mg/mL葡聚糖标准溶液0.0、0.2、0.4、0.6、0.8、1.0 mL,置于10 mL具塞试管中,并用蒸馏水补充至1.0 mL,将试管放入冷水浴中,分别加入蒽酮试剂4.0 mL(称取50 mg蒽酮,用100 mL浓硫酸溶解),摇匀。置沸水浴中加热15 min,冷却至室温。以空白作对照,在620 nm波长处测定吸收度。以吸收度为横坐标,浓度为纵坐标,绘制标准曲线。
1.3.3多糖的测定精密量取样品供试液1 mL,置于10 mL具塞试管中,照标准曲线的绘制项下操作,测定吸光度,计算样品多糖含量。
1.3.4不同醇沉浓度影响的考察称取3份相同产地的黑木耳样品,按1.3.1项中方法提取多糖,分别用90%、80%、70%浓度的乙醇进行醇沉,考察不同醇沉浓度对多糖检测的影响。
1.3.5不同对照品影响的考察称取3份相同产地的黑木耳样品,按1.3.1项中方法提取多糖,分别用葡聚糖和葡萄糖绘制标准曲线,考察不同对照品对多糖检测的影响。
2结果与分析
2.1醇沉浓度的确定
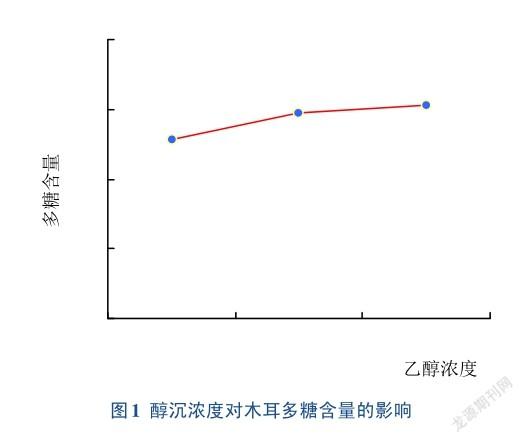
多项研究表明,多糖沉淀使用的乙醇浓度对沉淀的效果(包括多糖得率、分子组成、表观粘度等)有重要的影响[19-22],浓度过低(沉淀不完全)或者过高(易产生浆状,不易操作)都不利于多糖的纯化[23]。因此,选择合适的醇沉浓度对保证多糖测定的准确性尤为重要。醇沉浓度对木耳多糖含量影响见图1。随着醇沉浓度的增加,样品多糖含量略呈上升趋势,但差异不显著(RSD=1.5%),为便于实验操作和经济性,选用80%的醇沉浓度作为实验条件。
2.2对照品的确定
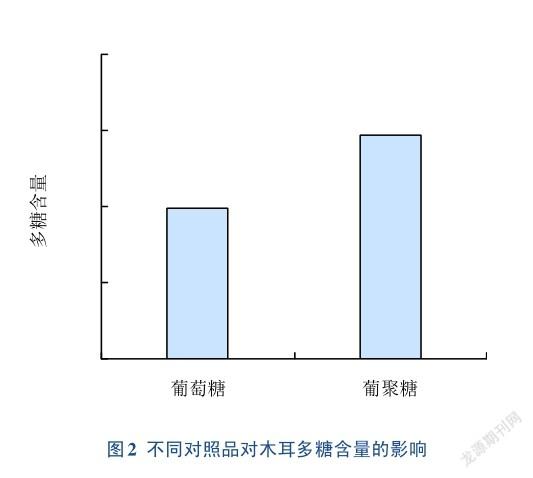
研究表明,不同对照品对多糖含量测定有一定的影响[24]。本研究选用葡萄糖和葡聚糖2种对照品进行考察,结果见图2。与葡萄糖相比,采用葡聚糖绘制标准曲线测得木耳样品中多糖含量较高,差异明显(RSD=2.9%),因此本方法确定对照品为葡聚糖。
2.3方法学考察
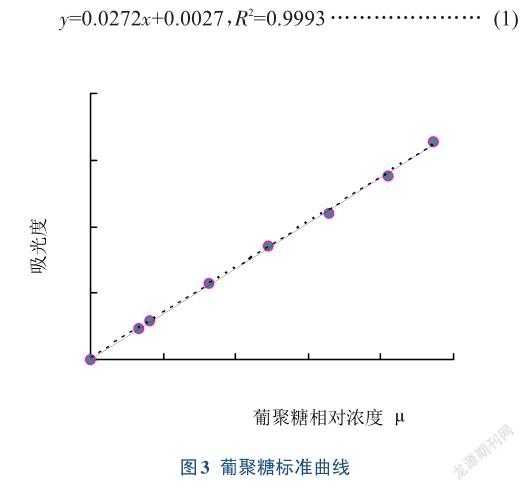
2.3.1线性实验葡聚糖标准曲线见图3,可知葡聚糖在3.27~23.61μg/mL范围内,其浓度与对应的吸光度呈良好的线性关系。其回归方程见公式(1)。
2.3.2回收率实验取同产地黑木耳样品适量,粉碎过40目筛,取粉末0.25 g,按1.3.1项制备供试品,分别在醇沉后定容前加入相当于样品含量50%、100%、150%的葡聚糖对照品各3份(加标葡聚糖浓度为0.1023 mg/mL,加标体积分别为1.5、3.0、4.5 mL),按照1.3.2和1.3.3项完成测定。由表1可见,加标样品的回收率为101.2%,表明方法准确性良好。
2.3.3精密度实验取同一批黑木耳样品,按1.3项下方法平行制备并测定6份平行样中的多糖含量,结果6份样品多糖含量平均值为8.2%,RSD=1.5%,表明方法精密性良好。
2.3.4稳定性实验取同一批黑木耳样品,按1.3项下方法制备供试品,记录其在显色反应后3 h内的吸光度,每0.5 h测定1次,连续测定6次,结果测得的吸光度平均值为0.381,RSD=0.6%,表明蒽酮-硫酸显色后,样品溶液在3 h内基本稳定。
2.4不同品种、产地木耳的多糖含量测定
制备不同品种、产地木耳的供试品溶液,于620 nm波长处测定吸光度,每个产地测定10个批次,每批次平行处理2份,计算多糖的含量,并进行统计学分析,结果见表2。不同产地黑木耳中多糖含量存在显著差异(P<0.01),其中浙江江山产的黑木耳中多糖含量最高,为4.1%。浙江江山产的毛木耳中多糖含量整体较江苏徐州产的含量稍高,但差异无统计学意义(P> 0.05),即不同产地毛木耳中多糖含量差异不明显。除辽宁本溪产地的黑木耳中多糖显著低于其他2个产地的毛木耳外(P<0.01),同产地或地域位置相近的不同产地木耳2个品种间的多糖含量水平相当,无显著差异(P>0.05)。
3結论
本研究采用蒽酮-硫酸法测定木耳多糖,结果表明该方法结果准确、重现性好,可用于木耳多糖的质量控制。不同产地的黑木耳多糖含量有一定的差异,在选取的3个黑木耳产地中,以浙江江山产的黑木耳多糖含量最高,为4.1%。不同产地的毛木耳多糖含量差异不明显,同产地黑木耳和毛木耳2个品种间的多糖含量水平相当。辽宁本溪产的黑木耳中多糖含量显著低于其他南方产地木耳中多糖含量,这可能是木耳生长受到温度、湿度、光照等生长环境因素南北差异比较大导致的。
4讨论
多糖常用的测定方法目前主要有苯酚-硫酸法、蒽酮-硫酸法、DNS法及高锰酸钾法,每种方法都有各自优缺点。蒽酮-硫酸法的原理是糖在浓硫酸作用下,经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮试剂反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量呈正比,从而可进行糖的定量。该法的特点是几乎可以测定所有的碳水化合物,故木耳在提取时要注意将提取液离心和过滤干净,以免滤渣中纤维素、淀粉等糖类物质与蒽酮试剂发生反应从而增加了测定误差。另外,不同的糖类与蒽酮试剂的显色深度会有不同,从而影响测定的结果,笔者考察了葡萄糖和葡聚糖2个对照品在测定结果上的差异性,结果发现用葡聚糖测定的结果较高,这可能与黑木耳多糖的单糖组成主要为甘露糖和鼠李糖而非葡萄糖有关[25]。
李承范[26]用蒽酮-硫酸法测定了木耳中多糖的含量,其结果为3.48%,与本实验结果接近。但与之相比,本实验多糖前处理方法更为简便。杜娟等[17]用苯酚-硫酸法测定了黑木耳中多糖的含量,其结果为3.50%,也与本实验结果接近。本研究在预实验中也考察了苯酚-硫酸法,发现与蒽酮-硫酸法测定的结果接近,差异不明显。周勇等[27]以香菇为研究对象,比较了苯酚-硫酸法和蒽酮-硫酸法在香菇多糖含量测定上的差异。结果发现香菇中多糖采用苯酚-硫酸法、蒽酮-硫酸法测定结果接近,2种方法的线性关系、重复性、精密度、稳定性均较好。这说明苯酚-硫酸和蒽酮-硫酸2种方法在测定某些特定多糖上同样适用,虽然苯酚-硫酸法在多糖含量测定上目前较为常用,但考虑到苯酚的毒性,不利于检测操作的安全,用蒽酮-硫酸法测定木耳多糖含量不失为一种合适的选择。
参考文献
[1]冯小飞,陈玉惠,赵宁,等.不同产地黑木耳水溶性多糖与蛋白质含量测定比较[J].食用菌,2016(4):57-58.
[2]吕文英.黑木耳和毛木耳中无机营养元素含量的测定与研究[J].微量元素与健康研究,2007,24(4):30-31.
[3]李睿瑞,唐金敏,赵行建,等.黑木耳中水溶性多糖提取条件的研究[J].安徽农学通报,2018,24(11):9-10.
[4]Yoona S J, Yub M A, Pyunb Y R, et al. The nontoxic mushroom Auricularia auricular contains polysaccharide with anticoagulant activity mediated by antithrombin[J]. Thrombosis Research,2003, 112(3):151-158.
[5]Zeng W C, Zhang Z, Gao H, et al. Characterization of antioxidant polysaccharides from Auricularia auricular using microwave -assisted extraction[J]. Carbohydrate Polymers,2012,89(2):694-700.
[6]Chen Z Q, Wang J H, Fan Z L, et al. Effects of polysaccharide from the fruiting bodies of Auricularia auricular on glucose metabolism in60Co-γ- radiated mice[J]. International Journal of Biological Macromolecules,2019,135:887-897.
[7]Nguyen T L, Chen J, Hu Y L, et al. In vitro antiviral activity of sulfated Auricularia auricula polysaccharides [J]. Carbohydrate Polymers,2012,90(3):1254-1258.
[8]Reza M A, Hossain M A, Lee S J, et al. Dichlormethane extract of the jelly ear mushroom Auricularia auricular Judae (higher Basidiomycetes) inhibits tumor cell growth in vitro[J]. International Journal of Medicinal Mushrooms,2014,16(1):37-47.
[9]Song G L, Du Q Z. Structure characterization and antitumor activity of anαβ-glucan polysaccharide from Auricularia polytricha[J]. Food Research International,2012,45(1):381-387.
[10]Lu A X, Yu M G, Shen M, et al. Preparation of the Auricularia auricularpolysaccharidessimulatedhydrolysatesandtheir hypoglycaemiceffect[J].InternationalJournalofBiological Macromolecules,2018,106:1139-1145.
[11]Yang B K, Ha J Y, Jeong S C, et al. Hypolipidemic effect of an exobiopolymerproducedfromsubmergedmycelialcultureof Auricularia polytricha in rats[J]. Biotechnology Letters,2002,24(16): 1319-1325.
[12]Ma J W, Qiao Z Y, Xiang X. Optimisation of extraction procedure for black fungus polysaccharides and effect of the polysaccharides on blood lipid and myocardium antioxidant enzymes activities[J]. Carbohydrate Polymers,2011,84(3):1061-1068.
[13]Zhao S, Rong C, Liu Y, et al. Extraction of a soluble polysaccharide fromAuriculariapolytrichaandevaluationofitsantihypercholesterolemic effect in rats[J]. Carbohydrate Polymers,2015, 122:39-45.
[14]Nguyen T L, Wang D, Hu Y, et al. Immuno-enhancing activity of sulfated Auricularia auriculapolysaccharides[J]. Carbohydrate Polymers,2012,89(4):1117-1122.
[15]杨伟君,马诗经,焦春伟,等.灵芝孢子粉多糖含量检测方法的优化[J].中国食用菌,2018,37(2):67-72.
[16]殷贝贝,赵爽,刘宇,等.市售不同品种木耳蛋白质和水溶性多糖含量的研究[J].北方园艺,2011(23):147-149.
[17]杜娟,时文静.香菇、金针菇、黑木耳多糖的提取与测定[J].江苏农业科学,2016,44(8):347-350.
[18]郭晓雷,朱思潮.硫酸蒽酮法与硫酸苯酚法测定灵芝多糖含量比较[J].中国中医药学刊,2010,28(9):2000-2002.
[19]颜梦秋,唐庆九,杨焱,等.醇沉条件和干燥方式对毛头鬼伞子实体多糖品质的影响[J].菌物研究,2014,12(4):221-225.
[20]耿安静,陈健.香菇精多糖乙醇沉淀规律的研究[J].食品科学, 2010,31(4):99-102.
[21]Xue B L, Wen J L, Xu F, et al. Structural characterization of hemicelluloses fractionated by graded ethanol precipitation from Pinus yunnanensis[J]. Carbohydrate Research,2012,352(9):159-165.
[22]Balto A S, Lapis T J, Silver R K, et al. On the use of differential solubility in aqueous ethanol solutions to narrow the DP range of food-grade starch hydrolysis products[J]. Food Chemistry,2016,197: 872-880.
[23]黃庆斌,郑志昌,陈竟豪,等.不同醇沉竹荪多糖组分对青春双歧杆菌体外增殖作用的影响[J].食品工业科技,2020(4):86.
[24]孙晓燕,蔡昌利,徐丽莉,等.多糖含量测定方法的比较[J].现代中药研究与实践,2015,29(3):58-62.
[25]庄伟,屈咪,赵迪,等.黑木耳多糖的结构组成及其免疫活性研究[J].食品科技,2020,45(2):205-210.
[26]李承范.7种常见食用菌中多糖的提取和测定[J].光谱实验室, 2012,29(2):996-999.
[27]周勇,易延逵,杨晓敏,等.香菇中多糖含量测定方法的比较研究[J].食品研究与开发,2016,37(13):124-128.
