HPLC测定真菌及其制品中麦角甾醇含量
2021-02-03王晓琴黄秀丽陈月景罗旋胡嘉珊翁嘉
王晓琴 黄秀丽 陈月景 罗旋 胡嘉珊 翁嘉
摘要:本研究旨在找出真菌及其制品的特征指标,用于其质量评价、掺伪鉴别等。建立了真菌及其制品中麦角甾醇含量测定的高效液相色谱法(HPLC),并利用建立的HPLC法对冬虫夏草、破壁灵芝孢子粉等真菌及其制品以及螺旋藻、大豆油等6种植物油样品进行麦角甾醇含量的测定。结果显示,麦角甾醇在5~160μg/mL范围内具有较好的线性,线性相关系数大于0.999,检出限为0.1μg/mL,平均回收率为86.32%~105.24%。螺旋藻以及大豆油等6种植物油中均未检出麦角甾醇,真菌类及其制品中均含有麦角甾醇,麦角甾醇具有专属性。该方法操作简便、灵敏,且具有较好的重复性和稳定性,可应用于真菌及其制品中麦角甾醇含量的定量分析。
关键词:真菌及其制品;麦角甾醇;专属性,高效液相色谱法(HPLC)
中图分类号:S567.3文献标志码:A论文编号:cjas20191000244
Determination of Ergosterol in Fungi and Its Products by HPLC
Wang Xiaoqin, Huang Xiuli, Chen Yuejing, Luo Xuan, Hu Jiashan, Weng Jia
(Huizhou Institute for Food and Drug Control, Huizhou 516000, Guangdong, China)
Abstract: The aim is to find out the characteristic indexes of fungi and its products for quality evaluation and adulteration identification. The HPLC method was established for determining ergosterol in fungi and its products. With the established HPLC method, the contents of ergosterol were determined in fungi and its products (Cordyceps sinensis and Ganoderma lucidum spores powder), spirulina and six kinds of plant oil, such as soybean oil. The results showed that there was a good linearity in the range of 5-160μg/mL of ergosterol, the correlation coefficient was more than 0.999, the detection limit was 0.1μg/mL, and the average recovery was from 86.32% to 105.24%. Ergosterol was not determined in spirulina and six kinds of plant oil (such as soybean oil), while it was detected in fungi and its products. Ergosterol had specificity in fungi and its products. This study suggests that the method is simple and sensitive, and has good repeatability and stability, thus it can be adopted to quantitatively analyze ergosterol in fungi and its products.
Keywords: Fungi and Its Products; Ergostero; Specificity; High Performance Liquid Chromatography (HPLC)
0引言
目前,真菌在保健方面的作用漸渐被大家所认识,如冬虫夏草、灵芝孢子系列等产品已经广为大家所接受,另外在筛选新药及寻找抗癌药物方面,食药用真菌也已作为重要的研究对象[1-3]。甾体类成分对真菌有着重要的生理功能,同时还具有多种生物学活性,因此研究真菌甾体类成分具有十分重要的理论意义和应用前景[4-6]。
麦角甾醇是大型真菌中普遍存在的甾体类化合物,也是真菌类的特征甾醇,主要存在于绝大多数的真菌细胞膜中[7],维系着真菌细胞的正常代谢[8],可以增强人体抵抗疾病的能力,是重要的脂溶性维生素D2源[9-11],具有明显的抑菌、抗肿瘤功效[12-13],其含量与真菌生物量存在相关性[14],可以通过检测麦角甾醇含量来测量真菌的生物量。
目前,真菌中麦角甾醇的含量研究已经有了一些成果,灵芝、灵芝孢子油,香菇,喇叭菌、美味牛肝菌、冬虫夏草等已有研究,不同真菌中麦角甾醇的提取方法主要有皂化回流[16]、超临界提取[17]、闪式提取[18]和超声辅助提取[19]等,对麦角甾醇的定性与定量分析研究主要报道的方法有UV法[20]、毛细管电泳法[21]、高效液相色谱法[22- 23]、液相色谱-质谱法[8,24]和气相色谱-质谱法[25-26]等,与其他方法相比,HPLC分析不需要进行衍生化,操作简单,结果可靠。关于真菌中多糖的研究开发较多,但是麦角甾醇作为食药用真菌所含有的一种重要资源还没有得到广泛开发利用,现有研究大多集中于单一种类真菌中麦角甾醇的研究,系统研究较少,同时也缺乏菌类麦角甾醇检测的国家标准,导致把关不严,市场上销售的真菌质量参差不齐,尤其掺假灵芝孢子油的乱象不断。因麦角甾醇在大部分植物中不含有或含量很小,其良好的特异性和稳定性使其可作为真菌的特征指标,建立麦角甾醇含量测定的方法,对于推动其在食药用真菌及其产品质量控制与评价中的应用具有重要作用。
本研究旨在提取真菌及其制品中的麦角甾醇,建立高效液相色谱(HPLC)测定方法,为食药用真菌的进一步研究和开发利用提供依据,同时为食药用真菌质量评价提供方法参考。
1材料与方法
1.1仪器
高效液相色谱仪(岛津LC-20A),旋转蒸发仪
(BUCHI Rotavaper R-210)。
1.2材料与试剂
麦角甾醇标准品为HPLC级,纯度≥98%,购于中检院。冬虫夏草,蛹虫草,赤灵芝子实体,紫芝子实体,灵芝孢子粉、猪苓、猴头菇、香菇、桦褐、黑木耳、茯苓、灵芝孢子油、螺旋藻购买于专卖店、药店或官方旗舰店,菜籽油、大豆油、玉米油、葵花籽油、花生油和橄榄油购于当地大型购物超市。色谱分析用流动相甲醇为色谱纯,其余试剂为分析纯。试验在惠州市食品药品检验所食品室,于2018年10月—2019年5月进行。
1.3实验方法
1.3.1色谱条件色谱柱为ODS-2 HYPERSIL(4.6 mm×250 mm,5μm);流动相为甲醇;流速1 mL/min;检测波长282 nm;柱温37℃;进样量10μL;外标法定量。
1.3.2对照品溶液的制备准确称取20 mg(精确至 0.0001 g)麦角甾醇于20 mL棕色容量瓶中,用甲醇-三氯甲烷溶液(1:1,V/V)定容至刻度,摇匀,即得(浓度为1 mg/mL)。
1.3.3供试品溶液的制备称取约0.5 g粉碎后样品(精确至0.001 g)于100 mL密封玻璃容器中,加入40 mL 50 g/L的氢氧化钠-甲醇溶液,混匀后于80℃水浴皂化1 h,皂化后立即用冷水冷却至室温。
将皂化液转移到250 mL的分液漏斗中,加入50 mL石油醚,振荡提取,将下层溶液转移至另一250 mL的分液漏斗中,重复提取1次,合并醚层。将醚层并入蒸发瓶内,于50℃水浴中减压蒸馏浓缩,待瓶中醚液近干时,取下蒸发瓶。用甲醇-三氯甲烷溶液(1:1,V/V)将蒸发瓶中残留物溶解并转移至10 mL棕色容量瓶中,定容至刻度。过0.45μm有机系滤膜,待上机测定。
2结果与分析
2.1提取条件的选择
对2种水解液(50 g/L NaOH-甲醇溶液;50 g/L KOH-乙醇溶液)、水解液体积(20、30、40 mL)、皂化温度(40、60、70、80、90℃)、皂化时间(30、45、60、75、120 min)等因素进行了考察。
结果发现2种水解液中,相同提取条件下以50 g/L氢氧化钠-甲醇溶液提取效果较佳。水解液体积(20、30、40 mL)对麦角甾醇提取率影响不大,差异不显著,考虑到真菌类样品菌丝体较轻,所占体积较大,为了保证样品能皂化完全同时又不造成浪费,选用水解液体积为40 mL。考察了不同皂化温度对麦角甾醇提取率的影响,发现80℃和90℃下皂化效果均较佳,从安全及能耗等方面考虑,确定皂化温度为80℃。对80℃下皂化时间进行了考察,发现随着皂化时间的延长,提取率不断升高,当皂化时间为60 min时,麦角甾醇提取率最高,皂化时间为120 min时,提取率反而有所下降,为此确定皂化时间为60 min。
2.2色谱条件的选择
2.2.1检测波长的选择利用紫外分光光度计对麦角甾醇标准品进行扫描,波长范围为190~700 nm,结果麦角甾醇在282 nm处具有最大吸收峰,为此确定麦角甾醇检测波长为282 nm。
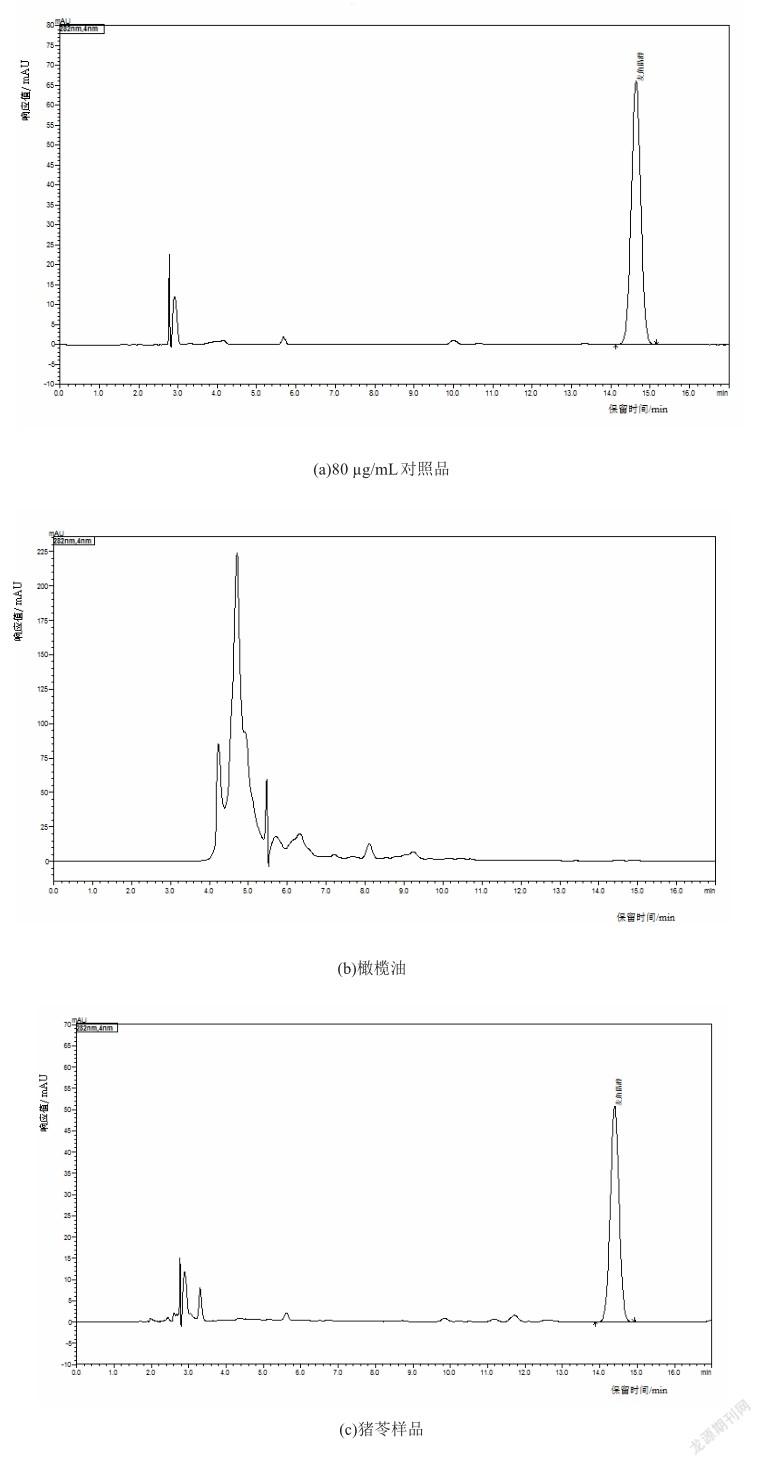
2.2.2流动相的选择检测麦角甾醇常用流动相有甲醇、甲醇-水等洗脱系统。本实验考察了不同比例甲醇-水作为流动相的差别,结果显示,在不同配比条件下随着水比例的增加,麦角留醇峰形变低、变宽、保留时间变长,在100%甲醇的比例下,不但出峰时间提前,其响应值也相对提高,麦角留醇峰形窄、对称,可以与样品中其他成分分开,而且实验操作简单、方便、快捷。故本研究选用100%甲醇作为流动相,麦角甾醇保留時间在14.421 min,柱效和峰形良好。
2.2.3色谱柱的选择比较了几种不同类型、不同品牌的C18反相色谱柱的色谱分离效果,实验结果表明,麦角甾醇在以纯甲醇为流动相,流速1.0 mL/min,柱温为37℃时,色谱柱上均有较好的分离效果。
2.3线性关系、方法检出限及定量限
以对照品溶液为原液,依次配制成浓度为5、10、20、40、80、120、160μg/mL的系列对照品溶液。按照“1.3.1”色谱条件进行分析,测定对照品的峰面积。以峰面积为纵坐标,麦角甾醇浓度为横坐标,绘制标准曲线,结果见表1。线性回归方程如式(1)。结果表明,麦角甾醇在5~160μg/mL范围内呈现良好的线性关系。
Y=14.054X+5.421 R2=0.9998………………(1)
2.4精密度试验
在上述色谱条件下,以浓度为80μg/mL的对照品溶液为考察对象,依法连续测定6次,得麦角甾醇峰面积的RSD为0.059%,表明本方法精密度良好。
2.5稳定性试验
取灵芝孢子粉样品,制备的供试品溶液室温放置,放置1、2、3、4、6、12 h后各测定1次,共测定6次,得麦角甾醇峰面积的RSD为2.88%,表明供试品溶液中麦角甾醇在12 h内稳定性良好。
2.6重复性试验
精密称取同一灵芝孢子粉试样6份,按照“1.3.3”制备供试品,按照“1.3.1”方法进行测定。结果表明,麦角甾醇平均含量为1.24 mg/g,RSD为1.81%(n=6),本方法重复性较好。

2.7实测样品及加标回收率
选取冬虫夏草、蛹虫草、赤灵芝子实体、紫芝子实体、猴头菇、香菇、黑木耳、桦褐、猪苓、茯苓、破壁灵芝孢子粉、灵芝孢子油和螺旋藻、大豆油、玉米油、葵花籽油、花生油、菜籽油、橄榄油加入0.6 mg和0.8 mg标准品,制备样品并进行测定,重复3次,结果见表2、图1。冬虫夏草加标回收率在86.38%~101.00%,RSD为4.00%;蛹虫草加标回收率在88.62%~102.00%,RSD为2.09%;赤灵芝子实体加标回收率在88.00%~100.67%,RSD为0.88%;紫芝子实体加标回收率在86.33%~ 95.50%,RSD为4.82%;破壁灵芝孢子粉加标回收率在88.00%~99.63%,RSD为3.60%;猪苓加标回收率在88.12%~104.50%,RSD为1.14%;猴头菇加标回收率在89.33%~105.33%,RSD为2.63%;香菇加标回收率在88.75%~107.50%,RSD为3.12%;桦褐加标回收率在86.00%~92.90%,RSD为3.51%;黑木耳加标回收率在90.75%~97.17%,RSD为2.07%;茯苓加标回收率在89.75%~95.32%,RSD为5.19%;灵芝孢子油加标回收率在86.00%~94.17%,RSD为0.53%;螺旋藻加标回收率在99.48%~101.40%;大豆油加标回收率在91.76%~ 98.58%;玉米油加标回收率在89.99%~96.27%;葵花籽油加标回收率在90.75%~97.52%;花生油加标回收率在88.03%~101.25%;菜籽油加标回收率在93.93%~ 98.60%;橄榄油加标回收率在91.92%~93.70%;各试样中加回标收率在86.38%~105.33%,可满足含量测定的需求。

3讨论
本研究采用NaOH-甲醇溶液皂化提取麦角甾醇,相对于传统的皂化回流,操作更为简便,而且比超声法提取的麦角甾醇含量多,究其原因,真菌中含有游离麦角甾醇及酯化麦角甾醇[27-28],真菌中的酯化麦角甾醇在NaOH-甲醇溶液中发生水解产生游离麦角甾醇,最终提取的是总的麦角甾醇,采用超声法只能提取游离的麦角甾醇,故选取NaOH-甲醇溶液皂化提取麦角甾醇。有文献报道用紫外分光光度法测定灵芝制品中的麦角甾醇含量[29],但该法所测结果受三氯甲烷的紫外吸收及样品中其他杂质的干扰[30],重复性差,同时测得含量还较高,故本研究应用高效液相色谱法,可以有效排除干扰,不仅特异性强,而且结果准确度也高,能比较真实地反映其实际水平。
4结论
本研究建立了真菌及其制品中麦角甾醇含量测定的高效液相色谱法(HPLC),麦角甾醇在5~160μg/mL范围内具有较好的线性,线性相关系数大于0.999,检出限为0.1μg/mL,平均回收率为86.32%~105.24%,该方法操作简便、灵敏,且具有较好的重复性和稳定性,可应用于真菌及其制品中麦角甾醇含量的定量分析。利用建立的HPLC法对冬虫夏草、破壁灵芝孢子粉等真菌及其制品以及螺旋藻、大豆油等6种植物油样品进行麦角甾醇含量的测定,螺旋藻以及大豆油等6种植物油中均未检出麦角甾醇;真菌类及其制品中均含有麦角甾醇。由此可见,麦角甾醇具有专属性,可作为真菌及其制品的特征指标,用于质量评价、掺伪鉴别等。

参考文献
[1]Chung D J, Yang M Y, Li Y R, et al. Ganoderma Lucidum Repress Injury of Ethanol- induced Steatohepatitis via Anti- inflammation, Anti-oxidation and Reducing Hepatic Lipid in C57BL/6J Mice[J]. Journal of Functional Foods,2017,33:314-322.
[2]汪雯翰,朱麗娜,张赫男,等.抑制前列腺癌的食药用菌醇提物的筛选及灵芝醇提物对癌细胞的抑制机理[J].菌物学报,2018,37(6): 782-793.
[3]谭洪升,李翔,巩伯梁,等.灵芝子实体和孢子粉三萜含量的测定及体外抗肿瘤活性的评价[J].微生物学免疫学进展,2018,46(1):43-48.
[4]高铫晖,王高乾,黄蕙芸,等.真菌三萜及甾体的生物合成研究进展[J].有机化学,2018,38(9):2335-2347.
[5]左园园,任佳丽,李忠海.食用菌中甾醇物质抗炎活性研究概述[J].食品与机械,2018,34(1):167-172.
[6]Li W, Zhou W, Cha J Y, et al. Sterols from Hericium Erinaceum and TheirInhibitionofTNF-αandNOProductionin Lipopolysaccharide- induced RAW 264.7 Cells[J].Phytochemistry, 2015,115:231-238.
[7]邓玉清,王纪,虞龙.微生物麦角甾醇的研究进展[J].微生物学杂志,2001,21(3):45-47.
[8]李晶,倪朝敏,陈建华,等.新型在线净化前处理HPLC-MS/MS测定香精香料中的麦角甾醇和麦角甾酮[J].食品科学,2018,39(12): 313-318.
[9]Jasinghe V J, Perera C O. Ultraviolet Irradiation: The Generator of Vitamin D2 in Edible Mushrooms[J].Food Chemistry,2006,95:638-643.
[10]屠婕紅,盛静,童梦楠,等.紫外光照射增加栽培食用菌中维生素D2含量的研究[J].营养学报,2018,40(3):288-293.
[11]Yelena S, William craig B, Amada L, et al. Effects of UV- B Radiation Levels on Concentrations of Phytosterol, Ergothioneine, and Polyphenolic Compounds in Mushroom Powders Used as Dietary Supplements[J].Journal of Agriculture,2014,62(14):3034-3042.
[12]Takaku T, Kimura Y, Okuda H. Isolation of an Antitumor Compound from Agaricus blazei Murill and Its Mechanism of Action[J].The Journal of Nutrition,2001,131(5):1409-1413.
[13]肖琳,刘明,刘格,等.麦角甾醇衍生物通过抑制NF-κB通路诱导人宫颈癌HeLa细胞凋亡[J].肿瘤药学,2018,8(4):512-518.
[14]杨秀璐,孟佳启,李婷,等.双波长法测定小柄马勃子实体液体发酵菌丝中麦角甾醇和麦角甾酮含量[J].中国食用菌,2018,37(5):57-61.
[15]Linsler D, Taube F, Geisseler D, et al. Temporal Variations of the Distribution of Water- stable Aggregates. Microbial Biomass and Ergosterol in Temperate Grassland Soils with Different Cultivation History[J].Geoderma,2015,241-242:221-229.
[16]朱效刚,陶冠军,陈蕴.高效液相色谱法测定功能性红曲中的麦角甾醇[J].食品与发酵工业,2005,26(2):104-107.
[17]宋师花,贾晓斌,陈彦,等.超临界CO2萃取灵芝中麦角甾醇的实验研究[J].中国中药杂志,2009(14):1783-1785.
[18]何荣军,周菲,赵月钧,等.灵芝总甾醇的闪式提取工艺优化及其抗氧化活性[J].食品与发酵工业,2013,39(9):200-214,
[19]胡代花,张嘉昕,李翠丽,等.超声辅助提取金针菇中麦角甾醇及其测定方法[J].食品工业科技,2017(23):192-196.
[20]高虹,谷文英.三波长光度法测定姬松茸中麦角甾醇含量[J].分析化学,2007,35(4):586-588.
[21]胡月芳.毛细管电泳-电化学检测法测定淮山中三种植物甾醇含量[J].北方园艺,2016(12):162-165.
[22]相聪坤,宿树兰,关胜江,等. HPLC法测定不同产地不同品种马勃药材中麦角甾醇[J].中草药,2016,47(8):1397-1400.
[23]Li S P, Lai C M, Gong Y X, et al. Simultaneous determination of ergosterol, nucleosides and their bases from natural and cultured Cordyceps by pressurised liquid extraction and high-performance liquid chromatography[J].Journal of Chromatography A,2004,1306(2):239-242.
[24]李思明,冯怡,曾星.HPLC-APCI-MS /MS法同时测定猪苓颗粒中麦角甾酮与麦角甾醇的含量[J].药物分析杂志,2014,34(4):649-653.
[25]戚大伟,林华清,沙云菲,等.气相色谱-质谱联用法测定烟草及烟草制品中的麦角甾醇[J].烟草科技,2013(5):41-45.
[26]黄龙,王进元,罗诚浩,等.烟草中游离植物甾醇的GC/MS/SIM分析[J].烟草科技,2006(10):41-45.
[27]Yuan J P, Wang J H, Liu X, et al. Simultaneous Determination of Free Ergosterol and Ergosterol Esters in Cordyceps sinensis by HPLC[J].Food Chemistry.2007,105(4):1755-1759.
[28]Yuan J P, Wang J H, Liu X. Distribution of Free and Esterified Ergosterols in the Medicinal Fungus Ganoderma lucidum[J].Applied Microbiology and Biotechnology,2007,77(1):159-165.
[29]张方英,方保梅,张静.灵芝制品中麦角甾醇的检测方法[J].江苏农学院学报,1997(19):22.
[30]张丽,王瑜杰,丁安伟.HPLC法测定灵芝孢子油中麦角甾醇的含量[J].江苏中医药,2009,41(6):52-53.
