干露及恢复过程中菲律宾蛤仔免疫指标的变化
2021-02-03王钰王文文谢深涵袁梦丁晓倩闫喜武秦艳杰
王钰 王文文 谢深涵 袁梦 丁晓倩 闫喜武 秦艳杰
摘要:在滩涂养殖和运输过程中,菲律宾蛤仔经常处于干露状态。笔者研究了蛤仔在干露胁迫和随后的恢复过程中酶活力和免疫相關物质含量的变化,初步揭示了滩涂贝类耐干露的生理学机制。在蛤仔干露12、24、48 h,以及恢复培养2、6、12、24 h时分别取蛤仔鳃和内脏团,测定酶活力及免疫相关物质含量,设持续海水养殖的蛤仔为对照组。结果表明,蛤仔在干露胁迫12 h和24 h时,内脏团AKP活力显著高于对照组(P<0.05);CAT活性在整个实验中与对照组差异不显著(P>0.05),鳃中AKP和CAT活力与对照组差异不大;内脏团SOD活力在干露12 h时显著升高,而鳃中SOD活力在恢复期显著升高(P<0.05);内脏团中MDA含量在干露24 h时显著高于对照组,鳃中MDA含量在干露12 h和24 h时显著低于对照组;内脏团NO含量在恢复海水后6 h时显著高于对照组(P<0.05),而鳃在干露48 h时NO含量显著高于对照组。分析认为,干露过程中,蛤仔呼吸代谢减慢,鳃的生理机能维持平稳或受到抑制,代谢和免疫保护作用主要由内脏团来完成。恢复培养时,随着呼吸作用和血液循环的恢复,鳃逐渐承担起部分抗氧化功能,使机体迅速恢复到正常生理状态。
关键词:滩涂养殖;菲律宾蛤仔;干露;酶活力;免疫指标;MDA;NO
中图分类号:S917.4文献标志码:A论文编号:cjas2020-0157
The Effects of Air Exposure and Recovery on Immune Parameters of Ruditapes philippinarum Wang Yu1, Wang Wenwen1, Xie Shenhan1, Yuan Meng1, Ding Xiaoqian1, Yan Xiwu1,2, Qin Yanjie1,2
(1College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, Liaoning, China;
2Engineering Research Center of Shellfish Culture and Breeding in Liaoning Province, Dalian 116023, Liaoning, China)
Abstract: Manila clam (Ruditapes philippinarum) is often exposed in air during the cultivation and transportation. In order to detect the physiological features of clams suffered from air exposure, we studied the changes of enzyme activities and immunity substances during air exposure and recovery stages. The gills and visceral masses were sampled at 12 h, 24 h and 48 h after air exposure and at 2 h, 6 h, 12 h and 24 h after recovery in sea water. The enzyme vitalities and the important immune related substances were tested by the kits, and the clams cultured in sea water all along were considered as controls. The AKP activities of the visceral mass in air exposed clams for 12 h and 24 h were significantly higher than those in control (P<0.05). CAT activities in visceral mass were not different from those of controls. AKP and CAT values in gills were relatively stable during the whole experiment. SOD values were significant higher in visceral mass at 12 h of air exposure, and in gills during recovery for 2 h. MDA levels were significantly higher in visceral mass at 24 h of air exposure, and lower in gills during recovery for 12 h and 24 h than those in controls. NO showed the maximum value at 6 h after recovery in visceral mass and at 48 h of air exposure in gill. According to the results, it is concluded that the antioxidation and immunization are exercised mainly by visceral mass during air exposure. And during recovery process, along with the recovery of respiration and circulation, the gill exercises the antioxidation to some extent, and then the clams quickly return to the normal physiological level. Keywords: Mudflat Aquaculture; Ruditapes philippinarum; Air Exposure; Enzyme Activity; Immunity Index; MDA; NO
0引言
近年来,随着养殖业不断发展,滩涂资源合理的开发利用逐渐受到重视。中国浅海滩涂分布广泛,总面积约220万hm2,滩涂开发以养殖业为主[1]。在自然条件下,受潮汐、自然迁徙或运输等因素影响,潮间带生物经常会处于干露状态。研究潮间带生物耐干露的能力,以及干露过程中的生理生态学变化,有助于揭示潮间带生物独特的生理学特征。贝类是潮间带生物的主要群体。一般贝类离水后,能在一个相当长的时间内维持生命力,这种离水后能维持生命活动的时间,称为“露空时间”[2]。露空时间越长则水生动物的干露耐受能力越强,但过长时间的干露会打破动物体细胞内外的水分平衡,动物因不能再从周围环境中获得足够的氧气而窒息死亡[3]。贝类的露空时间与种类、大小有关,相同种类,成贝比稚贝更耐干露[4]。近年来,有关水生生物尤其是稚贝,在干露条件下生长和存活的报道较多[5]。贝类的先天性免疫防御主要包括体液免疫和细胞免疫2个方面[6]。在贝类的细胞免疫程中,血细胞会通过吞噬作用和水解酶与抗氧化酶的释放来抵挡异物入侵[7]。而血细胞分泌的凝集素、溶血素、抗菌肽、非特异性免疫相关酶系及各种行使调控作用的蛋白因子作为体液免疫在机体中起到重要作用[8]。现有研究表明,贝类体内免疫相关活性的溶酶体酶含量会在受到异物刺激后产生显著变化[9]。碱性磷酸酶(Alkaline phosphatase, AKP)是溶酶体重要组成部分[10],存在于贝类的血细胞和血清中,在免疫反应中发挥重要作用[11]。血细胞在吞噬异物的过程中会发生呼吸爆发(Respiratory burst),即大量活性氧(Reactive oxygen species, ROS),如超氧阴离子(O2-)、过氧化氢(H2O2)羟(基)氢氧基和硝酸盐超氧化物阴离子(Peroxynitrite anions)产生的过程[12-13]。氧自由基会在发生免疫作用的同时削弱血细胞活性,而贝类产生的超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalase, CAT)、一氧化氮(Nitric Oxide, NO)组成的抗氧化体系可以减轻ROS对机体的毒害作用[14]。很多研究已经证实CAT、SOD和NO除了具有清除氧化自由基的作用外,还参与贝类的免疫反應[15-17]。
菲律宾蛤仔(Ruditapes philippinarum)隶属于软体动物双壳纲、帘蛤目,于中国南北海区广泛分布[18]。在菲律宾蛤仔的养殖和运输过程中经常会处于干露状态中。本实验在干露及复养条件下对菲律宾蛤仔鳃和内脏团中AKP、SOD、CAT酶活力以及丙二醛(malonic dialdehyde, MDA)、NO含量的变化进行分析,以期揭示菲律宾蛤仔应对干露胁迫的生理学适应机制。
1实验材料与方法
1.1实验材料
实验所用菲律宾蛤仔壳长(2.8±0.1) cm,壳宽(1.8±0.1) cm,壳高(1.0±0.1) cm。蛤仔养殖实验在大连海洋大学辽宁省贝类良种繁育工程技术研究中心50 L水槽内进行。实验前将蛤仔于15~16℃条件下暂养7天,暂养期间,每天投喂螺旋藻粉一次,持续通气,并及时挑出死亡个体。待死亡率稳定并接近于0时开始实验。
1.2实验方法
1.2.1干露实验实验组蛤仔从海水中捞出,擦干水分,置于19 L电子制冷冰箱中进行干露实验,温度设置为15℃[实测温度为(15.4±0.8)℃]。干露48 h后,将所有蛤仔重新投入15~16℃自然海水中进行复养。对照组蛤仔一直放于50 L水槽中海水养殖,温度为15~ 16℃。对照组和实验组蛤仔起始数量均为100只,实验平行进行3次。整个实验期间不投饵。
1.2.2取样及酶活力指标测定干露实验组分别在干露12 h(A12h)、24 h(A24h)和48 h(A48h),以及放入海水中2 h(W2h)、6 h(W6h)、12 h(W12h)和24 h(W24h)取样,每次每个平行组取9只蛤仔样品,用解剖刀剖开蛤仔双壳后在冰盘上迅速解剖,分别剪取内脏团和鳃组织,每3只蛤仔各组织分别混合,称量组织块质量,加入9倍体积的0.9%生理盐水,用组织研磨器低温下研磨。低温高速离心机4℃2500 r/min,离心10 min取上清液测定AKP活力、NO及MDA的含量。取上清液用生理盐水按1:9稀释成10%组织匀浆,用来检测蛋白浓度。取上清液用生理盐水按1:1稀释成50%组织匀浆,用来测定组织中CAT和SOD酶活力。AKP、CAT、SOD酶活力、MDA及NO的含量均采用南京建成生物工程有限公司试剂盒进行测定,按照说明书操作。
1.3数据处理
所有结果均为各个平行实验样本的平均值。采用SPSS 16.0软件进行方差分析和多重比较,以P< 0.05为差异显著水平。
2结果
2.1实验过程中蛤仔AKP活力的变化
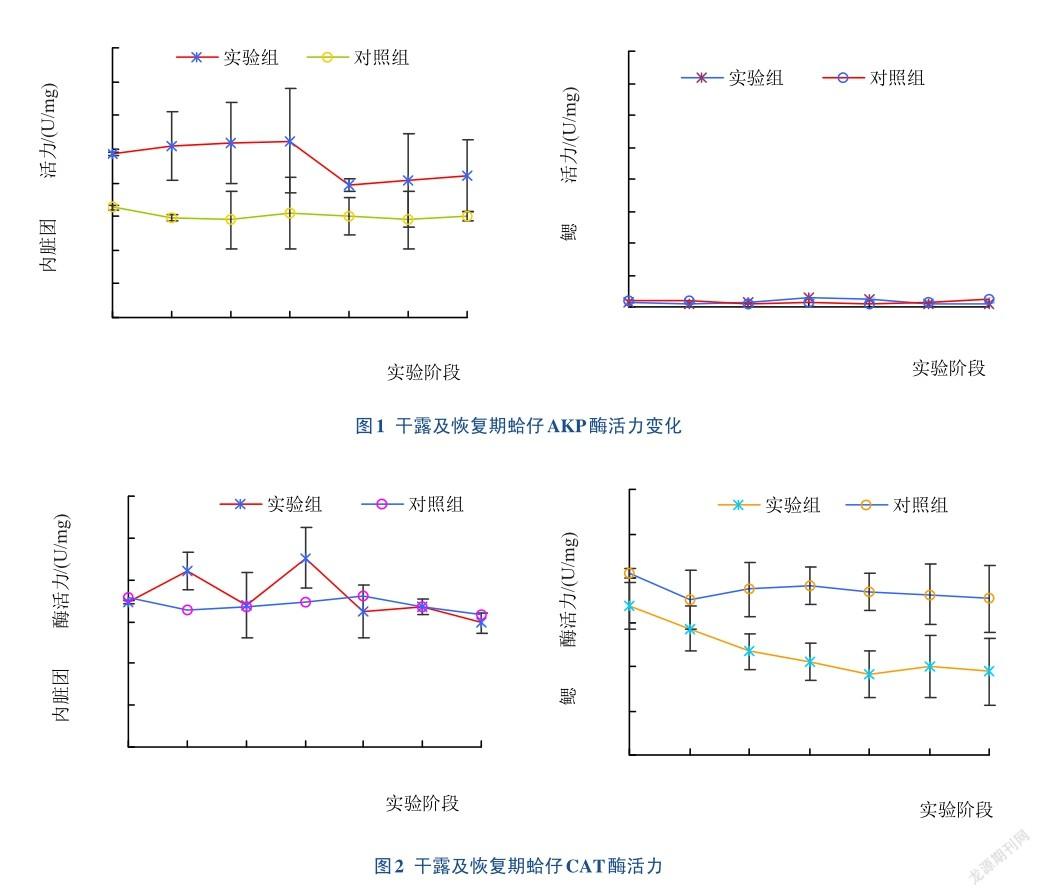
干露实验过程中蛤仔AKP活力的变化如图1所示,对照组AKP活力基本保持稳定,平均值为30.17 U/mg。内脏团实验组在干露过程中AKP活力高于对照组,在干露12 h和24 h时与对照组差异显著(P<0.05),复养后活力降低趋于平稳。鳃实验组AKP活力基本保持稳定,与对照组差异不显著(P>0.05)。整个实验期间,蛤仔内脏团中AKP酶活力显著高于鳃中AKP酶活力(P<0.05)。
2.2实验过程中蛤仔抗氧化酶活力的变化
实验过程中蛤仔鳃和内脏团中CAT酶活力相差不大(图2),干露24 h及恢复2 h时,实验组蛤仔内脏团中CAT酶活力出现短暂升高[分别是(84.26±2.39) U/mg和(90.53±10.78) U/mg],但与对照组差异不显著(P> 0.05),其余时间内CAT酶活力均与对照组持平。与对照组相比,实验组蛤仔鳃中CAT活力在整个实验过程中有降低的趋势,但与对照组差异不显著(P>0.05)。
实验过程中蛤仔鳃和内脏团中SOD酶活力相差不大(图3),干露过程中蛤仔内脏团SOD活力高于对照组,在干露24 h时最高[(74.64±15.71) U/mg, P< 0.05]。恢复期与对照组差异不显著。干露期蛤仔鳃中SOD酶活力与对照组持平,恢复期2 h时显著高于对照组(P<0.05),之后恢复对照组水平。
2.3干露实验过程中蛤仔MDA和NO含量的变化
实验过程中蛤仔鳃和内脏团中MDA含量相差不大(图4)。干露12 h和24 h时,蛤仔内脏团中MDA含量显著高于对照组[分别是(15.40±0.79)μmol/mg和(18.10±1.31)μmol/mg,P<0.05],而鳃中MDA含量则显著低于对照组[分别是(7.98±1.37)μmol/mg和(8.47±0.92)μmol/mg,P<0.05],干露48 h及恢复期内,鳃和内脏团中MDA含量均与对照组差异不显著(P>0.05)。
实验过程中蛤仔鳃和内脏团中NO含量相差不大(图5)。整个实验过程中,对照组NO含量基本保持稳定。实验组蛤仔内脏团NO含量在干露时保持稳定,与对照组无显著差异,在恢复期先升高后降低,在复养6 h时达到最大值[(6.20±0.93)μmol/mg],与对照组差异显著(P<0.05)。实验组蛤仔鳃NO含量在干露状态下普遍高于对照组,且在干露48 h时达到最大值[(4.44±0.80)μmol/mg],与对照组差异显著(P<0.05),恢复期逐渐恢复至对照组水平。3讨论
3.1干露对蛤仔碱性磷酸酶活力的影响
AKP是贝类免疫中较为重要的水解酶,直接参与体内磷酸基团的代谢和转移,与营养物质的消化吸收相关[19- 21]。从本次实验研究的结果来看,内脏团的AKP活力高于鳃,说明内脏团是免疫、代谢和营养物质消化吸收的主要场所[11]。有研究表明,海洋生物在缺氧胁迫下,糖酵解是主要功能反应,而与鱼类、甲壳动物不同的是,贝类还会发生糖酵解的异化反应[28]。因此,研究认为,贝类耐低氧能力较强[29-30]。干露期间蛤仔處于缺氧状态,主要通过糖酵解作用来供应能量,而AKP对糖酵解有重要作用[22]。实验组内脏团AKP酶活性在干露期A12h和A24h时显著高与对照组(P< 0.05),推测是干露胁迫激活了蛤仔免疫系统,使得AKP活性增强,以应对干露期间的能量供应;恢复期AKP酶活性降低并恢复平稳,这可能是因为解除干露胁迫后蛤仔机体代谢恢复正常,能量供应恢复,使得AKP活性降低。这与关于三疣梭子蟹的研究结果不同[23],可能是蛤仔长期生活于滩涂的特殊环境中,适应干露所产生的独特生理特征。
3.2干露对蛤仔抗氧化酶活力的影响
从本次实验研究的结果来看,对照组蛤仔内脏团和鳃的SOD和CAT酶活力相当,说明鳃和内脏团在抗氧化过程中都起到重要作用。其中内脏团的CAT和SOD酶活力在蛤仔干露过程中有上升的趋势,其中SOD酶活力达到显著水平,恢复初期(2 h)也有小幅上升。段海宝[14]关于青蛤的研究结果也表明干露胁迫下抗氧化酶活力先上升后下降,与本文的研究结果相似,但与三疣梭子蟹的耐干露研究结果[24]相反,可能是由于青蛤、蛤仔均属于双壳滩涂贝类,且耐干露能力都比较强,且与甲壳类耐干露的生理机理不同造成的。本研究发现干露过程中蛤仔鳃中2种酶活力在干露过程中没有显著变化,分析认为干露过程中鳃无法进行呼吸代谢,主要的抗氧化作用由内脏团来完成。而在恢复期间,鳃中SOD酶活力出现显著升高的过程,推测蛤仔重新入水,呼吸代谢异常旺盛,从而使鳃承担了清除氧自由基的主要作用。
3.3干露对蛤仔MDA和NO含量的影响
MDA是由机体脂质过氧化作用产生的最终产物,其含量的变化能反映细胞膜氧化损伤的程度,是评价细胞膜氧化损伤的一种指标[25-26]。实验组蛤仔在干露12 h和24 h时,蛤仔内脏团中MDA含量显著高于对照组(P<0.05),说明蛤仔内脏团细胞膜氧化损伤程度升高这种现象在黑足鲍干露过程中也有报道[27]。相对来讲,蛤仔内脏团中脂质成分较多,推测是由于干露胁迫使蛤仔内脏团无氧呼吸代谢加强,生成大量的负氧离子破坏了细胞膜结构,导致细胞质膜受损。而鳃中MDA含量则显著低于对照组(P<0.05),鳃内细胞的细胞质膜损伤程度降低,侧面说明了干露时蛤仔鳃的代谢维持较低水平以保护机体。干露48 h及恢复期内,鳃和内脏团中MDA含量均与对照组差异不显著(P> 0.05),说明蛤仔代谢逐渐恢复正常水平。

NO是链式阻断剂,一类存在于生物各组织的极不稳定的生物自由基,具有抑制脂质过氧化和清除自由基的作用,在生理条件下,结构型一氧化氮合酶合成适量的一氧化氮。与体内的氧自由基结合,生成强氧化基,对机体起保护作用[23]。整个实验过程中,对照组NO含量基本保持稳定。实验组蛤仔内脏团NO含量在干露时保持稳定,与对照组无显著差异,结合之前MDA的实验结果,推测是干露时内脏团内的氧自由基增多,机体为保护自身,产生了过量的NO与之结合,使得所测得的NO含量保持不变造成的。NO在恢复期先升高后降低,在复养6 h时达到最大值,与对照组差异显著(P<0.05),说明在恢复期氧自由基迅速减少,过量的NO还未调节到正常水平,所以在复养6 h时升高到最大值,随后恢复正常。实验组蛤仔鳃NO含量在干露状态下普遍高于对照组,且在干露48 h时达到最大值,与对照组差异显著(P<0.05),推测是干露胁迫后鳃内也释放了大量的NO,而代谢产生的氧自由基含量少,所以未与氧自由基结合,使得所测的NO含量较高。恢复期鳃的代谢恢复正常,含有的NO水平恢复正常至对照组水平。
4结论
通过干露及恢复海水培养实验,发现蛤仔干露过程中,鳃组织中各种酶活力和MDA保持平稳或受到抑制,主要是由于其呼吸作用适应性减慢造成的,此时蛤仔免疫和抗氧化作用主要由内脏团来完成。而恢复海水培养过程中,随着呼吸作用和血液循环的恢复,鳃逐渐承担起部分抗氧化功能,从而使机体迅速恢复到正常生理状态。从NO含量的变化也可以推测,蛤仔鳃和内脏团2种组织在干露和恢复培养过程中发挥作用存在明显差异。
参考文献
[1]彭建,王仰麟.我国沿海滩涂的研究[J].北京大学学报:自然科学版,2000,36(6):832-839.
[2]蔡英亚,张英,魏若飞.贝类学概论(第二版)[M].上海:上海科学技术出版社,1995.
[3]刘建业,喻达辉,李金碧.盐度和pH对合浦珠母贝(Pinctada fucata)耗氧率和排氨率的影响[J].海洋与湖沼,2011,42(4):603-607.
[4]陆彤霞,尤仲杰,马斌,等.酸碱度和干露对墨西哥湾扇贝幼虫和稚贝的影响[J].水产养殖,2003,3(24):42-45.
[5]杨凤,谭文明,闫喜武,等.干露及淡水浸泡对菲律宾蛤仔稚贝生长和存活的影响[J].水产科学,2012,31(3):143-146.
[6]Loker E S, Adema C M, Zhang S M, et al. Invertebrate immune systems not homogeneous, not simple, not well understood[J]. Immunol Rev,2004,198 :10-24.
[7]Soares- da- Silva I M, Ribeiro J, Valongo C, et al. Cytometric, morphologic and enzymatic characterisation of haemocytes in Anodonta cygnea[J]. Comparative biochemistry and physiology. PartA, Molecular & integrative physiology,2002,132(3):541-53.
[8]Butt D, Raftos D. Phenoloxidase-associated cellular defence in the Sydney rock oyster, Saccostrea glomerata, provides resistance against QX disease infections[J]. Developmental and Comparative Immunology, 2008,32(3):299-306.
[9]李东东,聂鸿涛,刘国龙,等.盐度和干露对大竹蛏呼吸代谢相关酶的影响[J].水产科学,2019,38(1):55-60.
[10]彭怀明,周书林.软体动物免疫功能研究进展[J].动物医学进展, 2010(8):79-83.
[11]牟海津,江晓路.免疫多糖对栉孔扇贝酸性磷酸酶碱性磷酸酶和超氧化物歧化酶活性的影响[J].青岛海洋大学学报,1999,29(3): 463-468.
[12]Klebanoff S J. Oxygen dependent cytotoxic mechanisms of phagocytes[J].Adv Host Defense Mech,1982,1.
[13]时少坤.环境因子对贝类几种免疫因子影响的研究[D].上海:上海海洋大学,2013.
[14]段海宝,茆双,杜楠,等.干露胁迫对青蛤呼吸代谢及抗氧化相关酶活力的影响[J].海洋科学,2020,44(3):42-49.
[15]饶玉才.外界刺激与环境胁迫对背角无齿蚌(Anodonta woodiana)免疫因子的影响[D].南昌:南昌大学,2007.
[16]李子牛,林听听,么宗利,等.盐度对青蛤抗氧化酶活性及生长的影响[J].生态学杂志,2012,31(10):2625-2630.
[17]丁君,孙巍,刘志敏,等.0#柴油对文蛤三种免疫酶活性的影响[A].武汉大学:环境污染与大众健康学术会议[C].美国科研出版社, 2010:845-851.
[18]刘青,张越,付鑫,等.菲律宾蛤仔的研究进展[J].河北渔业,2011(1): 56-59.
[19]孙虎山,李光友.脂多糖对栉孔扇贝血清和血细胞中7种酶活力的影响[J].海洋科学,1999(4):54-58.
[20]Zhang R Q, Chen Q X, Zheng W Z, et al. Inhibition kinetics of green crab (Scylla serrata) alkaline phosphatase activity by dithiothreitol or 2-mercaptoethanol[J].The International Journal of Biochemistry & Cell Biology,2000,32(8):865-87.
[21]刘云,孔伟丽,姜国良,等.2种免疫多糖对刺参组织主要免疫酶活性的影响[J].中国水产科学,2008,15(5):787-793.
[22]Tian J Y, Jia H B, Yu J. A description of alkaline phosphatases from marine organisms[J].中国海洋湖沼学报:英文版,2016,34(4):795-809.
[23]高煥,阎斌伦,陈百尧,等.干露温度对三疣梭子蟹非特异免疫指标的影响[J].水产科学,2013,32(5):280-283.
[24]姜娜,王芳,路允良,等.干露对三疣梭子蟹抗氧化和应激能力的影响[J].水产学报,2014,38(12):1996-2004.
[25]瞿中和.细胞生物学[M].北京:高等教育出版社,2000.
[26]代国杰,朱建津,高琳琳,等.褪黑素对小鼠抗氧化作用的影响[J].食品工业科技,2010,31(3):347-350.
[27]刘毅,张继红,吴文广,等.不同温度条件下黑足鲍干露耐受能力和生化响应的模拟研究[J].中国水产科学,2020,27(11):52-60.
[28]Qiao L, Song S, Fang Z, et al. Effects of hypoxia on survival, behavior, metabolism and cellular damage of Manila clam(Ruditapes philippinarum)[J].PLoS One,2019,14(4):215-223.
[29]Rosenberg R, Hellman B, Johansson B. Hypoxic tolerance of marine benthic fauna[J].Marine ecology progress series,1991,79(1): 127-131.
[30]Miller D, Poucher S, Coiro L. Determination of lethal dissolved oxygen levels for selected marine and estuarine fishes, crustacean, and a bivalve[J]. Marine Biology,2002,140(2):287-296.
