党参茎基腐病镰孢菌鉴定及其对杀菌剂的敏感性研究
2021-02-03漆永红李敏权曹素芳蒋晶晶李雪萍李青青徐美蓉李继平
漆永红 李敏权 曹素芳 蒋晶晶 李雪萍 李青青 徐美蓉 李继平
摘要:为明确党参茎基腐病害的病原、致病性和优势病原种类及其对不同杀菌剂的敏感性,采用组织分离法进行病原菌分离,并根据其培养性状、形态学和分子生物学特征进行鉴定,同时采用平皿菌丝生长抑制法测定不同药剂的敏感性。结果表明,该病害的病原为尖孢镰孢菌(Fusarium oxysporum)、茄病镰孢菌(F. sonali)和木贼镰孢菌(F. equiseti),其中尖孢镰孢菌为优势种。室内致病性测试结果表明,3种镰孢菌均可引起党参茎基腐病,其中尖孢镰孢菌的致病性最强,显著高于其他2种菌。供试药剂对菌丝生长均有抑制作用,苯醚甲环唑对3种镰孢菌具有很强的抑制活性,同时3种镰孢菌对吡唑醚菌酯的敏感性较高。
关键词:党参;茎基腐病;镰孢菌;病原鉴定;杀菌剂;敏感性测定
中图分类号:S436.429文献标志码:A论文编号:cjas2020-0052
Identification of Codonopsis pilosula Crown Rot Disease and Its Sensitivity to Fungicides
Qi Yonghong1, Li Minquan2, Cao Sufang2, Jiang Jingjing1, Li Xueping1, Li Qingqing1, Xu Meirong3, Li Jiping1
(1Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou 730070, Gansu, China;
2Institute of Fruit and Floriculture Research, Gansu Academy of Agricultural Sciences, Lanzhou 730070, Gansu, China; 3Institute of Agricultural Quality Standards and Testing Technology, Gansu Academy of Agricultural Sciences, Lanzhou 730070, Gansu, China)
Abstract: To clarify the pathogen, pathogenicity and dominant pathogen species of Codonopsis pilosula crown rot disease and their sensitivity to different fungicides, the pathogen was isolated by tissue isolation method and identified according to its culture traits, morphology and molecular biological characteristics. Meanwhile, the sensitivity of different fungicides was determined by mycelium growth inhibition method. The results showed that the disease pathogens were identified as Fusarium oxysporum, F. sonali and F. equiseti. The dominant species was F. oxysporum. Pathogenicity testing showed that the three species could cause C. pilosula crown rot disease, F. oxysporum had the strongest pathogenicity, and its disease rate and disease index had a significant difference from those of the other two. Laboratory toxicity test of different fungicides to the mycelia growth of the three species showed that difenoconazole fungicide had the strongest inhibition activity, and the three Fusarium species had the highest sensitivity to pyraclostrobin fungicide.
Keywords: Codonopsis pilosula; Crown Rot Disease; Fusarium spp.; Pathogen Identification; Fungicides; Sensitivity Testing
0引言
黨参(Codonopsis pilosula)为桔梗科党参属,多年生草本植物,产自中国北方海拔1560~3100 m的山地林边及灌丛中。党参为中国常用的传统补益药,具有补中益气、健脾益肺的功效,主要有增强免疫力、扩张血管、降压、改善微循环、增强造血功能等作用[1]。根据外形和产地不同,党参分为西党、潞党、东党和条党[2]。甘肃省渭源县是中国党参之乡,主要生产白条党参。随着党参人工栽培面积的逐年扩大,生长环境的改变和病原菌的不断积累,病害已成为制约党参产量和品质的重要因素之一。
国内一些学者对党参的病害进行了研究。王艳等[3]报道甘肃省渭源和陇西县党参病害有斑枯病(Septoriacodonopsidis)、白粉病(Sphaerotheca codonopisi)、灰霉病(Botrytis cinerea)和根腐病(Fusarium oxysporiums)共4种。何先元等[4]研究发现,川党的根腐病(Fusarium sp.)、锈病(Puccinia campanumoeae)、紫纹羽病(Helicobasidium mompa)和霜霉病(Peronospora corydalis)等病害严重影响了其品质和产量。刘春叶等[5]对洛党参白粉病、锈病和根腐病的田间发生动态进行了调查,结果发现锈病发生最早。余中莲等[6]研究表明,川党参主要病害有锈病、根腐病、紫纹羽病、白粉病和斑枯病共5种,其中锈病、根腐病和紫纹羽病发生严重。近年来,党参茎基腐病在甘肃省党参种植区普遍发生,为害面积逐年呈上升趋势,尤其以重茬党参发病严重[7]。据调查,一般田间发病率为5%~10%,严重的达30%以上,该病害已成为制约当地党参发展的主要因素之一,严重影响了党参的产量与品质,给种植户带来巨大的经济损失[8]。关于该病害在甘肃省定西市临洮县、渭源县、岷县等地的病原种类等未见报道,故本研究拟对定西市发生的党参茎基腐病的发生症状进行研究,以确定其病原、致病性及其优势种群,同时进行室内药剂筛选及敏感性测定,初步筛选出化学防治的最佳药剂,为党参茎基腐病的田间防治提供理论依据。
1材料与方法
1.1病样采集与病原菌分离和纯化
2018年6月在甘肃省定西市临洮县、渭源县、岷县等主要党参生产基地采集发病植株,装入塑料袋带回实驗室。采用常规组织分离法[9],剪取茎基部病健交界处5 mm×5 mm组织块在75%酒精中浸泡5 s,然后转移至1.5%次氯酸钠溶液中消毒1 min,无菌水漂洗3次晾干,置于PDA培养基平板内于25℃培养5~7天。从菌落边缘切取菌丝块置于香石竹叶片琼脂(CLA)培养基(琼脂15~20 g,蒸馏水1000 mL,每皿加入长度1 cm的无菌康乃馨叶片3片),在25℃培养7~10天。将分离纯化的菌株转接至PDA斜面,4℃保存备用。
1.2致病性测定
采用牙签刺接种法,将灭菌的牙签放在带菌的PDA培养基中培养,使牙签上布满菌丝;用带菌牙签穿刺党参‘陇党1号’幼苗茎部,无菌土掩埋接种部位,每菌接种15株党参幼苗,以无菌牙签穿刺党参幼苗作为对照(CK),接种30天后观察党参的发病情况,统计发病率。病情指数根据分级标准进行测定:0级,茎基部没有病斑;1级,茎基部有轻微病斑,病斑面积占5%;3级,茎基部有轻微病斑,病斑面积占10%;5级,茎基部有轻微病斑,病斑面积占25%;7级,茎基部有轻微病斑,病斑面积占50%以上。
1.3病原菌形态学鉴定
将病原菌分别接种在PDA和CLA培养基上,25℃下培养7天和10天后,观察并拍照记录菌落形态、颜色、产孢结构与分生孢子形态、大小,根据镰孢菌分类方法和标准进行病原菌种类鉴定[10]。
1.4病原菌分子生物学鉴定
1.4.1真菌基因组DNA提取刮取PDA培养基上的病原菌菌丝,采用真菌基因组DNA快速抽提试剂盒E.Z. N.ATM.HP Fungal DNA Kit(OMEGA)的方法提取DNA,保存于-20℃备用。
1.4.2分子鉴定的引物本试验用真菌通用引物和镰孢菌特异性引物[11- 12],通用引物F1和F2的序列分别为ATTACTCCAGCATCCTTGC、TTTACAACTCCCAAA CCCC;核糖体内部转录间隔区(internal transcribed spacer,ITS)ITS1和ITS4的序列分别为TCCGTAGGTGAACCTGCGG、TCCTCCGCTTATTG ATATGC;镰孢菌特异性引物TEF1αF和TEF1αR的序列分别为ATGGGTAAGGARGACAAGAC、GGARGT ACCAGTSATCATGTT。
1.4.3 PCR扩增PCR扩增体系(25μL):10×Buffer2.5μL、2.5 mol/L dNTP 4μL、10μmol/L正反向引物各1μL、Taq酶0.5μL、DNA模板1μL,用ddH2O补足至25μL。PCR反应条件:94℃预变性10 min;94℃变性1 min,55℃退火1 min,72℃延伸2 min,25个循环;72℃延伸10 min,4℃冰箱保存。PCR产物经1%琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司测序,将获得的序列与GenBank核酸序列库进行同源性比对分析。
1.5病原菌对药剂的敏感性测定
供试药剂及浓度:10%苯醚甲环唑水分散粒剂(山东惠民中联生物科技有限公司),浓度为500、250、125、62.5、31.25μg/mL;250 g/L丙环唑乳油(中国农科院植保所农药厂),浓度为800、400、200、100、50μg/mL;70%代森锰锌可湿性粉剂(四川国光农化有限公司),浓度为1000、500、250、125、62.5μg/mL;25%吡唑醚菌酯悬浮剂(山东惠民中联生物科技有限公司),浓度为1000、500、250、125、62.5μg/mL;430 g/L戊唑醇悬浮剂(永农生物科技有限公司),浓度为600、300、150、75、37.5μg/mL。
采用常规菌丝生长抑制法测定供试药剂对病原菌的敏感性。在DNA培养基上培养3种真菌,打取0.5 cm菌饼,将其移到含有不同药剂浓度的PDA培养基上,每种药设5个浓度,以无药处理作对照。25℃培养5天后,十字交叉法测量菌落直径,计算抑制率。采用唐启义和冯明光[13]的实用统计分析及其DPS数据处理系统软件,用生物测定-数量型数据机率值分析模型计算药剂的毒力回归方程y=a+bx、EC50和相关系数r,同时由平均b值确定不同病原菌对药剂的敏感性。
2结果与分析
2.1党参茎基腐病发病症状
党参地上部的部分叶片变黄,植株由下而上变黄枯死。靠近地面根上部的茎基部受害后,起初产生红色的类似“铁锈”病斑,逐渐变为褐色至黑褐色病斑,最后蔓延到整个茎部(图1)。
2.2病原菌在田间的分布及种类鉴定
共采集到党参标样52份,室内分离到镰孢菌株328株。3种镰孢菌在每个县区均有分布,对分离到的菌株进行鉴定和统计,尖孢镰孢菌217株,占66.16%;茄病镰孢菌和木贼镰孢菌为63株和48株,分别占19.20%和14.64%;其中尖孢镰孢菌为党参茎基腐病的优势种群。
各病原菌的培养性状和形态学特征鉴定如下:(1)菌株编号HX-2-3-3-1尖孢镰孢菌(F. oxysporum)。在 PDA培养基上菌落白色、粉色至紫色。大型分生孢子镰孢形,中间粗,两端尖细,具3~5个横隔膜,多为3个隔,大小为(23.5~32.9)μm×(2.4~3.5)μm,足胞明显。小型分生孢子椭圆形、长椭圆形,单胞,无色,假头状,大小为(3.5~14.1)μm×(1.8~2.9)μm。
(2)菌株编号WDCJ- 1- 1- 1茄病镰孢菌(F. sonali)。在PDA培养基上菌落淡蓝色,菌表白色,较繁茂或致密。大型分生孢子无色、淡绿色,较宽,两端圆,马特型,2~5个隔膜,多为3个隔膜,大小为(21.2~37.6)μm×(3.9~4.8)μm。小型分生孢子单胞,椭圆形、肾形,无色,大小为(7.1~14.1)μm×(2.9~4.1)μm。
(3)菌株编号MCJ-2-1-1木贼镰孢菌(F. equiseti)。气生菌丝棉絮状,多数菌株后期变黄褐色。大型分生孢子镰孢形,顶细胞延长渐细,足细胞明显,3~5个分隔,大小为(26.0~52.5)μm×(3.0~5.0)μm。小型分生孢子,纺锤形或肾形。
2.3病原菌分子生物学鉴定结果
测序结果与GenBenk数据库中进行Nucleotide Blast比对,与该病原菌的ITS片段同源性达99%,其中尖孢镰孢菌(F. oxysporum)、茄病镰孢菌(F. sonali)和木贼镰孢菌(F. equiseti)的序列分别为543、546、596 bp。党参茎基腐病与F. oxysporum、F. sonali和F. equiseti.亲缘关系最近。结合形态学特征,将从甘肃省定西市临洮县、渭源县、岷县采集的党参中分离得到的茎基腐病致病菌鉴定为尖孢镰孢菌(F. oxysporum)、茄病镰孢菌(F. sonali)和木贼镰孢菌(F. equiseti)。
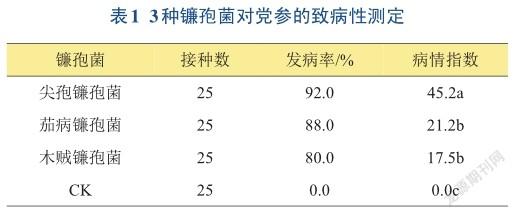
2.4 3种镰孢菌对党参的致病性测定结果
与对照相比,尖孢镰孢菌、茄病镰孢菌和木贼镰孢菌均对党参有致病性,但发病率和病情指数不同(表1)。尖孢镰孢菌的致病性最强,发病率和病情指数最高,分别为92.0%和45.2,显著高于茄病镰孢菌和木贼镰孢菌(P<0.05),而茄病镰孢菌和木贼镰孢菌对党参的致病力较弱,两者差异不显著。

2.5不同病原菌对杀菌剂的敏感性测定结果
各种药剂在一定的浓度处理下均对3种镰孢菌有抑制作用,随着处理浓度的增加,抑制效果增加。不同药剂对3种镰孢菌的半致死中浓度EC50值不同,其中苯醚甲环唑对3种镰孢菌的EC50值最小,戊唑醇次之,而代森锰锌最高,表明苯醚甲环唑对3种镰孢菌具有很强的抑制活性(表2)。从毒力回归方程可以看出,各药剂在不同镰孢菌中的b值不同。吡唑醚菌酯的b值最大,戊唑醇次之,而苯醚甲环唑的b值最小。经统计分析,吡唑醚菌酯与苯醚甲环唑、丙环唑、代森锰锌相比差异显著,而苯醚甲環唑、丙环唑、代森锰锌和戊唑醇四者之间差异不显著,表明3种镰孢菌对吡唑醚菌酯的敏感性较高(表3)。

3讨论与结论
植物病害病原种类的确定是防治的前提和基础,明确病原种类对制定合理的防治策略和提高防治效果有重要的指导作用[14]。本试验首次开展了甘肃省党参茎基腐病害研究,初步明确了该病害的病原为尖孢镰孢菌(F. oxysporum)、茄病镰孢菌(F. sonali)和木贼镰孢菌(F. equiseti),其中尖孢镰孢菌为优势种,这表明党参茎基腐病病原种类复杂,存在多种镰孢菌复合侵染的现象,因此不难想象田间党参茎基腐病为害的普遍性和严重性。
尖孢镰孢菌是农业生产中危害最严重的土传病原物之一,具有很强的寄生和腐生能力,其致病机制[15]为:(1)尖孢镰孢菌产生毒素镰孢菌酸对寄主植物抵抗力的降低和对寄主植物细胞代谢的影响[16-17];(2)尖孢镰孢菌产生的细胞壁降解酶降解寄主植物的细胞壁防御和保护组织,致使寄主植物细胞内的营养物质释放[18,19];(3)尖孢镰孢菌与寄主植物互作过程中产生一些蛋白物质影响病原菌在寄主植物根部定植和萌发[20];(4)尖孢镰孢菌对寄主植物防卫物质解毒,使寄主植物失去防御机制[21]。本试验仅明确了党参茎基腐病的发病症状、不同镰孢菌的种类和优势病原菌,但关于不同镰孢菌和党参茎基腐病的致病机理有待于进一步研究。
化学防治在镰孢菌的防治中起到很重要的作用[22-23]。本试验通过室内药剂生测筛选出苯醚甲环唑对3种镰孢菌具有很强的抑制活性,同时3种镰孢菌对吡唑醚菌酯的敏感性较高,为党参茎基腐病的田间防治提供理论依据。然而,在实际生产当中,长期用药单一,病原菌对此类药剂产生抗性,应采取多种药剂交替使用的方法来防治党参茎基腐病。同时,对镰孢菌这种土传病原引起植株根部发病,选择灌根药剂的剂型应具有双向内吸的特点,可针对不同剂型这一可控变量展开研究,筛选出防效更好的剂型。
由镰孢菌引起的病害不仅通过化学方法,还可利用综合方法解决,这是由于镰孢菌是一种常见的土传病原菌,可通过带菌种子和种苗进行远距离传病,同时施用未腐熟粪肥加重病害发生[24],这表明遏制病原菌传播和施用充分腐熟的农家肥是防治党参茎基腐病最直接和最有效的农业防治措施。此外,病原菌由伤口侵入植株后,迅速在植株的维管束内繁殖,并堵塞导管,严重阻碍植株的物质运输,导致叶片黄化、萎蔫及枯死[25],这表明彻底清除土壤中的蝼蛄、蛴螬和地老虎等地下害虫,以免其为害造成伤口,使病原菌更易从造成的伤口侵入加重茎基腐病的发生,这进一步说明在党参移栽时,选择无虫感染、无机械损伤和表皮光滑健康种苗的重要性。
参考文献
[1]国家药典编委会.中华人民共和国药典[M].北京:化学工业出版社,2005:199.
[2]卢燕林,张强,李彩萍,等.地道潞党参营养特性与产地土壤特征研究[J].山西农业科学,2007,35(5):42-45.
[3]王艳,陈秀蓉,王引权,等.甘肃省党参病害种类调查及病原鉴定[J].山西林业科学,2011,39(8):866-868,871.
[4]何先元,马发者,前乔芝.川党参规范化生产标准操作规程(试行).中国现代中药,2007,9(9):39-43.
[5]刘春叶,张盈,廖国会,等.贵州道真县洛党参主要病害发生动态及防控对策[J].中国植保导刊,2018,38(9):53-57.
[6]余中莲,雷美艳,蒲盛才,等.重庆党参真菌病害种类调查及病原鉴定[J].中药材,2015,38(6):1119-1122.
[7]陈秀蓉.甘肃省药用植物病害及其防治[M].北京:科学出版社, 2015:72-73.
[8]龚成文,米永伟,漆永红,等.甘肃中药材连作障碍问题探析[J].甘肃科技,2020,36(4):153-155.
[9]方中达.植病研究方法[M].北京:中国农业出版社,2001:6-13.
[10]王拱辰,郑重,叶琪明,等.常见镰孢菌鉴定指南[M].北京:中国农业科学技术出版社,1996:5.
[11]Murry M, Thompson W. Rapid isolation of high molecular weight plant DNA[J].NucleicAcids Rsearch,1980,8(19):4321-4326.
[12]Michielse C B, Rep M. Pathogen profile update: Fusarium oxysporum[J]. Molecular Plant Pathology,2009,10:311-324.
[13]唐启义,冯明光.实用统计分析及其DPS数据处理系统[M].北京:科学出版社,2002:121-140.
[14]漆永红,徐冬,张彦梅,等.嘉峪关市洋葱基盘腐烂病病原鉴定及药剂室内毒力测定[J].草业学报,2013,22(5):339-344.
[15]张荣,姜子德,李敏慧,等.尖孢镰孢菌致病机理及相关致病基因研究进展[J].中国农学通报,2011,27(15):254-258.
[16]MarréM T, Vergani P, Albergoni F G. Relationship between Fusaric acid uptake and its binding to cell structures in leaves of Egeria densa and its toxic effects on membrane permeability and respiration[J]. Physiological and Molecular Plant Pathology,1993,42:141-157.
[17]Bouizgarne B, Brault M, Pennarum A M, et al. Electrophysiological responses to Fusaric acid of root hairs from seedlings of date palm susceptible and resistant to Fusarium oxysporum f.sp. Albedinis[J]. Journal of Phytopathology,2004,152:321-324.
[18]Ye S F, Yu J Q, Peng Y H, et al. Incidence of Fusarium wilt in Cucumis sativus L. is promoted by cinnamic acid, an autotoxin in root exudates[J]. Plant and Soil,2004,263(2):43-150.
[19]Garcia- Maceira F I, DI Pietro A, Roncero M I G. Cloning and disruptionofpgx4encodinganinplantaexpressed exopolygalacturonasefromFusariumoxysporum[J].Molecular Plant-Microbe Interactions,2000,13:359-365.
[20]Inoue I, Namiki F, Tsuge T. Plant colonization of the vascular wilt fungus Fusarium oxysporum requires FOW1, a gene encoding a mitochondrial protein[J]. Plant Cell,2002,14:1869-1883.
[21]Ito S, Takahara H, Kawaguchi T, et al. Post-transcriptional silencing of the tomatinase gene in Fusarium oxysporum f.sp. lycopersici[J]. Journal of Phytopathology,2000,150:474-480.
[22]宋慧云,段志豪,韋嘉怡,等.多穗柯炭疽病病原鉴定及其不同杀菌剂的室内毒力测定[J].南方农业学报,2019(3):593-599.
[23]傅本重,王政又,伍建榕,等.美人蕉叶斑病病原菌的生物学特性及其抑菌药剂筛选[J].中国农学通报,2011,27(31):105-108.
[24]Sangalang A R, Burgess L W, Backhouse D, et al. Mycogeography of Fusarium species in soil from tropical, arid and Mediterranean regions ofAustralia[J]. Mycological Research,1995,99(5):523-528.
[25]Burgess L W, Summerel B A. Mycogeography of Fusarium: survey of Fusarium species from subtropical and semiarid grassland soils from Queensland, Australia[J]. Mycological Research,1992,96:480-484.
