癫痫清颗粒对阿尔茨海默病小鼠学习记忆能力的影响和作用机制研究
2021-01-25齐越李荧贾冬杨彩瑜房晓楠李纪彤
齐越 李荧 贾冬 杨彩瑜 房晓楠 李纪彤




[摘要] 目的 觀察癫痫清颗粒对AD小鼠模型BBB的影响。 方法 采用侧脑室注射Aβ复制AD模型。选取80只小鼠按体重随机分为假手术组,模型组,癫痫清颗粒12.48 g/kg组、6.24 g/kg组、3.12 g/kg组,盐酸多奈哌齐组,BD1047(sigma-1受体抑制剂)1 mg/kg组,BD1047+癫痫清颗粒12.48 g/kg组,每组各10只。假手术组和模型组给予蒸馏水,各给药组小鼠灌胃相应药物;同时BD1047组和BD1047+癫痫清12.48 g/kg组,则按照1 mg/kg的剂量腹腔注射给药,每日1次,连续给药21 d。末次给药后,Morris水迷宫检测小鼠的学习记忆能力;HE法观察脑组织病理学变化;硫黄素S染色检测脑组织中Aβ表达水平;Western blotting法测定海马和皮质中Occludin、ZO-1、Cx43、PI3K、p-PI3K、AKT、p-AKT蛋白表达水平。 结果 与模型组比较,BD1047+癫痫清颗粒12.48 g/kg组、癫痫清颗粒12.48 g/kg组、6.24 g/kg组及3.12 g/kg组及盐酸多奈哌齐组小鼠穿台次数、p-PI3K及p-AKT蛋白表达水平显著增加,Aβ表达水平降低,occludin、ZO-1及Cx43表达水平均显著升高,其余指标差异无统计学意义(P>0.05);各给药组小鼠脑组织病理变化均得到不同程度改善。 结论 癫痫清颗粒可激活sigma-1受体,通过PI3K/AKT信号途径,抑制Aβ表达,保护BBB完整性,改善AD学习记忆障碍。
[关键词] 阿尔茨海默病;血脑屏障;Sigma-1受体;小鼠;连接蛋白
[中图分类号] R969.4 [文献标识码] A [文章编号] 1673-9701(2021)32-0034-06
[Abstract] Objective To observe the effect of Dianxianqing particles on brain blood barrier(BBB) model of mice with Alzheimer′s disease(AD). Methods The AD model was replicated by lateral ventricular injection of amyloid β-protein (Aβ). A total of 80 mice were randomly divided into the sham-operated group, the model group, the Dianxianqing particles 12.48 g/kg group, the Dianxianqing particles 6.24 g/kg group, the Dianxianqing particles 3.12 g/kg group, the donepezil hydrochloride group, the BD1047(sigma-1 receptor inhibitor) 1 mg/kg group and the BD1047+Dianxianqing particles 12.48 g/kg group according to their body weight, with 10 mice in each group. The mice in the sham-operated group and the model group were given distilled water and the corresponding drugs were gavaged in each administration group. Meanwhile, the BD1047 group and the BD1047+Dianxianqing particles 12.48 g/kg group were administered intraperitoneally at a dose of 1 mg/kg once daily for 21 days. After the final administration, the learning and memory ability of mice was detected by Morris water maze test. The pathological changes of brain tissues were observed by hematoxylin-eosin staining(HE) method. The expression level of Aβ in brain tissue was detected by thioflavin S staining. The expression levels of occludin, zonula occludens-1(ZO-1), connexin 43 (Cx43), phosphatidylinositol 3-kinase (PI3K), p-PI3K, serine-threonine kinase (AKT) and p-AKT in hippocampus and cortex were determined by Western blotting. Results Compared with the model group, the number of platform crossings and the expression levels of p-PI3K and p-AKT significantly increased in the BD1047+Dianxianqing particles 12.48 g/kg group, the Dianxianqing particles 12.48 g/kg group, the Dianxianqing particles 6.24 g/kg group, the Dianxianqing particles 3.12 g/kg group and the donepezil hydrochloride group. Meanwhile, the expression level of Aβ decreased, and the expression levels of occludin, ZO-1 and Cx43 significantly increased. There were no statistically significant differences in the remaining indicators. The pathological changes in the brain tissues of mice were improved to different degrees in each administration group. Conclusion Dianxianqing particles can activate sigma-1 receptor, as well as inhibit Aβ expression and protect BBB integrity through PI3K/AKT signaling pathway, thus improving learning and memory impairment of mice with AD.
[Key words] Alzheimer′s disease; Blood brain barrier; Sigma-1 receptor; Mice; Connexin
阿尔茨海默病(Alzheimer′s disease,AD)为一种老年人常见的中枢神经系统退行性疾病,临床主要表现为学习记忆能力减退、认知功能障碍,并伴有神经精神异常和行为障碍。AD病因复杂,细胞外淀粉样蛋白(Amyloid,Aβ)沉积被认为是AD的主要病理学特征[1],并与血脑屏障(Blood-brain barrier,BBB)破坏密切相关[2]。动物和临床研究表明,BBB功能障碍是AD的病理结果,并会加速其疾病进展[3-4]。因此,阻止Aβ诱导的BBB破坏对于AD治疗较为重要。
Sigma-1受体是一种伴侣蛋白,在中枢神经系统中广泛表达,主要位于内质网和线粒体相关的内质网膜内[5]。由于其功能复杂,故参与多种神经系统疾病的病理生理过程,如AD、亨廷顿病、抑郁症等[6]。最近的研究表明,Sigma-1受体表达的改变对BBB内皮细胞的活力和迁移具有深远的影响[7-8]。癫痫清颗粒为专利药(专利号:ZL 2011 1 0069494),由郁金、菖蒲、柴胡、水蛭等多味中药组成,具有豁痰息风、活血通络、开窍益智的功效。前期研究表明,癫痫清颗粒可通过抑制Aβ沉积和tau蛋白磷酸化,改善AD模型小鼠的学习记忆障碍[9],但是否具有保护BBB完整性的作用则尚不清楚。因此,本实验采用侧脑室注射Aβ诱导AD模型以此考察癫痫清颗粒是否通过sigma-1抑制Aβ沉积调节BBB完整性,并探讨其相关机制,为癫痫清颗粒的临床应用提供夯实的实验基础。
1 资料与方法
1.1 一般资料
1.1.1 仪器 脑立体定位仪(成都泰盟科技公司,型号:DW-200);微量进样器(上海安亭微量进样器厂,规格:10 μL);Y迷宫(辽宁中医康复中心);Morris水迷宫(成都泰盟科技公司,型号:MT-200)。
1.1.2 药物与试剂 癫痫清颗粒(辽宁中医药大学附属第二医院,批号20140110,规格:生药含量为5.31 g生药/g);盐酸多奈哌齐片[卫材(中国)药业有限公司,批号140 606 A,规格:5 mg] ;BD1047(TOCRIS公司,货号:138356-21-5);淀粉样蛋白(Aβ25-35,美国Sigma公司,货号;A4559);兔抗磷脂酰肌醇3激酶(Phosphatidylinositol 3 kinase,PI3K)多克隆抗体(批号:GR3245955-1)均购自美国Abcam公司,兔抗磷酸化PI3K(Phospho-phosphatidylinositol 3 kinase,p-PI3K)多克隆抗体(批号:bs-6417R),兔抗絲氨酸/苏氨酸蛋白激酶(Protein kinase B,AKT)多克隆抗体(bs-10724R),兔抗磷酸化AKT(Phospho-protein kinase B,p-AKT)多克隆抗体(批号:bs-0876R),兔抗肌动蛋白(β-actin)多克隆抗体(bs-10966R)均购自北京博奥森生物技术有限公司,兔抗紧密连接蛋白(occludin)多克隆抗体(批号:L02141996)、兔抗胞质附着蛋白-1(tight junction protein 1, ZO-1)多克隆抗体(批号:H09253419)、兔抗连接蛋白43(Connexin-43,Cx43)多克隆抗体(批号:I06142837)均购自沈阳万类生物科技有限公司,硫磺素-S(美国Sigma公司,批号;MKCC1990),二喹啉甲酸蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号:120219200821);其余试剂均为分析纯,水为纯净水。
1.1.3 动物 SPF级健康ICR雄性小鼠80只,体重20~24 g,由辽宁长生生物技术有限公司提供,实验动物生产合格证号:SCXY(辽)2015-0001。所有受试动物均饲养于辽宁中医药大学实验动物中心,分笼饲养,每笼5只,饲养室温度为20~23℃、相对湿度为50%~60%。本研究经辽宁中医药大学动物伦理委员会批准,实验操作符合《中华人民共和国实验动物管理条例》要求。
1.2 方法
1.2.1 AD模型制备 参考文献方法并加以改进[10]。小鼠给予350 mg/kg的水合氯醛麻醉后,固定予脑立体定位仪上,剪毛,常规碘伏酒精消毒,手术刀纵向切开头部皮肤长约2 cm,以囟门为原点,向右移动1 mm,后移动0.5 mm,作为侧脑室的体表投射点,微量进样器垂直进针,深度为3 mm,缓慢注射3 μL老化的Aβ25-35(1 mg Aβ25-35溶解到940 μL生理盐水中,37℃孵育120 h),弥散5 min。伤口消毒后,缝合,置于鼠笼中饲养,注意术后保暖。假手术组注射等体积无菌生理盐水。在实验造模及给药过程中对大鼠进行一般状况观察,并对死亡情况进行记录。
1.2.2 分组及给药 小鼠适应性饲养1周后,按体重随机分为假手术组(n=10)和模型组(n=70)。模型组小鼠按“2.1”项下操作复制AD模型;假手术组小鼠麻醉后侧脑室注射无菌生理盐水,其余步骤同造模组(腹腔注射的均为生理盐水)。造模过程中,无小鼠死亡,参考文献的造模成功标准[10],70只小鼠全部造模成功。将70只小鼠按体重随机分为模型组、癫痫清颗粒高、中、低剂量组(12.48、6.24、3.12 g/kg,以生药量计)、盐酸多奈哌齐组(灌胃给药1.3 g/kg)、sigma-1R抑制剂(BD1047,腹腔注射1 mg/kg)和癫痫清颗粒组(12.48 g/kg,以生药量计)+BD1047组(腹腔注射1 mg/kg)。各给药组小鼠灌胃相应药物,药物用蒸馏水进行溶解稀释,假手术组与模型组小鼠均给予灌胃相应体积的蒸馏水;每日给药1次,连续21 d,给药体积为20 mL/kg。癫痫清颗粒组:按癫痫清颗粒临床人用量每日24 g计,小鼠用量为24 g×0.0026(20 g小鼠与70 kg人的系数比)×50=3.12 g/kg(以生药量计),为临床等效量作为低剂量;2倍量(6.24 g/kg,以生药量计),作为中剂量;4倍量(12.48 g/kg,以生药量计)作为高剂量;盐酸多奈哌齐组:按盐酸多奈哌齐人用量10 mg计,小鼠用量为10 mg×0.0026(20 g小鼠与70 kg人的系数比)×50=1.3 mg/kg;BD1047组:小鼠用量为参考文献用量[11]。
1.3 观察指标
1.3.1 水迷宫实验 Morris水迷宫为直径80 cm、高33 cm的白色圆桶状装置。将水迷宫装置分为四个等面积的扇形区域,分别记为第一至第四象限。平台为俯视圆形,侧视工形的白色金属装置。平台位于第一象限扇形区域中间位置。桶内装水,水中混匀可食用白色素掩盖平台位置,保持水面高于平台1 cm。第16天至第20天,为小鼠训练时间,每天游泳两次,间隔4 h。第21天为空间探索实验,记录小鼠穿越平台的次数。
1.3.2 脑组织病理形态学观察 行为学实验结束,每组随机选取6只小鼠进行苏木精-伊红(Hematoxylin-eosin staining,HE)染色。小鼠快速取脑后,将其固定于4%多聚甲醛中,浸泡24 h。石蜡切片常规脱蜡脱水后制备切片(切片厚度为4 μm),进行HE染色,光学显微镜下观察脑组织的病理形态学变化。
1.3.3 脑组织内Aβ表达的测定 4 μm厚的石蜡切片来源于“2.4”项下的小鼠脑组织切片。石蜡切片脱蜡至水,自来水冲洗;磷酸盐(PBS)缓冲液冲洗2 次,每次5 min;切片置于3%过氧化氢中10 min以灭活内原性酶;PBS缓冲液冲洗3次,每次5 min;1%硫黄素-S乙醇溶液避光孵育10 min,PBS缓冲液冲洗3次,每次10 min,JEOA801D形态学图像分析系统计算各组阳性细胞平均光密度值。
1.3.4 脑组织中PI3K、p-PI3K、AKT、p-AKT、occludin、ZO-1及Cx43的测定 每组随机选取4只小鼠,在小鼠的脑组织中加入高效的裂解液后,匀浆,12 000 r/min(4°C)离心20 min,二喹啉甲酸法测定蛋白浓度。总蛋白为40 μg进行十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳,再以恒流电转的方式转移至聚偏二氟乙烯膜上(100 mA、2 h)。用5%的脱脂奶粉进行室温封闭2 h后,加入PI3K(1∶500)、p-PI3K(1∶400)、AKT(1∶500)、p-AKT(1∶300)、Occludin(1∶300)、ZO-1(1∶200)、Cx43(1∶300)和β-actin(1∶1000)一抗,4°C孵育过夜,PBS洗膜,每次10 min,连续3次;加入二抗(1∶5000),室温内孵育2 h,PBS洗膜,每次10 min,连续3次。加入ECL发光液进行曝光,采用Image J V1.8.0.112图像分析软件进行灰度值分析,以目标蛋白条带灰度值与内参β-actin条带灰度值的比值表示目标蛋白的相对表达水平。
1.4 统计学方法
采用SPSS 17.0统计学软件进行数据分析。计量资料以(x±s)表示,首先对数据进行正态性检验。符合正态分布的数据,多组间比较采用单因素方差分析,若方差齐性则采用LSD检验进行组间两两比较,若方差不齐性则采用Dunnett′s T3检验进行组间两两比较。若不符合正态分布,则采用非参数检验进行统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况观察结果
造模后,假手术组小鼠饮食进水及活动度良好,精神状态正常;模型组小鼠出现精神萎靡、倦怠懒动、目光迟滞等情况。灌胃给药后,各给药组小鼠的精神状况及活动度有所增加,而模型组小鼠一般情况无明显变化。
2.2 水迷宫实验结果
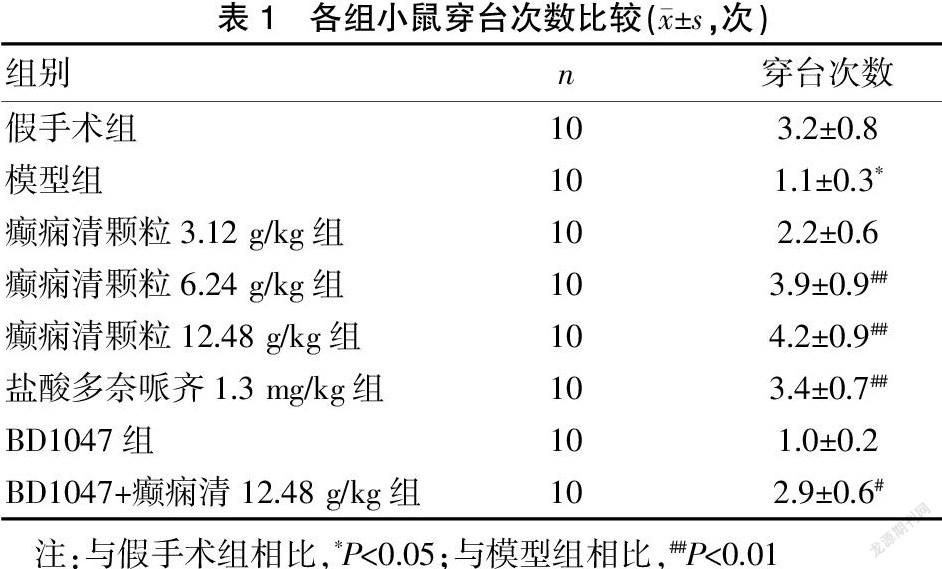
与假手术组相比,模型组小鼠穿越平台的次数减少,差异有统计学意义(P<0.05)。与模型组相比,癫痫清颗粒6.24、12.48 g/kg剂量组、盐酸多奈哌齐组和BD1047+癫痫清12.48 g/kg组穿越平台的次数增加,差异有统计学意义(P<0.01)。与模型组比较,BD1047组穿越平台次数无明显差异(P>0.05)。见表1。
2.3 脑组织病理形态学观察结果
假手术组小鼠脑组织海马区神经元排列有序,细胞核清晰,核仁明显,胞浆着色均匀,未见坏死和炎症细胞浸润;模型组小鼠脑组织海马区神经元排列紊乱,细胞间隙増宽,胞体形状不规则,胞质嗜酸性增强,核固缩明显,可见不同程度的神经元变性坏死;癫痫清颗粒高、中、低剂量组可见小鼠脑组织海马区神经元形态呈现轻、中、重的变化;盐酸多奈哌齐组可见小鼠脑组织神经元细胞排列整齐,锥体细胞排列紧密;BD1047组可见小鼠脑组织海马区神经元排列紊乱,胞质嗜酸性增强,胞核固缩、溶解、消失;BD1047+癫痫清12.48 g/kg组可见小鼠脑组织海马区神经元与周围组织的间隙减小,散在的神经元减少,锥体细胞排列紧密,可见少量核固缩。见封三图2。
2.4 各组小鼠Aβ表达结果
为了明确癫痫清颗粒对AD模型小鼠脑内病理特征的影响,本实验采用硫黄素S染色检测Aβ在AD模型小鼠脑组织中的表达。結果显示,在假手术组中未观察到阳性染色的Aβ斑块。与假手术组相比,模型组和BD1047组小鼠阳性染色的Aβ斑块数量和面积均明显增加(P<0.01)。与模型组相比,盐酸多奈哌齐组、癫痫清颗粒6.24、12.48 g/kg剂量组及BD1047+癫痫清12.48g/kg组小鼠脑组织内Aβ斑块的阳性染色明显减少(P<0.05,P<0.01)。见封三图3、表2。
2.5 各组小鼠BBB中连接蛋白表达的结果
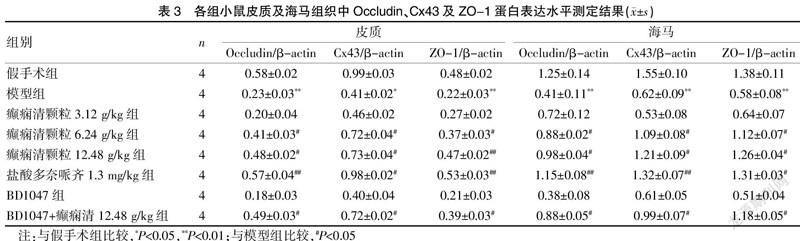
本实验采用Western bolt法检测皮质和海马部位连接蛋白的表达。结果显示,与假手术组比较,模型组Occludin、Cx43及ZO-1的表达明显降低,差异有统计学意义(P<0.05)。与模型组相比,癫痫清颗粒6.24、12.48 g/kg剂量组和盐酸多奈哌齐组Occludin、Cx43及ZO-1的表达明显增加,差异有统计学意义(P<0.05)。与模型组相比,BD1047组Occludin、Cx43及ZO-1的表达无显著性差异(P>0.05)。与模型组相比,BD1047+癫痫清12.48 g/kg组皮质部位Occludin、Cx43及ZO-1的表达显著增加,但相比癫痫清颗粒12.48 g/kg剂量组略有减少。见图1、表3。
2.6 各组小鼠脑组织中PI3K、p-PI3K、AKT及p-AKT蛋白表达水平测定结果
与假手术组比较,模型组皮质和海马部位的p-PI3K、p-AKT表达显著降低(P<0.05),PI3K及AKT蛋白表达水平比较,差异无统计学意义(P>0.05),与模型组相比,癫痫清颗粒6.24、12.48 g/kg剂量组和盐酸多奈哌齐组皮质和海马部位的p-PI3K、p-AKT表达明显增加(P<0.05)。与模型组相比,癫痫清颗粒3.12 g/kg剂量组、BD1047组和BD1047+癫痫清12.48 g/kg组p-PI3K和p-Akt的表达无显著性差异,但BD1047+癫痫清12.48 g/kg组PI3K和p-AKT的水平略有增加,但差异无统计学意义(P>0.05)。见图2、表4。
3 讨论
AD虽然历经了上百年的研究,但发病机制仍不明确。目前为止,较为公认的“β淀粉样蛋白级联假说”认定Aβ为导致AD复杂病理事件的始动因素,是AD发生发展的核心,且与BBB完整性密切相关。在生理情况下,完整的BBB功能可以促进Aβ清除,阻止外周Aβ向脑内转移,避免Aβ的毒性聚集。但当BBB的渗透性升高时则会造成Aβ的清除减少、Aβ积累和神经原纤维缠结的增加。更为重要的是,增加的Aβ神经毒性又进一步破坏BBB的结构基础、分子调控以及免疫应答等,形成恶性循环,加剧BBB损害。因此,抑制Aβ沉积导致的BBB破坏,对于早期发现潜在的AD人群及对AD致病机制的深入研究均有重大意义。
BBB是由脑微血管内皮细胞、紧密连接、星形胶质细胞终足、周细胞和基底膜共同构成的选择透过性细胞屏障系统,主要包括闭合蛋白、连接蛋白(Cx43,ZO-1,occludin)等[12]。AD患者Cx43、ZO-1、Occludin表达减少,BBB通透性增加[13],学习记忆能力下降;APP/PS1小鼠脑中ZO-1表达显著降低,BBB发生损伤[14];Occludin敲除基因小鼠可表现出严重的BBB渗漏[15]。以上研究均说明,连接蛋白的表达与BBB功能有关,并影响学习记忆能力。Aβ主要在与认知活动密切相关的脑区富集,如大脑皮层和海马等,且与BBB密切相关[16],Aβ沉积增加,则BBB通透性增强。因此,本实验参考Aβ斑块密度最大的两个区域,即皮质、海马部位,检测BBB紧密连接蛋白的表达。盐酸多奈哌齐具有改善AD模型小鼠行为学的作用,且可抑制Aβ沉积,广泛应用于AD的治疗[17]。故本研究选用盐酸多奈哌齐作为阳性对照药。Sigma-1R是一类区别于G蛋白偶联和离子型受体的细胞内蛋白质,广泛存在于中枢神经系统的神经元、神经胶质细胞和相关的免疫和内分泌组织中。本文的前期研究表明,sigma-1受体活化后可抑制Aβ沉积,降低BBB通透性,改善学习记忆障碍(数据未见报道),说明sigma-1受体与BBB密切相关。本研究在AD小鼠模型的基础上给予sigma-1受体抑制剂BD1047发现,根据表3数据表示,与模型组相比,BD1047组皮质、海马部位Cx43、ZO-1、Occludin表达、Aβ沉积无明显差异,而BD1047与癫痫清颗粒联用后,与模型组相比,小鼠穿越平台次数增加,皮质、海马部位Cx43、ZO-1、Occludin表达提高,Aβ沉积减少,说明癫痫清颗粒通过激活sigma-1受体抑制Aβ沉积,降低BBB通透性,改善AD模型小鼠学习记忆能力。
PI3K是由调节亚基p85和催化亚基p110所组成的异二聚体。AKT也叫蛋白激酶B,是PI3K的下游效应分子。PI3K磷酸化使质膜上生成第二信使,进而激活AKT蛋白中的苏氨酸磷酸化位点。PI3K/Akt作为细胞内信号传导通路之一,参与调节细胞增殖、生长、衰老、凋亡等过程[18]。研究表明,激活PI3K/Akt信号通路后,可增加Occludin水平,降低BBB通透性[19]。在本研究中,根据表4结果显示,与模型组相比,BD1047组小鼠的p-PI3K及p-AKT表達水平无明显差异,BD1047与癫痫清颗粒联用后,与模型组相比,p-PI3K及p-AKT表达增加,PI3K及AKT表达未见明显变化。
综上所述,癫痫清颗粒具有改善AD模型小鼠BBB损伤的作用,其机制可能与激活sigma-1受体、通过PI3K/Akt通路抑制Aβ沉积有关。
[参考文献]
[1] Krauser DL,Muller N. Neuroinflammation,microglia and implications for anti-inflammatory treatment in Alzheimer's disease[J]. J Alzheimers Dis,2010,2010(1):5429-5438.
[2] Parachikova A,Nichol KE,Cotman CW. Short-term exercise in aged Tg2576 mice alters neuroinflammation and improves cognition[J]. Neurobiol Dis,2008,30(1):121-129.
[3] Langen UH,Ayloo S,Gu C. Development and cell biology of the blood-brain barrier[J]. Annual Rev Cell Dev Bi,2019,35(1):591-613.
[4] Sagare AP,Bell RD,Zhao Z,et al. Pericyte loss influences Alzheimer-like neurodegeneration in mice[J]. Nat Commun,2013,4(1):193-215.
[5] Mori T,Hayashi T,Hayashi E,et al. Sigma-1 receptor chaperone at the ER-mitochondrion interface mediates the mitochondrion-ER-nucleus signaling for cellular survival[J]. PLos One,2013,8(10):e76 941.
[6] Ryskamp D,Wu J,Geva M,et al. The sigma-1 receptor mediates the beneficial effects of pridopidine in a mouse model of Huntington disease[J]. Neurobio Dis,2017,97(Pt A):46-59.
[7] Christ MG,Huesmann H,Nagel H,et al. Sigma-1 receptor activation induces autophagy and increases proteostasis capacity in vitro and in vivo[J]. Cells,2019,8(3):211.
[8] Olivieri M,Amata E,Vinciguerra S,et al. Antiangiogenic effect of(±)-haloperidol metabolite Ⅱ valproate ester [(±)-MRJF22] in human microvascular retinal endothelial cells[J]. J Med Chem,2016,59(21):9960-9966.
[9] 康凯. 癫痫清颗粒对阿尔茨海默病模型小鼠Tau蛋白磷酸化及Aβ产生的影响[D].沈阳:辽宁中医药大学,2017.
[10] 黄寓,康凯,齐越,等. 癫痫清颗粒对 Aβ(25-35)所致阿尔茨海默病小鼠模型学习记忆的影响[J]. 辽宁中医药大学学报,2016,18(7):29-32.
[11] Liu DY ,Chi TY,Ji XF,et al. Sigma-1 receptor activation alleviates blood-brain barrier dysfunction in vascular dementia mice[J]. Exp Neurol,2018,308:90-99.
[12] Huang ZS,Wong LW,Su YX,et al. Blood-brain barrier integrity in the pathogenesis of Alzheimer’s disease[J]. Front Neuroendocrin,2020,59:100 857.
[13] Chalbot S,Zrtterberg H,Blennow K,et al.Blood-cerebrospinal fluid barrier permeability in Alzheimer's disease[J]. J Alzheimers Dis,2011,25(3):505-515.
[14] Xie YN,Yan LL,Zeng HT,et al. Fish oil protects the blood-brain barrier integrity in a mouse model of Alzheimer’s disease[J]. Chin Med-UK,2020,15(10):698-712.
[15] Zhong XQ,Luo CJ,Deng MZ,et al.Scutellarin-treated exosomes increase claudin 5,occludin and ZO1 expression in rat brain microvascular endothelial cells[J]. Exp Ther Med,2019,18(1):33-40.
[16] 龍犇,李向宁,张建平,等.β淀粉样蛋白斑块的高分辨全脑三维定量研究[J].中国科学:生命科学,2019,49(2):140-150.
[17] Qi Y,Ji XF,Chi TY,et al. Xanthoceraside attenuates amyloid β peptide1-42-induced memory impairments by reducing neuroinflammatory responses in mice[J]. Eur J Pharmacol,2018,820:18-30.
[18] 梁德凤,周鑫才,吴芸菲. 二甲双胍调节PI3K/AKT通路对高糖诱导牙周膜成纤维细胞凋亡的影响研究[J]. 口腔医学研究,2020,36(12):1103-1107.
[19] Wang W,Dentler W L,Borchardt RT,et al. VEGF increases BMEC monolayer permeability by affecting occludin expression and tight junction assembly[J]. Am J Physiol Heart Circ Physiol,2001,280(1):434-440.
(收稿日期:2021-05-07)
