miR-6838-5p抑制卵巢癌细胞增殖和迁移的分子机制研究
2021-01-21胡翠芳陈梦雨黄寅虎
胡翠芳,陈梦雨,黄寅虎,王 婧,邱 英
(陆军军医大学大坪医院妇产科,重庆 400042;*通讯作者,E-mail:aloukti@126.com)
卵巢癌是全世界最常见的妇科肿瘤之一,尽管卵巢癌的诊断和治疗得到较大的进展,然而卵巢癌患者的5年生存率仍然很低[1,2]。卵巢癌发生、发展的机制尚未阐明,深入探讨卵巢癌的分子机制对卵巢癌的临床诊疗方案具有重要意义。微小RNA(miRNA)是一种内源性的非编码小分子RNA,与恶性肿瘤细胞的浸润、增殖、转移等行为有关,参与恶性肿瘤的发生、发展[3,4]。越来越多的研究表明,miRNA可作为卵巢癌的分子标志物和治疗靶点,为卵巢癌的临床诊疗提供新的思路[5,6]。有研究显示,miR-6838-5p在三阴性乳腺癌细胞系表达水平降低,是一种肿瘤抑制因子[7]。迄今为止,miR-6838-5p在其他肿瘤如卵巢癌中的调控作用研究甚少。本研究旨在观察miR-6838-5p在卵巢癌中是否存在异常表达,探讨miR-6838-5p影响卵巢癌细胞增殖和迁移的分子机制,为临床上卵巢癌的基因治疗提供新的治疗靶点。
1 材料和方法
1.1 标本来源
选择2018年3月至2019年11月于我院行手术切除且经病理确诊的39例卵巢癌及癌旁组织。患者平均年龄(52.31±7.12)岁,患者术前均未接受放化疗或其他辅助治疗。本研究通过了本院伦理委员会批准,患者均签署了知情同意书。
1.2 细胞株和实验试剂
5种卵巢癌细胞株(OC3、SKOV-3、OVCAR-3、A2780、HO-8910)和正常卵巢上皮细胞株(IOSE80)购自美国ATCC公司。DMEM培养基、RPMI-1640培养基、胎牛血清(FBS)购自美国Gibco公司。qRT-PCR试剂盒购自日本TaKaRa公司。Transwell小室购自美国Corning公司。双荧光素酶报告基因检测试剂盒、miR-6838-5p模拟物、NC模拟物、PPM1D mRNA野生型质粒和突变型质粒购自上海赛默飞世尔科技有限公司。引物购自上海生工生物科技服务有限公司。CCK-8试剂盒、BCA蛋白浓度测定试剂盒、结晶紫染液购自上海碧云天生物科技有限公司。Lipofectamine 3000转染试剂盒购自美国Invitrogen公司。抗β-actin、PPM1D、MAPK、p-ERK、p-JNK抗体均购自美国Santa Cruze公司。
1.3 细胞培养和转染
OC3、OVCAR-3细胞在体积分数为10%胎牛血清的RPMI-1640培养基培养,IOSE80、SKOV-3、A2780、HO-8910细胞在体积分数为10%胎牛血清的DMEM培养基培养,于37 ℃、5%CO2培养箱培养。根据处理方法不同将OVCAR-3细胞分为两组,根据Lipofectamine 3000说明书进行转染。阴性对照组:转染NC模拟物;miR-6838-5p组:转染miR-6838-5p模拟物。转染后继续培养48 h,进行后续实验。
1.4 实时荧光定量PCR(qRT-PCR)检测miR-6838-5p和PPM1D mRNA的相对表达量
采用Trizol法分别提取组织及细胞总RNA,逆转录得到cDNA,qRT-PCR扩增检测组织或细胞miR-6838-5p和PPM1D mRNA的表达水平。miR-6838-5p以U6为内参,PPM1D mRNA以GAPDH为内参。qRT-PCR扩增引物序列见表1。qRT-PCR反应体系和条件参照说明书进行操作,miR-6838-5p和PPM1D mRNA的相对表达量根据2-ΔΔCt方法计算。

表1 qRT-PCR扩增引物序列
1.5 CCK-8法检测OVCAR-3细胞增殖
将转染后的各组OVCAR-3细胞以3×103个/孔接种于96孔板,每孔培养基200 μl,每组设置4个复孔。每孔加入20 μl CCK-8溶液,于37 ℃、5%CO2培养箱避光培养3 h,酶标仪测定每孔在450 nm波长处的吸光度值。每天测1次,连续测5 d,实验重复4次。
1.6 Transwell迁移实验检测OVCAR-3细胞迁移
收集转染后的各组OVCAR-3细胞,用不含FBS的RPMI-1640培养基重悬至5×105个/ml,取200 μl细胞悬液接种于Transwell上室,下室加入含FBS的RPMI-1640培养基600 μl,每组设置4个复孔,于37 ℃、5%CO2培养箱培养24 h。用4%多聚甲醛固定30 min,用0.2%结晶紫溶液染色30 min,棉签擦去膜上层的细胞。倒置显微镜下计数膜下层的细胞数并拍照,实验重复4次。
1.7 生物信息学技术和双荧光素酶报告基因实验
采用miRGator、microRNA.org、miRNApath等生物信息学软件预测miR-6838-5p的靶基因。构建靶基因野生型质粒和突变型质粒,将OVCAR-3细胞接种于96孔板,分别将野生型质粒、突变型质粒与miR-6838-5p模拟物或NC模拟物共转染至OVCAR-3细胞,于37 ℃、5%CO2培养箱培养48 h,使用双荧光素酶报告基因检测试剂盒分析萤火虫荧光素酶活性和海肾荧光素酶活性。
1.8 Western blot检测OVCAR-3细胞中PPM1D蛋白表达
收集转染后的各组OVCAR-3细胞,于冰上裂解细胞并提取总蛋白。BCA蛋白浓度测定试剂盒检测蛋白浓度,各组取等量蛋白样品进行十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳,转膜至PVDF膜,在5%脱脂牛奶中封闭1 h。TBST溶液洗膜后,加入一抗β-actin(1 ∶2 000)、PPM1D(1 ∶1 000)、MAPK(1 ∶1 000)、p-ERK(1 ∶1 000)、p-JNK(1 ∶1 000),4 ℃过夜孵育。TBST溶液洗膜后,加入二抗(1 ∶5 000),以ECL显影液化学发光,在暗室成像拍照。
1.9 统计学处理

2 结果
2.1 miR-6838-5p在卵巢癌组织和细胞株中的表达水平
qRT-PCR结果显示,miR-6838-5p在卵巢癌组织和癌旁组织中相对表达水平分别为1.16±0.31和5.23±0.65。与癌旁组织相比,卵巢癌组织中miR-6838-5p表达水平降低(P<0.01,见图1)。与正常卵巢上皮细胞株(IOSE80)相比,miR-6838-5p的表达水平在各卵巢癌细胞株中均降低(P<0.05),其中在OVCAR-3细胞株中表达最低(P<0.01,见图2)。

与癌旁组织相比,**P<0.01图1 卵巢癌组织和癌旁组织中miR-6838-5p表达Figure 1 The expression of miR-6838-5p in ovarian cancer tissues and adjacent tissues

与IOSE80细胞株相比,*P<0.05,**P<0.01图2 卵巢癌细胞株和正常卵巢上皮细胞株中miR-6838-5p表达Figure 2 The expression of miR-6838-5p in ovarian cancer cell lines and normal ovarian epithelial cell lines
2.2 转染后miR-6838-5p的表达
阴性对照组和miR-6838-5p组OVCAR-3细胞miR-6838-5p相对表达水平分别为1.00±0.05和9.72±0.82。与阴性对照组相比,miR-6838-5p组miR-6838-5p表达水平升高(P<0.01),表明miR-6838-5p模拟物转染成功。
2.3 过表达miR-6838-5p抑制OVCAR-3细胞增殖
CCK-8法显示,第2,3,4,5天,miR-6838-5p组OVCAR-3细胞吸光度值明显低于阴性对照组(P<0.05,见图3),表明过表达miR-6838-5p可抑制OVCAR-3细胞增殖。
2.4 过表达miR-6838-5p抑制OVCAR-3细胞迁移
Transwell迁移实验显示,阴性对照组和miR-6838-5p组膜下层细胞数分别为(142.60±10.90)个和(53.82±9.35)个。与阴性对照组相比,miR-6838-5p组迁移的细胞数低于阴性对照组(P<0.01,见图4),表明过表达miR-6838-5p可抑制OVCAR-3细胞迁移。

与阴性对照组相比,*P<0.05,**P<0.01图3 过表达miR-6838-5p对OVCAR-3细胞增殖的影响Figure 3 The effect of miR-6838-5p overexpression on the proliferation of OVCAR-3 cells
2.5 生物信息学技术预测miR-6838-5p的靶基因
miRGator、microRNA.org、miRNApath等软件预测显示,miR-6838-5p的靶基因可能是PPM1D,miR-6838-5p与PPM1D mRNA互补序列见图5。
2.6 miR-6838-5p对PPM1D mRNA靶向调控验证
双荧光素酶报告基因实验显示,与共转染野生型质粒+NC模拟物相比,共转染野生型质粒+miR-6838-5p模拟物的相对荧光素酶活性明显降低(P<0.01)。与共转染突变型质粒+NC模拟物相比,共转染突变型质粒+miR-6838-5p模拟物的相对荧光素酶活性差异无统计学意义(P>0.05,见图6),表明miR-6838-5p和PPM1D mRNA能够靶向结合。

与阴性对照组相比,**P<0.01图4 过表达miR-6838-5p对OVCAR-3细胞迁移的影响Figure 4 The effect of miR-6838-5p overexpression on the migration of OVCAR-3 cells

图5 miR-6838-5p与PPM1D mRNA互补的序列Figure 5 The complementary sequence of miR-6838-5p and PPM1D mRNA
2.7 转染后PPM1D mRNA的表达
qRT-PCR实验显示,阴性对照组和miR-6838-5p组OVCAR-3细胞中PPM1D mRNA表达分别为1.02±0.12和0.24±0.08,两组间比较差异有统计学意义(P<0.01),表明miR-6838-5p可抑制PPM1D mRNA的表达。
2.8 过表达miR-6838-5p对PPM1D蛋白表达的影响
Western blot实验显示,过表达miR-6838-5p后,OVCAR-3细胞中PPM1D蛋白表达降低,MAPK信号通路中MAPK、p-ERK、p-JNK表达水平显著降低(见图7)。

与野生型+NC相比,**P<0.01图6 miR-6838-5p与PPM1D mRNA双荧光素酶报告基因实验结果Figure 6 Results of dual luciferase reporter gene of miR-6838-5p and PPM1D mRNA
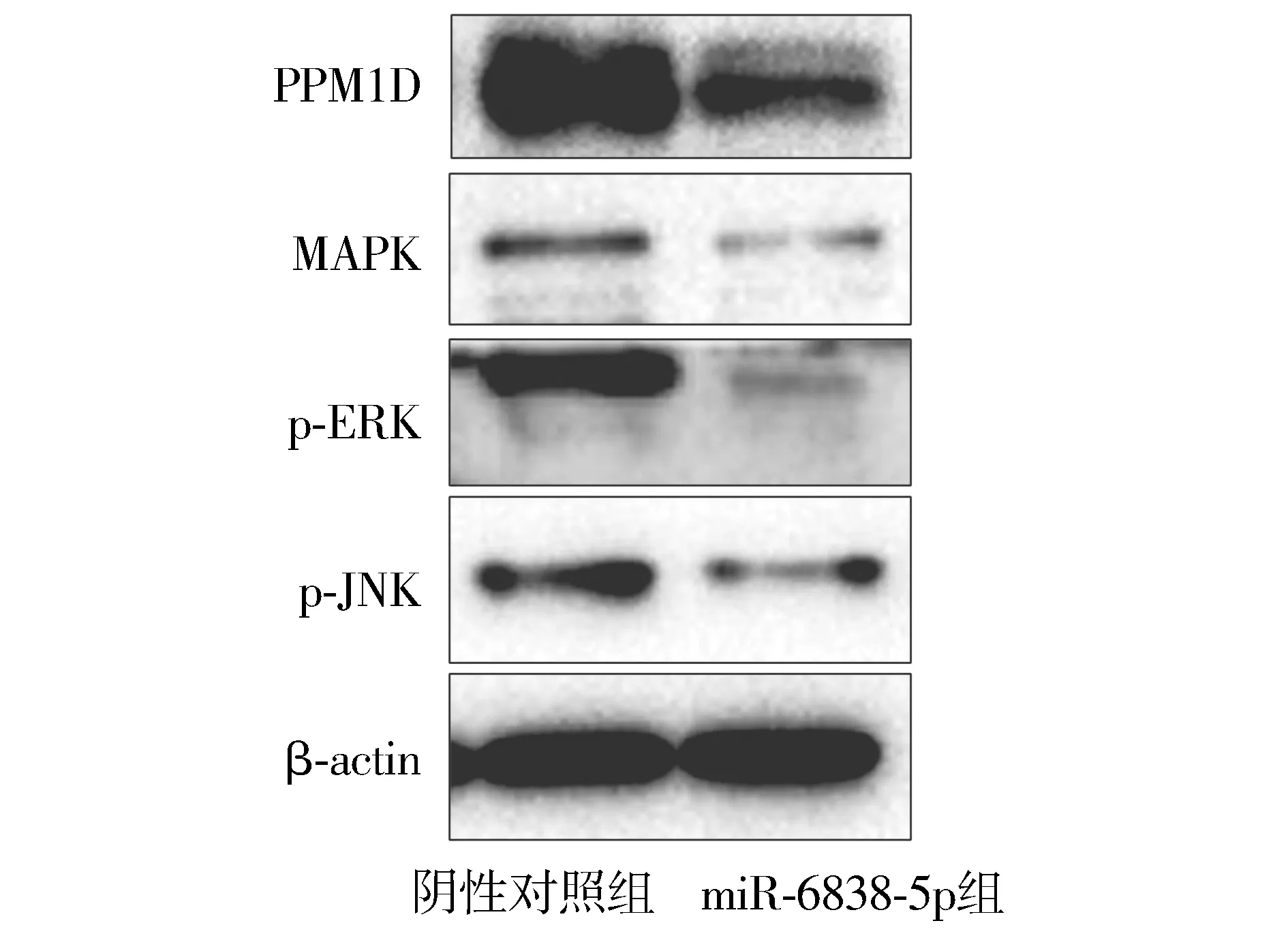
图7 过表达miR-6838-5p对OVCAR-3细胞PPM1D蛋白表达的影响Figure 7 The effect of miR-6838-5p overexpression on PPM1D protein expression in OVCAR-3 cells
3 讨论
微小RNA(miRNA)通过与靶基因mRNA的3′非翻译区(3′-UTR)互补结合,在转录后层面抑制靶基因的表达,调节细胞分化、增殖、凋亡、转移等多种生理过程,参与疾病的发生、发展,与肿瘤的形成密切相关[8,9]。大量研究表明,miRNA如miR-205、miR-758-3p、miR-145、miR-200c、miR-128在卵巢癌中表达水平降低或增加,通过靶向调节某些关键癌基因或抑癌基因,在卵巢癌的各种恶性生物学行为中扮演重要角色[10-13]。Liu等[7]研究发现,miR-6838-5p在三阴性乳腺癌中表达水平降低,通过调节下游靶基因表达影响Wnt信号通路活化,抑制三阴性乳腺癌细胞的增殖和上皮间充质转化,低表达miR-6838-5p促进三阴性乳腺癌细胞的增殖和转移,miR-6838-5p具有抑癌性。
本研究发现,miR-6838-5p在卵巢癌组织中相对表达水平显著低于癌旁组织。与正常卵巢上皮细胞相比,miR-6838-5p的表达水平在各卵巢癌细胞系中均明显降低。本研究进一步发现,过表达miR-6838-5p后,卵巢癌OVCAR-3细胞的增殖能力和迁移能力均减弱。以上结果表明,miR-6838-5p在卵巢癌中是一种抑癌基因。miRNA对肿瘤细胞生物学行为的调控作用,取决于miRNA的靶基因[14]。miRNApath、microRNA.org、miRGator等软件预测显示,PPM1D可能是miR-6838-5p的靶基因。进一步探讨miR-6838-5p与PPM1D的靶向关系,双荧光素酶报告基因实验结果发现miR-6838-5p与PPM1D mRNA存在互补结合位点,miR-6838-5p能够靶向结合PPM1D mRNA,PPM1D是miR-6838-5p的靶基因。PPM1D基因位于染色体17q23.3区域,PPM1D蛋白是一种具有丝/苏氨酸酶活性的蛋白磷酸酶,包含605个氨基酸[15]。多种实体肿瘤如乳腺癌、非小细胞肺癌、卵巢癌、甲状腺乳头状癌、结肠癌中均检测到PPM1D蛋白表达增加,敲除PPM1D基因可通过阻滞MAPK信号通路,显著抑制肿瘤细胞的增殖、迁移和侵袭,促进细胞凋亡,表明PPM1D基因是一种癌基因[16-19]。MAPK信号通路在调控卵巢癌细胞发生、发展过程中异常激活,与患者的不良预后相关[20]。Western blot结果显示,过表达miR-6838-5p后,MAPK信号通路中MAPK、p-ERK、p-JNK表达水平显著降低,表明miR-6838-5p可通过靶向PPM1D抑制MAPK信号通路的激活。
综上所述,miR-6838-5p在卵巢癌组织和细胞株中表达水平降低,miR-6838-5p作为抑癌基因可靶向调控PPM1D基因的表达,抑制MAPK信号通路的激活,抑制卵巢癌OVCAR-3细胞的增殖和迁移,本研究可能为卵巢癌的分子靶向治疗提供一定实验基础。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
