ARHI基因对胃癌细胞株MKN28增殖、侵袭、凋亡的影响及其机制研究
2020-02-14张晓威
张晓威
张晓威, 锦州医科大学附属第一医院 辽宁省锦州市 121000
核心提要: 本实验创新性的构建pcDNA3.1-ARHI质粒,通过细胞转染技术转染MKN28细胞株,研究结果提示:ARHI基因过表达可抑制胃癌细胞MKN28的增殖, 促进细胞凋亡, 这可能与ARHI基因高表达后导致磷脂酰肌醇3-激酶/蛋白激酶B通路中的血管内皮生长因子、磷酸化蛋白激酶B蛋白表达降低有关.这将为临床治疗提供给新的基因靶点.
0 引言
根据最新2018年全球癌症统计报告, 胃癌(gastric cancer,GC)的死亡率在中国位居第二, 仅次于肺癌, 达39万, 占比13.6%[1].较大多数GC患者确诊时已是晚期, 5年生存率不足30%[2,3].目前研究已证实, 肿瘤的发生发展与表观遗传学总基因的甲基化修饰密切相关[4-6].ARHI为Ras超家族中的一员, 现已经被证实可以抑制多种肿瘤生长, 其表达缺失与肿瘤的发生与进展密切相关[7-9].但是,针对ARHI基因对GC是否具有增殖抑制作用, 尚无报道,此次实验以GC细胞株MKN28为例, 研究ARHI基因对GC细胞增殖、侵袭及凋亡的影响, 并探讨其机制, 为临床研究提供基础.
1 材料和方法
1.1 材料 MKN28细胞由锦州医科大学附属第一医院脑与脊髓实验室馈赠, RPMI-1640培养基、胎牛血清、二甲亚砜、结晶紫、及碘化丙啶购买于美国Sigma公司,检测细胞凋亡所用试剂盒购买于南京凯基生物科技有限公司.ARHI、B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、蛋白激酶B(protein kinase B, AKT)、磷酸化AKT(p-AKT)、β-actin抗体、兔Ⅱ抗、鼠Ⅱ抗购买于Santa Cruz公司.
1.2 方法
1.2.1 细胞培养: MKN28细胞在含10%浓度胎牛血清的RPMI 1640培养基内, 5% CO2、37 ℃温度的孵箱内培养, 每36-60 h传代.取处于对数生长期的MKN28细胞进行相关实验.
1.2.2 质粒转染: 以pcDNA3.1为载体, 由上海舜百生物科技有限公司构建pcDNA3.1-ARHI质粒并检测; 稳定转染法转染细胞, 步骤如下: 取处于对数生长期的MKN28细胞, 以3×105个/mL浓度接种至6 cm培养皿内, 5%CO2、37 ℃的孵箱内培养24 h后, 更换新培养基, 将配置好的转染体系(9 μL转染试剂+200 μL培养基+2.4 μg质粒)加入6 cm培养皿内, 混匀后于5% CO2、37 ℃的孵箱内培养12 h后更换培养基, 24 h后加入G418(终浓度为500 μg/mL), 每日观察细胞增殖情况, 每2-3 d更换培养基, 同时加入G418(终浓度为500 μg/mL), 直至细胞为单个群落, 挑取单克隆细胞株至24孔板内孵育.逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)与Western blot实验挑取稳定高表达克隆株, 实验重复3次.空载体Mock组做阴性对照组.
1.2.3 RT-PCR检测各克隆细胞株ARHI基因mRNA表达水平: 收集处于对数生长的各组细胞, 加入Trizol液(每1×107个细胞加入1 mL), 取样器反复吹打至混匀; 每1 mL Trizol加入0.2 mL氯仿后震荡15 s后室温放置5 min.12000g(4 ℃)下离心5 min, 取上层水相至新EP管内; 加入等体积的异丙醇, 混匀, -20 ℃放置30 min; 2000 r/min 4 ℃离心10 min, 弃去上清, 加入预冷的75%乙醇(DEPC水配制); 7500 r/min 4 ℃离心5 min, 弃去上清, 室温内放置晾干后加入DEPC水20 μL; 检测mRNA浓度, 以最低浓度样品为标准, 配制各实验组上机样品并进行检测,实验重复3次.
1.2.4 Western Blot检测蛋白表达: 收集对数期的MKN28细胞及各实验组细胞, 加入适量蛋白裂解缓冲液, 震荡, 于冰上裂解10 min, 然后13000g4 ℃温度离心10 min.取上清, 弃去沉淀.以标准BCA试剂确定蛋白浓度定量.通过聚丙烯酰胺凝胶电泳将不同大小蛋白分离, 然后转印蛋白至PVDF膜, 通过浓度为5%的脱脂牛奶封闭膜内非特异性抗体.通过加入相应一抗后与PVDF膜上的目的蛋白相反应, 4 ℃环境孵育12 h.洗涤PVDF膜后与相应二抗在室温环境下孵育1 h, 洗涤PVDF膜3次.在PVDF膜上滴加化学发光试剂, 后通过X射线片曝光、显像, 记录.内参对照选β-actin, 观察ARHI、VEGF、Bcl-2、AKT、p-AKT、β-actin蛋白的表达情况.实验重复3次.
1.2.5 MTT比色法检测细胞增殖: 取生长处于对数期的MKN28细胞及各实验组细胞株接种于96孔板, 每空接种细胞约8×103个, 每组设5个重复孔, 5% CO2、37 ℃温度的孵育箱内培养24 h、48 h及72 h后, 在96孔板内每孔加入20 μL MTT, 继续孵育4 h, 弃去上清, 每孔加入150 μL二甲亚砜, 震荡混匀, 通过酶标仪测定96孔板中每孔在490 nm波长处的吸光度值, 取平均值, 绘制生长曲线, 计算各组细胞增殖率.实验重复3次.
1.2.6 细胞划痕实验检测各组细胞株迁移能力: 将MKN28细胞、Mock组及clone4细胞株接种于6孔板5×105个/孔, 培养至单层铺满, PBS液冲洗1次, 10 μL枪头尖端分别在6孔板细胞上垂直划痕, 后用PBS液再清洗2次, 加入含1%胎牛血清的1640培育基中, 余为对照组, 均设2个复孔.分别于0 h、48 h倒置相差显微镜(×400)下观测划痕细胞迁徙状况并照相, 测定划痕间距,计算迁移率并进行统计学分析.实验重复3次.
1.2.7 Transwell实验检测各组细胞株侵袭能力: 分别将处于对数生长期的MKN28细胞、Mock组及clone4细胞株, 制成细胞密度为1×105个/mL的细胞悬液, 取200 μL滴入Transwell上小室6孔板, 下室加500 μL含10%FBS的1640培育基, 均设2个复孔.于7 ℃培育48 h 后, 棉签去掉小室内表面残存细胞, 4%多聚甲醛固定后通过0.1%结晶紫染色, PBS液清洗, 生物显微镜进行拍照并计数.实验重复3次.
1.2.8 流式细胞术检测细胞凋亡: 培养MKN28细胞、Mock组及clone4细胞株至对数生长期, 更换培养基为无胎牛血清的RPMI 1640培养24 h后, 5% CO2、37 ℃温度的孵箱内培养48 h后, 收集不同处理组细胞, 4 ℃PBS洗涤3次, 调整每组样品中细胞浓度约为1.5×109/L ,分别按Annexin V FITC及PI试剂盒操作步骤及周期试剂盒操作步骤进行实验, 检测各组细胞凋亡率, 其中Annexin V FITC+/PI-的细胞百分率即为早期凋亡细胞率, Annexin V FITC+/PI+的细胞百分率即晚期细胞凋亡率, 二者之和为总凋亡率.实验重复3次.
统计学处理以SPSS 20.0进行统计学分析, 通过t检验分析比较数据,P<0.05为差异有统计学意义.
2 结果
2.1 RT-PCR检测MKN28细胞株及各克隆细胞株中ARHI基因mRNA表达水平 与MKN28细胞株相比, Mock组ARHI基因mRNA表达量1.003±0.073(P>0.05); clone1细胞株ARHI基因mRNA表达量0.899±0.056(P>0.05); clone2细胞株ARHI基因mRNA表达量1.995±0.0127(P<0.05);clone4细胞株ARHI基因mRNA表达量4.383±0.329(P<0.05)(图1、表1).
2.2 Western Blot实验检测MKN28细胞株及各克隆细胞株中ARHI蛋白表达水平 与MKN28细胞株相比, Mock组ARHI蛋白表达量0.252±0.007(P>0.05); clone1细胞株ARHI蛋白表达量0.254±0.004(P>0.05); clone2细胞株ARHI蛋白表达量0.524±0.001(P<0.05); clone4细胞株ARHI蛋白表达量0.997±0.012(P<0.05)(图2、表2).结合RT-PCR结果, clone4细胞株内ARHI基因转录mRNA水平及ARHI蛋白水平均较高, 故选取clone4高表达株作实验组.
2.3 MTT实验检测MKN28细胞株、MOCK组及Clone4细胞株增殖水平 与MKN28细胞株相比, Mock组细胞增殖能力无统计学差异(P>0.05); clone4细胞株48 h增殖能力为0.826±0.005(P<0.05), 72 h增殖能力为1.589±0.006(P<0.05)(图3、表3).
2.4 细胞划痕实验检测MKN28细胞株、MOCK组及Clone4细胞株迁移水平 与MKN28细胞株迁移率(19.92%±0.23%)相比, Mock组细胞迁移率(18.30%±0.53%)无统计学差异(P>0.05); clone4细胞株48 h迁移率为4.30%±1.57%(P<0.05)(图4、表4).
2.5 Transwell实验检测MKN28细胞株、Mock组及Clone4细胞株侵袭水平 与MKN28细胞株48 h侵袭(234±3.61)相比, Mock组细胞侵袭能力(235±4.51),无统计学差异(P>0.05); clone4细胞株侵袭能力为93.3±2.08(P<0.05)(图5、表5).
2.6 流式细胞术检测MKN28细胞株、Mock组及Clone4细胞株凋亡水平 流式细胞术检测各组细胞48 h总凋亡率显示, 与MKN28细胞株总凋亡率(3.51%±0.02%)相比, Mock组细胞总凋亡率为(3.60%±0.03%), 无统计学差异(P>0.05); clone4细胞株总凋亡率为14.13%±0.03%(P<0.05)(图6、表6).
2.7 Western blot检测MKN28细胞株、Mock组及Clone4细胞株内各蛋白表达水平 Western blot检测各组细胞蛋白表达显示, 与MKN28细胞株相比, Mock组细胞内各蛋白表达无统计学差异(P>0.05); clone4细胞株内ARHI、VEGF、Bcl-2、p-AKT蛋白表达具有统计学差异(P<0.05), AKT蛋白表达无统计学差异(P>0.05)(图7、表7).
3 讨论
众所周知, 肿瘤的发生发展与癌基因的激活和抑癌基因的失活密切相关[10-12].ARHI基因, 作为Ras家族中的一员,长度大约为8 kb, 包含2个外显子及1个内含子.相关研究证实: 其编码蛋白已经证实在人乳腺、卵巢内表达, 结肠癌、胰腺癌、宫颈癌、肝细胞癌、卵巢癌及喉鳞癌内ARHI蛋白表达降低[13-16].
本实验以GC细胞株MKN28为例, 稳定转染pcDNA3.1-ARHI质粒,通过RT-PCR及Western blot筛选高表达细胞克隆株作为实验组, 空载体MOCK组做阴性对照组, 结果提示ARHI过表达后可抑制GC细胞株MKN28增殖, 降低其侵袭和迁移能力, 并促进其凋亡,这与多数研究相一致, 为此, 我们进一步检测了相关蛋白, 进一步明确相关机制.大量研究显示Ras基因相关的信号通路与肿瘤的发生发展关系密切[17], 而Ras启动的下游信号通路, 目前公认的主要有两个, 一个是Ras-Raf-MAPKK-MAPK通路, 另外一个则是磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)/AKT通路.针对PI3K/AKT通路, PI3Ks蛋白家族参与细胞增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节, 活化的p-AKT可下调上皮型钙黏蛋白及β-连环蛋白和上调间充质细胞中的波形蛋白表达, 促进细胞上皮间充质转化, 进而降低了细胞黏附力, 促进肿瘤细胞的侵袭和转移[18], 这与本实验结果相一致,ARHI高表达克隆株细胞迁移能力降低, 侵袭能力降低, 差异具有统计学意义, 提示ARHI高表达可抑制肿瘤细胞迁移及侵袭能力.活化的AKT通过磷酸化多种酶、激酶和转录因子等, 在调节细胞凋亡中起着至关重要的作用.研究证实: PI3K/AKT通路在被激活后, 会导致细胞周期蛋白D1的降解减少, 推动细胞周期进行, 促进肿瘤细胞增殖.陆英等[19]报道显示ARHI基因表达增高可以抑制细胞周期内G2期向M期进展,进而抑制细胞分裂; 此外, Li[20]报道称ARHI基因过表达可导致乳腺癌细胞周期内G1期向S期进展抑制细胞分裂, 这可能与细胞类型不同有关.

表1 RT-PCR检测MKN28细胞株及各克隆细胞株内ARHI基因mRNA表达量
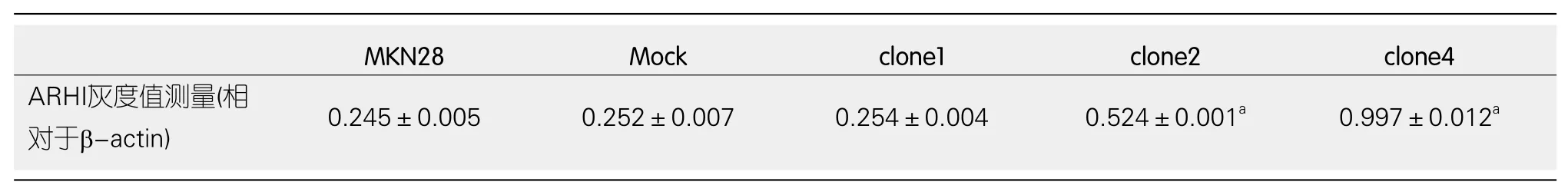
表2 MKN28细胞株及各克隆细胞株内中ARHI蛋白表达灰度值测量

表3 MTT检测MKN28、Mock组及clone4细胞株增殖率

表4 细胞划痕检测MKN28、Mock组及clone4细胞株迁移率

表5 细胞Transwell实验检测MKN28、Mock组及clone4细胞株侵袭率

表6 MKN28、Mock组及clone4细胞株总凋亡率统计

表7 MKN28、Mock组及clone4细胞株内蛋白表达灰度值测量
Bcl-2基因是公认的癌基因, 可通过阻止细胞色素c从线粒体释放至细胞质, 从而抑制肿瘤细胞凋亡, 促进增殖.AKT作为Bcl-2的上游蛋白, 当AKT磷酸化水平降低后, 引起Bcl-2蛋白表达降低, 进而导致细胞增殖能力降低, 凋亡率增加, 这与本实验凋亡结果相一致, 提示ARHI蛋白可以通过调节PI3K/AKT通路进而调节细胞凋亡.
总之, 本实验结果表明ARHI基因过表达可抑制GC细胞MKN28的增殖, 促进细胞凋亡, 这可能与ARHI高表达后导致PI3K/AKT通路中的VEGF、p-AKT蛋白表达降低有关, 这也可能为GC的治疗提供新的基因靶点.
文章亮点
实验背景
胃癌(gastric cancer, GC)作为消化道最常见的肿瘤之一,在诊断时往往伴有腹腔内广泛转移, 因此进一步明确GC侵袭转移的机制至关重要,ARHI基因已经被证实对多种肿瘤细胞具有抑制作用.进一步明确ARHI基因高表达对GC细胞的影响, 可为GC的诊断提供新思路.
实验动机
本研究拟明确:ARHI基因是否抑制GC细胞株增殖能力、迁移能力、侵袭能力; 是否可促进GC细胞株凋亡.实验结果将为GC患者的治疗提供新的基因靶点.
实验目标
本研究结果显示ARHI基因可以抑制GC细胞株增殖能力、迁移能力、侵袭能力; 并促进GC细胞株MKN28的凋亡, 进一步明确了ARHI基因的功能, 为动物实验、临床实验提供了基础.
实验方法
实验首选通过构建pcDNA3.1-ARHI质粒, 后转染至MKN28细胞内, 为进一步明确转然后单克隆细胞内ARHI基因及蛋白表达情况, 后进行了RT-PCR及Western blot实验; 筛选出高表达克隆株clone4后, 通过MTT实验检测细胞增殖能力; 细胞划痕实验检验细胞迁移能力;流式细胞术检测细胞凋亡能力; Western blot实验检测细胞内蛋白表达情况.

图4 细胞划痕检测MKN28、Mock组及clone4细胞株迁移能力.比例尺: 1:100 μm.

图5 Transwell实验检测MKN28、Mock组及clone4细胞株侵袭能力.

图6 流式细胞术检测MKN28、Mock组及clone4细胞株凋亡率.
实验结果
本项实验达到预期实验结果,ARHI基因可以抑制GC细胞株增殖能力、迁移能力、侵袭能力; 并促进GC细胞株MKN28的凋亡.为接下来动物实验及临床实验提供基础及指导.
实验结论
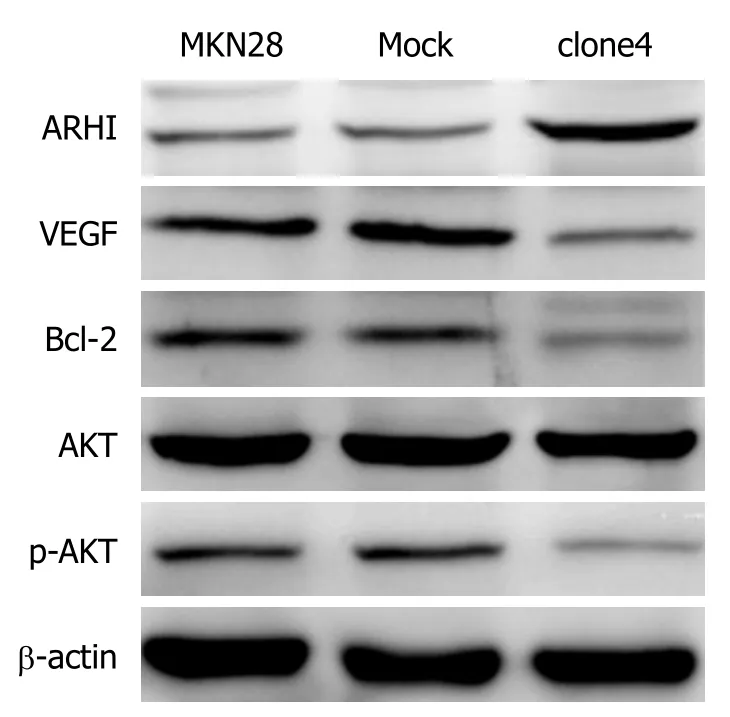
图7 Western blot检测MKN28、Mock组及clone4细胞株内蛋白表达.
ARHI基因过表达可抑制GC细胞MKN28的增殖, 促进细胞凋亡, 这可能与ARHI基因高表达后导致PI3K/AKT通路中的VEGF、p-AKT蛋白表达降低有关.通过此次实验, 有望将ARHI基因作为新的基因靶点, 为GC患者的治疗提供新方案, 同时有望成为GC是否发生转移的监测指标.
展望前景
实验未来研究的方向, 主要是: (1)构建动物模型, 进行组织学水平实验; (2)收集临床标本, 通过免疫组化、组织芯片等技术进一步提高说服力.
