Micro PET/CT观察三七总皂苷对脑缺血再灌注损伤大鼠模型脑葡萄糖代谢的影响
2021-01-18彭一檬张春银
彭一檬,余 录,谭 华,尤 强,张春银*
(1.遂宁市中心医院放射科,四川 遂宁 629000;2.西南医科大学附属医院核医学科,四川 泸州 646000)
脑缺血再灌注损伤病理生理反应较为复杂。葡萄糖转运蛋白(glucose transporter, GLUT)可能是治疗脑缺血再灌注损伤的新靶点,上调GLUT表达有利于缺血缺氧脑组织转运葡萄糖,从而缓解能量代谢衰竭,维持细胞内外离子浓度梯度,减轻脑组织水肿[1]。三七总皂苷(Panax notoginseng total sapoins, PNS)对大鼠脑缺血再灌注损伤模型具有神经保护作用[2]。本研究采用Micro18F-FDG Micro-PET/CT半定量分析脑缺血再灌注损伤模大鼠型脑葡萄糖代谢,以免疫组织化学分析GLUT表达,观察PNS对脑缺血再灌注损伤大鼠脑葡萄糖代谢的影响。
1 材料与方法
1.1 实验动物 6~8周龄健康雄性SD大鼠40只,由西南医科大学动物中心提供[许可证号:SCXK(川)2018-065];清洁级Ⅱ级,体质量250~300 g,以标准动物饲料喂养,12 h明暗交替光照。采用单纯随机抽样法将大鼠分为正常组、模型组、假手术组及PNS组,每组10只。
1.2 建立模型 采用改良线栓法建立大脑中动脉阻塞再灌注(middle cerebral artery occlusion/reperfusion, MCAO/R)模型[3]。对模型组及PNS组大鼠经腹腔注射10%水合氯醛(3 ml/kg体质量)麻醉,于颈前偏右侧切口,钝性分离并暴露右侧颈部血管,结扎并剪断颈外、颈内-外交通动脉后结扎翼鄂动脉,夹闭颈总动脉,颈内动脉绕线备用;于右颈外动脉近心端剪一倒“V”形小口,经此插入线栓(直径约为0.32 mm),插入1.8~2.0 cm后遇到阻力立即停止;结扎备用线,固定线栓后松开动脉夹;阻断1 h后拔出线栓,逐层缝合术区组织。假手术组插线深度约1.0 cm,1 h后拔出线栓缝合组织,其余操作相同。正常组仅麻醉,不予手术。
参照文献[4]标准评价神经功能缺损:神经功能正常为0分;提尾时,大鼠左前肢伸展程度与对侧不一致为1分;自由行走时向左侧转圈为2分;自由行走时向左侧倾倒为3分;无自发行走,但意识存在为4分;死亡与缺血有关为5分。术后2 h评分为1~4分且Micro PET/CT显示右侧大脑半球出现糖代谢减低区提示判断造模成功。排除造模不成功及意外死亡大鼠,随机抽取同级别大鼠进行补充造模,保证模型组及PNS组各10只,共20只大鼠为脑缺血再灌注损伤模型。
1.3 药物干预 以建模成功后3 h为干预起始时间点,对PNS组每日1次经腹腔注射PNS(浓度11.5 mg/ml),剂量为115 mg/kg体质量[5],连续3日给药;其余3组以等体积(10 ml/kg体质量)0.9%生理盐水代替PNS。
1.4 PET/CT扫描及图像分析 采用Siemens Inveon Multimodality System Micro PET/CT,配备Inveon集成工作平台和ASI Pro VM分析软件系统。18F-FDG(放射化学纯度>98%,pH为5.6)由西南医科大学附属医院核医学科提供,以Siemens Cyclotron RD型加速器制备。分别于造模成功后2、6、24、48及72 h进行显像,之前均停饲8 h并测定空腹血糖。俯卧位保定大鼠,腹腔麻醉后,经尾静脉注射18F-FDG 18.5~37.0 MBq(约0.2 ml),40 min后采集图像:CT采集曝光200 ms,以COBRA滤波反投影(filter back projection, FBP)进行重建,PET采集耗时约10 min,以2D-FBP进行重建。由2名具有2年以上工作经验的医师采用ASI Pro VM软件观察脑缺血部位及范围,勾画感兴趣容积(volume of interest, VOI),以糖代谢减低区为VOI 1,其镜像区域为VOI 2,测量标准摄取值(standardized uptake of value, SUV)。
1.5 免疫组织化学检测脑GLUT 兔抗鼠GLUT-1及GLUT-3抗体购自Bioworld公司。于建模成功72 h且PET/CT显像后摘取大鼠脑组织,制作石蜡切片,行免疫组织化学染色,以Image J软件测定平均光密度值。
1.6 统计学分析 采用SPSS 24.0统计分析软件,计量资料以±s表示,以重复测量方差分析比较各时间点组间及组内SUV差异;以独立样本t检验比较组间GLUT平均光密度值,P<0.05为差异有统计学意义。
2 结果
2.118F-FDG Micro PET/CT图像视觉及SUV 正常组及假手术组大鼠脑实质葡萄糖糖代谢均匀。模型组及PNS组大鼠术后2 h 右侧大脑半球均见葡萄糖代谢减低区,18F-FDG摄取明显低于镜像侧;术后6 h缺血灶糖代谢减低程度加重、范围稍扩大,此后模型组糖代谢减低区范围变化不明显,PNS组糖代谢减低区范围逐渐缩小,18F-FDG摄取逐渐增高,见图1。
2.2 缺血灶及周围脑组织SUV 术后2 h 正常组、模型组、假手术组及PNS组间SUV差异均无统计学意义(P均>0.05)。术后6、24、48及72 h,模型组及PNS组SUV均低于正常组和假手术组(P均<0.05),而PNS组均高于模型组(P均<0.05)。术后6 h 缺血灶18F-FDG摄取水平达到最低,之后SUV不同程度恢复;各时间点正常组及假手术组SUV差异均无统计学意义(P均>0.05),见表1。
2.3 GLUT-1及GLUT-3表达 GLUT-1主要表达于微血管内皮细胞(图2),GLUT-3主要表达于神经元细胞(图3),阳性表达细胞呈棕黄色;正常组和假手术组GLUT-1、GLUT-3阳性表达细胞数目均少于模型组和PNS组。术后72 h 模型组及PNS组GLUT-1和GLUT-3平均光密度值均高于正常组(P均<0.05),模型组高于假手术组(P<0.05),PNS组高于模型组及假手术组(P均<0.05);假手术组GLUT-1(t=-1.88,P=0.07)及GLUT-3平均光密度值(t=-1.2,P=0.21)与正常组比较差异均无统计学意义,见表2。
3 讨论
缺血、缺氧时,脑组织主要依靠无氧酵解,ATP减少、ADP增加,线粒体等细胞器因缺乏营养物质而受损;ATP减少使得Na-K-ATP酶活性降低,细胞内Na+浓度升高,导致细胞毒性脑水肿,进一步加重损伤[6-7]。葡萄糖是脑组织代谢的唯一能量来源,是必须依赖GLUT进入脑组织的极性分子;提高GLUT表达可起到神经保护作用,缓解能量代谢衰竭[1]。
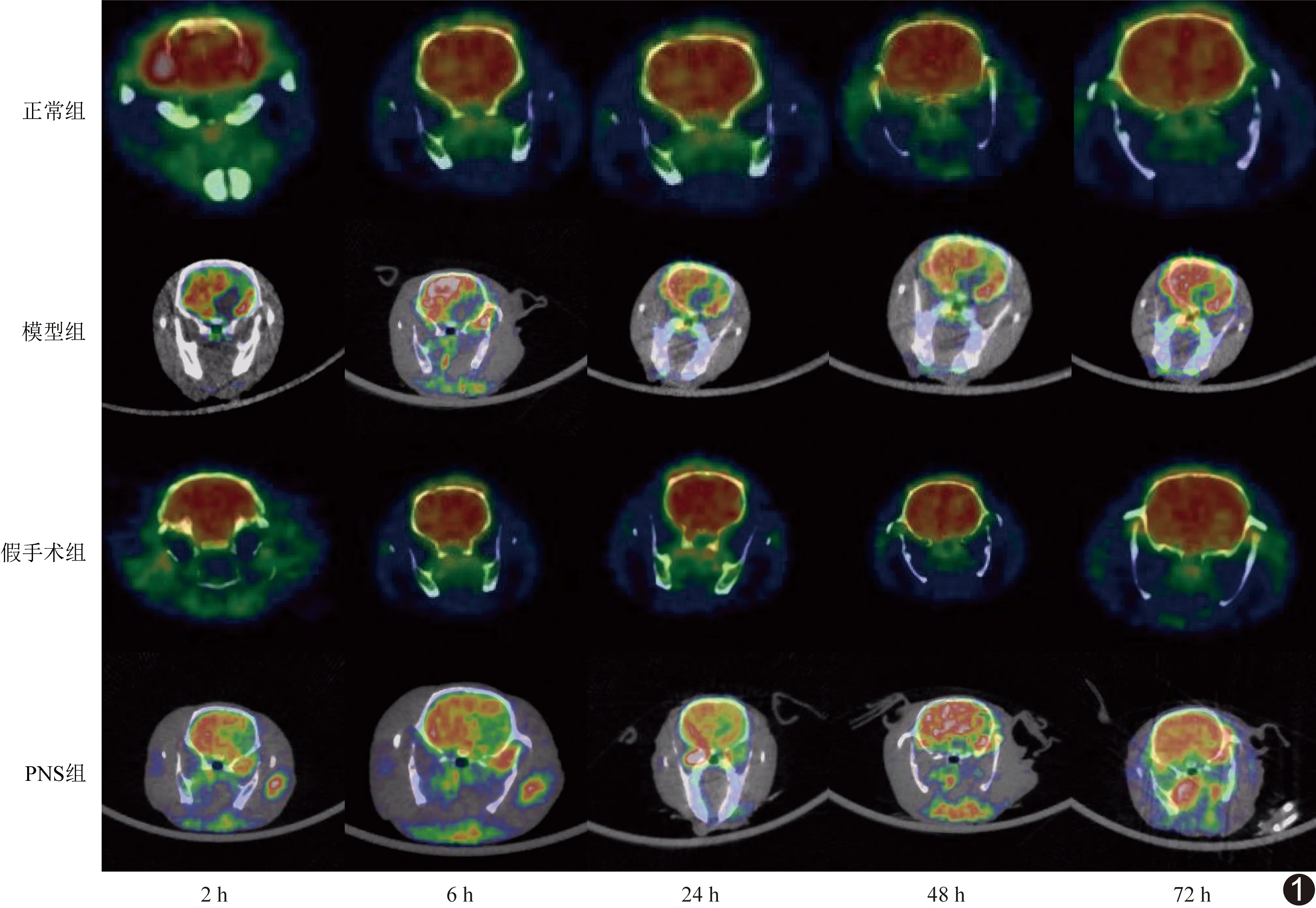
图1 各组不同时间点Micro PET/CT图
表1 各组大鼠右侧大脑半球VOI 的SUV(±s,n=10)
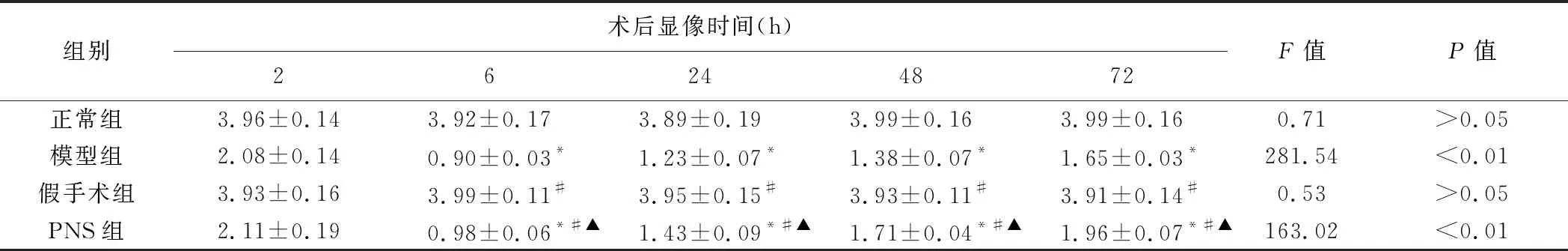
表1 各组大鼠右侧大脑半球VOI 的SUV(±s,n=10)
注:*:与正常组比较P<0.05;#:与模型组比较P<0.05;▲:与假手术组比较P<0.05
组别术后显像时间(h)26244872F值P值正常组3.96±0.143.92±0.173.89±0.193.99±0.163.99±0.160.71>0.05模型组2.08±0.140.90±0.03*1.23±0.07*1.38±0.07*1.65±0.03*281.54<0.01假手术组3.93±0.163.99±0.11#3.95±0.15#3.93±0.11#3.91±0.14#0.53>0.05PNS组2.11±0.190.98±0.06*#▲1.43±0.09*#▲1.71±0.04*#▲1.96±0.07*#▲163.02<0.01
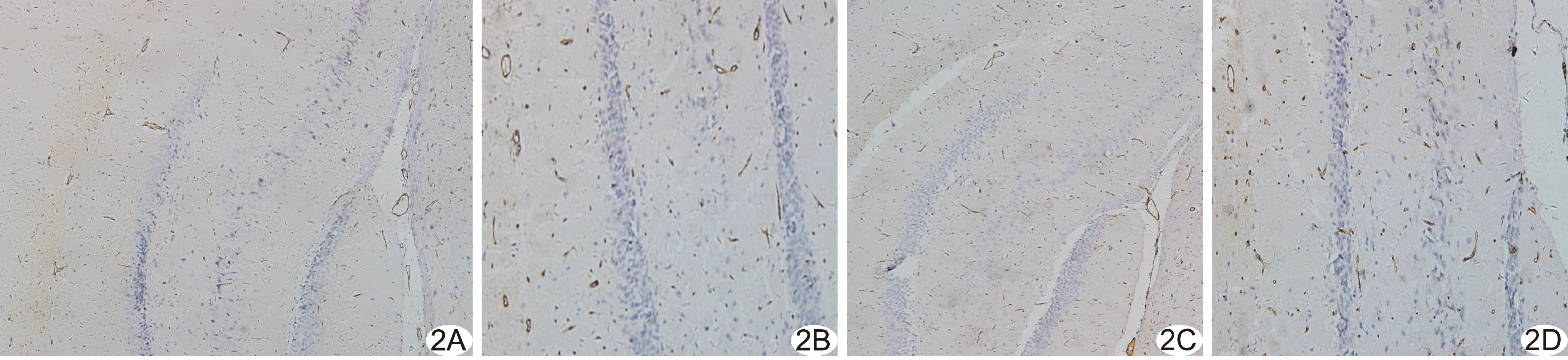
图2 脑组织GLUT-1免疫组织化学染色(×100) A.正常组; B.模型组; C.假手术组; D.PNS组
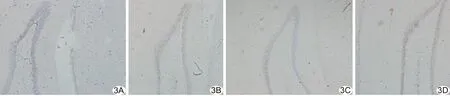
图3 脑组织GLUT-3免疫组化织化学染色(×100) A.正常组; B.模型组; C.假手术组; D.PNS组

表2 各组大鼠脑组织GLUT-1及GLUT-3免疫组织化学染色平均光密度值
本研究中,术后6、24、48及72 h,PNS组病灶SUV均高于模型组;随时间推移,病灶体积逐渐缩小,糖代谢逐渐增高,各时间点SUV差异均具有统计学意义。模型组及PNS组GLUT-1、GLUT-3表达较正常组和假手术组均有所上调;PNS组平均光密度值高于模型组,提示PNS可提高缺血灶GLUT表达,进而提高糖代谢。
PNS影响脑缺血再损伤后葡萄糖代谢的机制目前尚未明确。钟森等[8-10]认为PNS上调GLUT-1/3表达,有利于葡萄糖转运及提高脑组织中ATP、ADP及AMP含量,从而提高脑组织能量代谢;而CHENG等[11]提出PNS主要通过调节三羧酸循环和氧化呼吸链中的关键酶活性而有效抑制乳酸脱氢酶漏出,从而维持线粒体生理功能及正常能量代谢。安冬等[12-13]发现,PNS除影响脑能量代谢外,还可通过上调神经胶质谷氨酸转运体表达,清除细胞外、突触间隙过量谷氨酸而降低微血管通透性,改善微循环,促进血管生成,增加缺血组织血流灌注,调控凋亡信号通路等机制,以起到神经保护作用。
本研究通过PNS对18F-FDG摄取的影响评价其对缺血灶葡萄糖代谢率的作用,从而评估其疗效。BUNEVICIUS等[14]将18F-FDG摄取与脑葡萄糖代谢率的比值称为集总常数,默认值为1.0,即默认18F-FDG摄取与脑葡萄糖代谢率无差异;集总常数与物种及缺血时间相关,理论上同一时间点大鼠的集总常数是相同的,而脑缺血时大鼠集总常数增加20%~78%。FUKUMOTO等[15]研究证实18F-FDG摄取增高与脑缺血激活小神经胶质细胞及聚集巨噬细胞相关。本研究未以相应显像剂排除炎症反应所致18F-FDG摄取增高,但光镜下观察病灶区未见明显炎性细胞存在,由此可排除炎症反应对18F-FDG摄取的影响。
综上,18F-FDG摄取差异可反映大鼠脑葡萄糖代谢的变化趋势,采用Micro PET/CT可动态观察PNS对葡萄糖代谢的影响;PNS可通过上调脑GLUT-1/3表达促进脑葡萄糖转运,从而缓解能量衰竭,对大鼠脑缺血再灌注损伤具有保护作用。
