植物环肽生物活性及其作用机制研究进展
2021-01-05覃婷,张军
覃 婷,张 军
植物环肽生物活性及其作用机制研究进展
覃 婷,张 军*
广东药科大学生命科学与生物制药学院,广东省生物技术候选药物重点实验室,广东 广州 510006
环肽是植物来源的超稳定肽,是由头至尾环化骨架和形成胱氨酸结的3个二硫键组成的非常稳定的化合物。与其他类似肽相比,环肽的这种独特的拓扑化学结构使它们对化学、热和生物降解异常稳定,超强的稳定性可使它们在医药学领域方面取得很多进展。植物环肽是植物研究的一个新领域,由于其具有多种生物活性,引起了很多科学研究工作者的广泛重视与探究。多肽类药物的低稳定性与低的传递效率阻碍了其发展,而植物环肽的存在为多肽类药物存在问题的解决提供新的途径。综述了植物环肽的药理活性及其作用机制,为植物环肽发展成为药物应用于临床提供理论基础。
植物环肽;环半胱氨酸结结构;生物活性;作用机制;抗肿瘤;抗菌;杀虫;溶血
植物环肽是20世纪70年代首次发现于非洲植物kalata-kalata中的一种具有生物活性的物质[1]。直到1995年才通过核磁共振技术确定其空间结构,是由3对二硫键组成的胱氨酸结(cyclic cysteine knot,CCK)结构(图1)首尾相连的环肽[2]。从此,环肽结构和功能的研究取得了很大的进展,如在1999年将环肽命名为cyclotides[3];在1999年发现具有抑菌活性环肽[4];2001年首次发现大环肽kalata B1对幼虫具有抑制活性[5];2004年首次在堇菜科植物香堇菜L.中发现大环肽cycloviolacin[6];2015年从堇菜科植物中发现含大量亮氨酸的环肽[7];2019年,通过对毛叶黄花堇菜的变种var.Torr. & A. Gray的转录组进行分析,从而鉴定其中环肽的差异表达基因[8];至今为止,植物环肽的研究取得了很大成果,在医药学领域具有广泛的潜在应用。
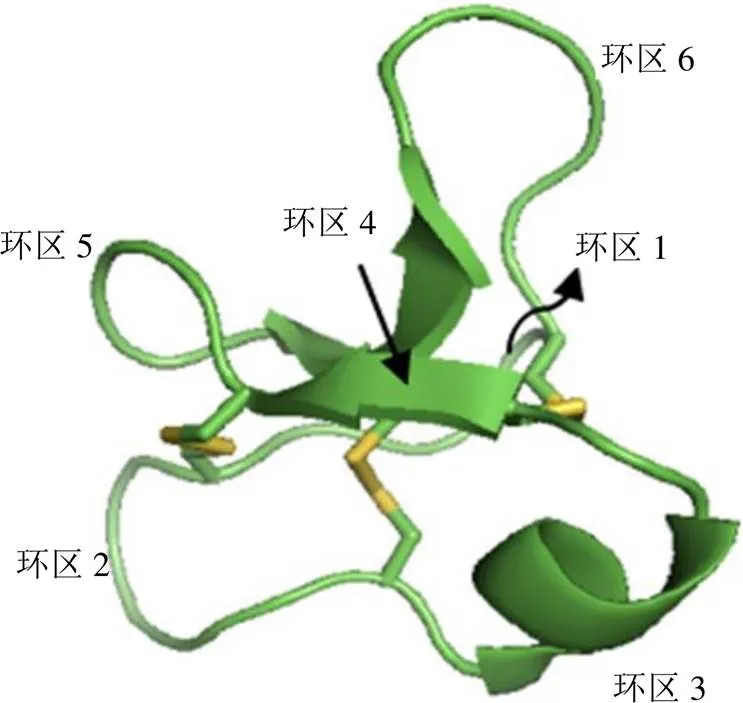
图1 环肽的CCK结构
环肽是植物体内经基因编码在核糖体内合成的一类序列长为28~37个氨基酸,由多肽链首尾相连,并与由6个固定半胱氨酸组成的三对二硫键形成稳定的六环结构,即CCK结构的环状多肽化合物[9-10]。环肽的这种独特的保守空间结构特征赋予其很强的耐酶降解能力、热稳定性及化学稳定性[11-12];并且具有杀虫[13-16]、抗菌[4,17]、抗人类免疫缺陷病毒(human immunodeficiency virus,HIV)[18]、抑制癌细胞[19-20]、促子宫收缩活性[21]及免疫促进活性[22]等多种生物活性[23]。据统计数据发现,目前发现的植物环肽几乎都是从堇菜科和茜草科植物中分离出来的[24-26],植物环肽也分布于葫芦科、茄科、豆科、禾本科植物等[9,27-30](表1),并且所有的堇菜科植物都含有环肽存在[28]。因此,大环肽资源的挖掘仍是植物研究中的重要部分,在药学研究与农业生产上具有较大的应用前景。植物环肽具有一系列的生物活性,有很大的应用空间及开发价值,然而在研究过程中还有很多的不足亟需解决,所以还要付出更大努力使植物环肽尽早应用于临床,造福人类。

表1 环肽在植物中的分布(http://www.cybase.org.au/)
续表1

来源植物名环肽名称 堇菜科(Violaceae)G.blakeanum (Standl.) Hekkinggloba A~F,mra 23 G.pauciflorum Hekkingglopa A~E 蜜花堇Melicytus ramiflorus J. R. Forst. et G. Forst.mra1-5、13、14a、14b、17a、22~26、29、30、30a Rinoreadentata (P. Beauv.) Kuntzeriden A M.chathamicus (F. Muell.) Garn. -Jonesmech 1~7 M.latifolius (Lindl.) P. S. Green mela 1~7 M.angustifolius (R. Br. ex DC.) Garn. -Jonesmang A 倒卵叶蜜花堇M.obovatus (Kirk) Garn. -Jonesmobo A、B Hybanthusparviflorus (L.f.) Baill.hyPa A Leoniacymose Mart.cycloviolin A~D Noisettiaorchidiflora (Rudge) Ginginsnor A Pombaliacalceolaria L.cycloviolacin O4,poca A、B L.triandra Cuatrec. ex L. B. Sm. & A. Fernándezltri A H.floribundus E. Muell.hyfl A~F H.floribundus W. Muell.hyfl I~M M.dentatus (R. Br. ex DC.) Molloy & Mabb.mden A~C、E~N 鳞隔堇R. virgata (Thwaites) Kuntzerivi 1~7 茜草科(Rubiaceae)Oldenlandiaaffinis (Roem. & Schult.) DC.kalata B1~B19、S、B9 linear、B10 linear,oak 6 cyclotide 1~2,oak 7 cyclotide,oak 8 cyclotide Palicoureacondensate Standl.palicourein Chassaliaparvifolia K. Schum.circulin A~F Chassaliachartacea Craib.circulin A,chassatide C1~C18 弯管花Chassalia curviflora (Wall.) Thwaiteschacur 1 Psychotriabrachiate Sw.psybra 1 Psychotriapoeppigiana Müll. Arg.psypoe 1 Psychotriabrachyceras Müll. Arg.psybry A~C,psyleio A、B,psyleio D Psychotrialeiocarpa Cham. & Schltdl.psyleio A~E Psychotrialongipes Müll. Arg.cyclopsychotride A 双花耳草H. biflora (Linn.) Lam.hedyotide B1、B2 Psychotriasolitudinum Standl.psysol 2 Palicoureaguianensis Aubl.pali A Palicoureatetragona Ruiz&Pav.cycloviolacin O22,paltet 1,vibi B Psychotrialeptothyrsa Miq.psyle A~F,vibi G、H 吐根九节Psychotria ipecacuanha (Brot.) Standl.caripe 1、2、4、6~8、10~13 H.centranthoides (Hook. & Arn.) Steud.hcf-1,hcf-1 variant H.terminalis (Hook. & Arn.) Hillebr.hcf-1 Psychotriasuterella Müll. Arg.PS-1 Chassaliadiscolor K. Schum.CD-1 豆科(Fabaceae)蝶豆Clitoria ternatea Linn.cliotide T1、T2、T6、T8~T21、T28、T32~T33、T40、T54、T55,cter A~R、1~13、15、18~20、25、28~33、35~37,CT 22、23、25~27、30、31、42、45 茄科(Solanaceae)Petuniaintegrifolia (Hook.) Schinz & Thellungphyb D 腋生矮牵牛Petunia axillaris (Lam.) B. S. P.phyb A、E、H、I Petunia xhybrida C.phyb A~C、E、F、I~L 禾本科(Poaceae)Panicumlaxum Sw.panitide L1~L9 葫芦科(Cucurbitaceae)木鳖子M. cochinchinensis (Lour.) Spreng.mCoT I-3、I-5、I-6 云南木鳖M. dioica Roxb. ex Willd.modi 6
1 作用机制
近30年来,已有很多研究报道了环肽在不同科属植物中的分布及其变异性。环肽具有多种生物活性,研究发现,环肽与细胞膜发生相互作用是其产生生物活性的主要原因[31-33]。环状骨架是环肽分子与膜相互作用过程中所必需的[34],同时,其表面独特的疏水性区域能调节其与膜相互作用,但它们的具体作用模式或机制并不太清楚[35-36]。虽然尚不能对环肽具体作用机制进行完全阐明,但大多数研究表明,植物环肽的生物活性取决于环肽的结构与细胞膜组成[15,37-38];环肽具有活性是因其结构、净电荷和疏水性与膜相互作用导致膜通透性改变的结果,强烈依赖于环肽独特的结构特征[36,39-41]。研究表明,膜结合是功能性的,因为环肽能够诱导磷脂囊泡的内容物泄漏,并在脂质双层中形成大孔[41],膜结合调节细胞毒性。
CCK结构的存在,赋予环肽较直链肽超强的耐热、耐化学降解及耐酶解的能力[42]。有研究表明,当kalata B1的CCK结构发生变化时,修饰后的衍生物不具有相应的抗HIV活性[43]。Ireland等[44]对植物环肽抗HIV的构效关系分析表明除了植物环肽的环状骨架对活性有影响外,植物环肽上某些loop区域的疏水性也与抗HIV的活性有关,而生物测定试验表明,环肽类和非环肽类具有相当的活性,表明环肽骨架可能不是活性的必要要求[45],但对维持环肽结构完整性具有重要性。由于潜在的药用价值,更多的大环肽被挖掘出抗HIV活性,研究发现环状骨架是抗HIV所必须的,大环肽的疏水性与抗HIV活性呈相关性,而且环肽抑制HIV病毒逆转录酶活性的能力似乎表明抗病毒活性发生在病毒进入宿主细胞之前,但是作用机制仍不清楚[18,43-44,46]。研究还发现将胰蛋白酶抑制剂亚家族环肽MCOTI-II的环3、5或6替换到Möbius亚家族环肽kalata B1的相应环中,降低了其溶血和细胞毒性活性,且大大降低了其细胞穿透性。另一方面,用kalata B1的相应环取代MCOTI-II的环,嵌合体环肽并不会产生细胞毒性[47]。说明独特的环序列对相应环肽的结构有重要影响,从而对环肽生物活性产生影响。
环肽已被分为3个亚家族,称为Möbius、bracelet和胰蛋白酶抑制剂(squash trypsin inhibitor,squash TI)环肽亚家族[48](图2)。相邻半胱氨酸(C)之间的环区被标注为1~6。一般而言,Möbius和bracelet亚家族大环肽的环区1包括1个保守的谷氨酸(E);Möbius亚家族大环肽序列长度多为28~29个氨基酸,其环区5包含1个标志性的脯氨酸(P);bracelet亚家族序列长度多为30~32个氨基酸;squash TI亚家族大环肽分布于葫芦科植物,序列长度多为33~34个氨基酸,且环区序列与其他亚家族差异较大,诸如环区1和6。尽管不同亚家族都具有CCK结构,但它们组成环的氨基酸残基不一样,因此活性也截然不同。如Möbius亚家族中的kalata B1,谷氨酸是调节其生物活性的重要氨基酸残基,一旦发生酯化反应其生物活性就会降低[49];而bracelet亚家族环5含有成簇的带电氨基酸,能产生微摩尔单位抑菌效果,强于Möbius亚家族[38]。有研究表明,化学修饰的环肽衍生物,其中单个残基相继被丙氨酸取代,证实在环肽表面有一片残基聚集,对生物活性很重要[15]。有研究表明蛋氨酸残基的氧化导致生物活性的丧失,增强了疏水区域对膜相互作用的重要性[45]。研究表明细胞毒性活性和它们的疏水性之间并没有很强的相关性。相反,似乎更像是带电和疏水氨基酸残基的分布决定了最终的效力。此外,研究还发现,虽然谷氨酸残基在维持bracelet亚家族环肽cycloviolacin O2的活性非常重要,但在Möbius环肽中却不太重要;而且在bracelet亚家族中,含有几个阳离子残基的环肽的活性略高于中性净电荷的活性[38]。

图A中粗线表示二硫键,图B中二硫键和首尾环化均用直线表示
对带电氨基酸残基谷氨酸、精氨酸、赖氨酸、色氨酸进行化学修饰,研究发现,色氨酸残基对Möbius亚家族环肽varv A和bracelet亚家族环肽cycloviolacin O2的生物活性具有同等重要意义[38];对Möbius亚家族中varv A的谷氨酸进行修饰,其活性降低300%;而在bracelet亚家族中cycloviolacin O2,对谷氨酸进行酯化会使活性大幅度降低[49]。对谷氨酸修饰后的大环肽进行核磁结构鉴定,显示甲基化或乙酰化修饰影响cycloviolacin O2环3处α-螺旋的氢键形成。氢键的缺失明显影响了α-螺旋的柔韧性,使其生物学活性大大降低[50]。修饰kalata B1的谷氨酸或用谷氨酸代替kalata B12中的天冬氨酸,会降低氧化折叠效率,对谷氨酸进行化学修饰,环肽的生物活性会丧失;因此,谷氨酸的存在提高了环肽的稳定性,并且对于环肽的细胞膜破坏活性至关重要[51]。cycloviolacin O2中带电的谷氨酸和赖氨酸残基的化学掩蔽导致对沙门氏菌的活性几乎完全丧失,而掩蔽精氨酸,活性则降低不太明显[52]。
环肽具有跨膜屏障和进入细胞的能力;特别是Mobius和bracelet亚家族的环肽已被发现具有脂质结合结构域,这允许特异性识别生物膜中的磷脂酰乙醇胺(phosphatidylethanolamine,PE),这种脂质选择性与环肽高度保守的三维结构密切相关,对其报道的生物学活性和细胞穿透能力具有重要意义[53];如kalata B1可以通过细胞内吞途径或直接膜易位进入细胞,就是通过将PE磷脂靶向细胞表面并诱导膜变形来启动通路的[54]。kalata B1的抗HIV活性也是因为它具有靶向和破坏HIV毒颗粒膜的能力,这些颗粒膜是富含PE磷脂的膜[55]。而胰蛋白酶抑制剂家族中缺少这种与细胞膜结合的结构,使得其具有不同于其他类型大环肽的理化性质与生物活性,但仍能透过细胞膜。Shenkarev等[56]采用dodecyl- phosphocholine micelles作为细胞膜模型,通过特异性识别细胞膜上的PE,测定kalataB1与细胞膜结合的方位。但这种具体作用机制尚不明确。
2 植物环肽的生物活性
2.1 抗HIV活性
由于环肽潜在的药理应用,其抗HIV活性得到了广泛研究。近年来,来自bracelet和Möbius亚家族的环肽被证明有抗HIV活性,见表2。
研究表明,cycloviolacin O2可能是靶向单核细胞中HIV-1的理想候选物,它们被纳入辅助治疗方法可能会提高HIV-1蛋白酶抑制剂的疗效,并最终促进病毒的消除[61]。最新研究表明,cycloviolacin O2的膜活性可能有助于抑制病毒载量并提高抗逆转录病毒药物的疗效[63]。

表2 具有抗HIV活性的环肽分布
2.2 细胞毒活性及抗肿瘤活性
相对于其他抗菌肽,环肽抗肿瘤活性最突出的特点表现在选择性对肿瘤细胞发挥细胞毒性[19,60,64]。从香堇菜中分离出了环肽cycloviolacin O2,该环肽能够分解人淋巴瘤细胞系U-937 GTB细胞的细胞膜,对钙黄绿素负载的HeLa细胞和脂质体的功能研究显示,它们各自的内容物以浓度相关性快速释放[65]。目前的结果表明,环肽具有特定的细胞膜破坏活性。从紫花地丁中提取出了viphi A、F、G均对肿瘤MM96L、HeLa、BGC-823细胞系和非肿瘤HFF-1细胞系显示出了细胞毒活性[20]。Yeshak等[66]在中发现了vaby A、D 2种环肽,它们均对淋巴瘤细胞系U-937 GTB细胞表现出剂量相关性细胞毒性。研究发现vaby A、D在其序列中都含有带电荷的残基,但vaby A的净电荷是中性的,而vaby D是带负电荷的肽。据报道,环肽的细胞毒性活性与其净电荷含量和带电残基含量相关[67]。Gerlach等[68]在双花堇菜中发现了环肽psyle A、C、E并且研究发现它们对淋巴瘤细胞系U-937 GTB细胞显示出了浓度相关性细胞毒性。Claeson等[69]对田野堇菜进行了初步筛选的分级。使用葡聚糖凝胶LH-20吸附色谱法,活性化合物被浓缩成2个级分,用反相色谱法从这2个级分中分离出varv A、F;而Lindholm等[19]检测了Varv A、F对10种人类肿瘤细胞系的细胞系,表现出了对不同细胞系有不同的影响,半数抑制浓度(IC50)值为2.7~7.5 μmol/L。就目前而言,环肽分子的体外实验比较广泛,体内实验较少,而急性毒性实验目前尚无研究。因此,环肽的细胞毒活性作用要想在临床上得到广泛的应用,就必须加强对体内和急性毒性实验的研究。具有细胞毒活性的植物环肽见表3。

表3 具有细胞毒活性的植物环肽
2.3 抗菌活性
目前研究主要报道了Mobius和bracelet 2类大环肽都存在抗菌活性[52,72],其抗菌机制可能是由于它们分子表面不同区域兼有疏水区和亲水区而具备两性分子的特性。Pränting等[52]在香堇菜中用反相高效液相色谱法分离出典型的环肽,包括Mobius亚族kalata B1和bracelet亚族cycloviolacin O2。用放射扩散法和最低抑菌浓度实验及时间-杀菌动力学的方法研究环肽对大肠杆菌、抗沙门氏菌血清型鼠伤寒沙门氏菌LT2和金黄色葡萄球菌3种细菌的抗菌活性。结果表明cycloviolacin O2对沙门氏菌血清型鼠伤寒沙门氏菌LT2和大肠杆菌的抑制活性较强;cycloviolacin O2能够有效杀死革兰阴性菌,包括耐药菌株肺炎克雷伯菌和铜绿假单胞菌,Pränting等[52]认为这与带电的谷氨酸和赖氨酸残基的化学掩蔽有关。
2.4 杀虫活性
Göransson等[73]研究了从香堇菜中分离得到的cycloviolacin O2对海洋污损生物藤壶的作用,结果表明cycloviolacin O2对藤壶具有抑制作用,且呈量效关系。藤壶是最具代表性的海洋污损生物,隶属于节肢动物门()、甲壳纲()、围胸目(),它的幼虫在海水中漂浮15~20 d,逐渐成熟附着在潮间带的礁石以及船只等设施的表面,分泌出有强吸附作用的藤壶胶,渗入到附着物的表面缝隙及微孔结构里,形成十分强大的吸附力,破坏这些表面[74-75]。藤壶又称海洋附着生物,当它大量繁衍且未能及时清理就会造成很大的危害,如给水产养殖和航运带来了严重的技术和经济问题。而且cycloviolacin O2对藤壶的作用在生物测定中是可逆和无毒的。因此,cycloviolacin O2在净化海洋环境中有很好的应用前景。还有研究表明cycloviolacin O2吞噬指数增加,证明其在体内的抗葡萄球菌活性可能与吞噬活性有关,此外还与直接的抗致病活性有关[76]。具有杀虫活性和抗菌活性的植物环肽见表4。
2.5 溶血活性
据报道,许多环肽具有溶血活性,并且它们在体内与膜相互作用[5]。Wang等[18]从光瓣堇菜中发现环肽cycloviolacins Y4、Y5具有溶血活性。将这2种环肽用于人类红细胞的体外溶血活性实验研究,并以蜂毒素作为阳性对照,结果表明这两种环肽的半数溶血(HD50)值均低于蜂毒素的HD50值,且二者溶血活性都比原型环肽kalata B1更强。Tang等[71]探究了三色堇菜的9种环肽提取物以蜂毒素为阳性对照对人类血红细胞的溶血活性试验,结果表明,环肽具有不同程度的溶血活性,HD50值范围为4.29~225.90 μmol/L。Vitri B溶血作用最小,vitri D溶血作用最强。具有溶血活性的植物环肽见表5。

表4 具有杀虫活性和抗菌活性的植物环肽分布

表5 具有溶血活性的植物环肽分布
2.6 其他
环肽还具有蛋白酶抑制活性,目前从堇菜属植物中发现了4种环肽cycloviolacin O13、14、16、24具有蛋白酶抑制活性。Ireland等[11]以kalata B1为阳性对照,考察了这4种环肽对胃蛋白酶、胰蛋白酶、嗜热菌蛋白酶的抑制作用,结果显示kalata B1在5 min内即完全降解,环肽在6 h时还均未降解。充分证明环肽可以抑制蛋白酶的降解。环肽还能促进子宫收缩,如Gran[1,79]对kalata-kalata植物的沸水提取物进行分离发现了具有子宫收缩活性的kalata B1,并作用于大鼠、兔子和人,它们的子宫收缩肌呈OT状。研究确定了天然kalata B1和2种嫁接环肽(缓激肽拮抗剂CKB-KAL和CKB-KIN)在大鼠中通过口服和静脉注射的药动学参数,并为天然和接枝环肽提供了可参考的药动学参数。本研究表明,天然和嫁接环肽的体内生物半衰期与临床使用的肽类药物相当,所测试的环肽具有与市场上的肽类药物相当的高的药物效率,暗示了低可能性的非靶点效应和毒性,因此是一种可行的药物设计支架,具有可调节的药动学性质[80]。
3 总结与展望
近10年,植物环肽在医药学领域不断发展,在药物中得到了应用。Thongyoo等[81]和Sommerhoff等[82]用减少环肽环6中的残基数量,或设计1种嵌合环肽,其中部分序列被结构相似的蛋白酶抑制剂片段所取代的方法研究开发了β-类胰蛋白酶抑制剂环肽,可作为治疗过敏性哮喘和炎症性疾病的治疗靶点。通过针对合成肽库筛选蛋白酶、分子建模或使用相关抑制剂的已知特异性数据来鉴定环肽序列替换,用序列替换的方法开发出了人凝血因子XIIa和基质蛋白酶抑制剂,用这种方法主要是替换环肽环1的序列,因为环1是squash TI亚家族环肽的主要结合环[83-84]。SET蛋白能够抑制癌基因蛋白磷酸酶2A(PP2A)发挥作用,COG肽是SET蛋白的有效拮抗剂;但由于COG肽水解稳定性差及生物利用低,导致COG肽的应用受到了限制。D’Souza等[85]将COG肽嫁接到超稳定的环肽支架MCoTI-II上,变成嫁接环肽MCOG,研究表明MCOG对癌细胞具有细胞毒性,在人血清中具有较高的稳定性,证明了环肽MCoTI-II在开发用于治疗癌症的肽药物中的应用。2015年,从热带雨林植物堇菜科植物(P. Beauv.) Kuntze发现环肽riden A,具有微弱的促进子宫收缩作用,在尼日利亚西南部发现有部分牧民利用该植物来帮助动物分娩,但在民族医学中,还需要在更大的范围内进行进一步的研究[86]。细胞穿透肽是细胞内传递亲水分子的理想载体,但它们作为药物的应用因其在血清中的低稳定性而受到损害,Huang等[87]对药物设计中研究最广泛的环肽支架之一MCoTI-II进行了修饰,修饰后的MCoTI-II与标准细胞穿透肽一样有效,并且细胞内化效率更高,还保持了所有所需的特征作为模板来移植所需的生物活性。环肽[T20K] kalata B1经口服给药可显著延缓和减轻小鼠自身免疫性脑髓炎的症状,抑制淋巴细胞增殖和减少促炎细胞因子,特别是白细胞介素-2,环肽严重阻碍了疾病的进展,没有表现出不良反应。因此,环肽是作为治疗T细胞介导的疾病的肽药物[88]。
植物环肽独特的结构骨架、广泛的生物活性、潜在的生物可获得性以及目前研究所显示出的分子多样性使得植物环肽成为一类在医药和植物保护上极有应用前景的物质。植物环肽一方面由于其内在的活性可能被直接用作药物或作为新药研究和设计的优良先导结构;另一方面由于其精确的三维结构、高稳定性和其中一些环区中氨基酸残基的可变性,可连接其他新颖活性物质而成为在多肽药物设计上非常有用的支架。环肽已被证明能够渗透人类细胞膜,并能够有效地靶向蛋白质-蛋白质在体外的相互作用,但更重要的是在动物模型中。虽然还没有环肽达到人类临床试验,但从动物模型中获得几种生物活性环肽的结果表明,这在不久的将来可能会发生。植物环肽对肿瘤细胞具有很强的细胞毒活性,不会影响正常细胞的正常生长,有望成为一类高效低毒的抗肿瘤药物。在非洲传统医药中,环肽促进子宫收缩活性已经得到广泛的应用,但还有待于现代医药学研究技术将其开发为高效低毒药物应用于临床。植物环肽还具有强杀虫活性,推测它可以用基因工程方法构建抗飞蛾及相关昆虫的转基因植物,以实现潜在的植物农药应用价值。但目前植物环肽药理研究还存在许多不足,各种药理活性的作用机制还有待进一步明确。综上所述,植物环肽在医药学领域具有很大的应用空间及开发价值,需要不断克服在研究过程中出现的不足与困难,将植物环肽早日应用于临床。
利益冲突 所有作者均声明不存在利益冲突
[1] Gran L. On the effect of a polypeptide isolated from “kalata-kalata” (DC) on the oestrogen dominated uterus [J]., 2009, 33(5/6): 400-408.
[2] Saether O, Craik D J, Campbell I D,. Elucidation of the primary and three-dimensional structure of the uterotonic polypeptide kalata B1 [J]., 1995, 34(13): 4147-4158.
[3] Craik D J, Daly N L, Bond T,. Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif [J]., 1999, 294(5): 1327-1336.
[4] Tam J P, Lu Y A, Yang J L,. An unusual structural motif of antimicrobial peptides containing end-to-end macrocycle and cystine-knot disulfides [J]., 1999, 96(16): 8913-8918.
[5] Jennings C, West J, Waine C,. Biosynthesis and insecticidal properties of plant cyclotides: The cyclic knotted proteins from[J]., 2001, 98(19): 10614-10619.
[6] Dutton J L, Renda R F, Waine C,. Conserved structural and sequence elements implicated in the processing of gene-encoded circular proteins [J]., 2004, 279(45): 46858-46867.
[7] Ravipati A S, Henriques S T, Poth A G,. Lysine-rich cyclotides: A new subclass of circular knotted proteins from Violaceae [J]., 2015, 10(11): 2491- 2500.
[8] Sternberger A L, Bowman M J, Kruse C P S,. Transcriptomics identifies modules of differentially expressed genes and novel cyclotides in[J]., 2019, 10: 156.
[9] Poth A G, Chan L Y, Craik D J. Cyclotides as grafting frameworks for protein engineering and drug design applications [J]., 2013, 100(5): 480-491.
[10] White A M, Craik D J. Discovery and optimization of peptide macrocycles [J]., 2016, 11(12): 1151-1163.
[11] Ireland D C, Colgrave M L, Craik D J. A novel suite of cyclotides from: Sequence variation and the implications for structure, function and stability [J]., 2006, 400(1): 1-12.
[12] Shafee T, Harris K, Anderson M. Biosynthesis of cyclotides [J]., 2015, 76: 227-269.
[13] Simonsen S M, Sando L, Ireland D C,. A continent of plant defense peptide diversity: Cyclotides in Australian(Violaceae) [J]., 2005, 17(11): 3176-3189.
[14] Barbeta B L, Marshall A T, Gillon A D,. Plant cyclotides disrupt epithelial cells in the midgut of lepidopteran larvae [J]., 2008, 105(4): 1221-1225.
[15] Simonsen S M, Sando L, Rosengren K J,. Alanine scanning mutagenesis of the prototypic cyclotide reveals a cluster of residues essential for bioactivity [J]., 2008, 283(15): 9805-9813.
[16] Pinto M F, Fensterseifer I C, Migliolo L,. Identification and structural characterization of novel cyclotide with activity against an insect pest of sugar cane [J]., 2012, 287(1): 134-147.
[17] Ovesen R G, Brandt K K, Göransson U,. Biomedicine in the environment: Cyclotides constitute potent natural toxins in plants and soil bacteria [J]., 2011, 30(5): 1190-1196.
[18] Wang C K, Colgrave M L, Gustafson K R,. Anti-HIV cyclotides from the Chinese medicinal herb[J]., 2008, 71(1): 47-52.
[19] Lindholm P, Göransson U, Johansson S,. Cyclotides: A novel type of cytotoxic agents [J]., 2002, 1(6): 365-369.
[20] He W, Chan L Y, Zeng G,. Isolation and characterization of cytotoxic cyclotides from[J]., 2011, 32(8): 1719-1723.
[21] Gran L, Sletten K, Skjeldal L. Cyclic peptides fromDC. molecular and biological properties [J]., 2008, 5(10): 2014-2022.
[22] Nguyen K N, Nguyen G K, Nguyen P Q,. Immunostimulating and gram-negative-specific antibacterial cyclotides from the butterfly pea () [J]., 2016, 283(11): 2067-2090.
[23] Oguis G K, Gilding E K, Jackson M A,. Butterfly pea (), a cyclotide-bearing plant with applications in agriculture and medicine [J]., 2019, 10: 645.
[24] Witherup K M, Bogusky M J, Anderson P S,. Cyclopsychotride A, a biologically active, 31-residue cyclic peptide isolated fromlongipes [J]., 1994, 57(12): 1619-1625.
[25] Göransson U, Luijendijk T, Johansson S,. Seven novel macrocyclic polypeptides from[J]., 1999, 62(2): 283-286.
[26] Gustafson K R, Walton L K, Sowder R C Jr,. New circulin macrocyclic polypeptides from[J]., 2000, 63(2): 176-178.
[27] Nguyen G K, Lian Y L, Pang E W,. Discovery of linear cyclotides in monocot plantof Poaceae family provides new insights into evolution and distribution of cyclotides in plants [J]., 2013, 288(5): 3370-3380.
[28] Burman R, Yeshak M Y, Larsson S,. Distribution of circular proteins in plants: Large-scale mapping of cyclotides in the Violaceae [J]., 2015, 6: 855.
[29] Niyomploy P, Chan L Y, Poth A G,. Discovery, isolation, and structural characterization of cyclotides fromMiq. [J]., 2016, 106(6): 796-805.
[30] Niyomploy P, Chan L Y, Harvey P J,. Discovery and characterization of cyclotides fromspecies [J]., 2018, 81(11): 2512-2520.
[31] Wang C K, Wacklin H P, Craik D J. Cyclotides insert into lipid bilayers to form membrane pores and destabilize the membrane through hydrophobic and phosphoethanolamine- specific interactions [J]., 2012, 287(52): 43884-43898.
[32] Craik D J. Host-defense activities of cyclotides [J].(Basel), 2012, 4(2): 139-156.
[33] Park S, Strömstedt A A, Göransson U. Cyclotide structure-activity relationships: Qualitative and quantitative approaches linking cytotoxic and anthelmintic activity to the clustering of physicochemical forces [J]., 2014, 9(3): e91430.
[34] Daly N L, Love S, Alewood P F,. Chemical synthesis and folding pathways of large cyclic polypeptides: Studies of the cystine knot polypeptide kalata B1 [J]., 1999, 38(32): 10606-10614.
[35] Shenkarev Z O, Nadezhdin K D, Lyukmanova E N,. Divalent cation coordination and mode of membrane interaction in cyclotides: NMR spatial structure of ternary complex Kalata B7/Mn2+/DPC micelle [J]., 2008, 102(5/6): 1246-1256.
[36] Henriques S T, Huang Y H, Castanho M A,. Phosphatidylethanolamine binding is a conserved feature of cyclotide-membrane interactions [J]., 2012, 287(40): 33629-33643.
[37] Huang Y H, Colgrave M L, Clark R J,. Lysine- scanning mutagenesis reveals an amendable face of the cyclotide kalata B1 for the optimization of nematocidal activity [J]., 2010, 285(14): 10797-10805.
[38] Burman R, Herrmann A, Tran R,. Cytotoxic potency of small macrocyclic knot proteins: Structure-activity and mechanistic studies of native and chemically modified cyclotides [J]., 2011, 9(11): 4306- 4314.
[39] Kamimori H, Hall K, Craik D J,. Studies on the membrane interactions of the cyclotides kalata B1 and kalata B6 on model membrane systems by surface plasmon resonance [J]., 2005, 337(1): 149- 153.
[40] Wang C K, Hu S H, Martin J L,. Combined X-ray and NMR analysis of the stability of the cyclotide cystine knot fold that underpins its insecticidal activity and potential use as a drug scaffold [J]., 2009, 284(16): 10672-10683.
[41] Huang Y H, Colgrave M L, Daly N L,. The biological activity of the prototypic cyclotide kalata b1 is modulated by the formation of multimeric pores [J]., 2009, 284(31): 20699-20707.
[42] Colgrave M L, Craik D J. Thermal, chemical, and enzymatic stability of the cyclotide kalata B1: The importance of the cyclic cystine knot [J]., 2004, 43(20): 5965-5975.
[43] Daly N L, Gustafson K R, Craik D J. The role of the cyclic peptide backbone in the anti-HIV activity of the cyclotide kalata B1 [J]., 2004, 574(1/2/3): 69-72.
[44] Ireland D C, Wang C K, Wilson J A,. Cyclotides as natural anti-HIV agents [J]., 2008, 90(1): 51-60.
[45] Nguyen G K, Lim W H, Nguyen P Q,. Novel cyclotides and uncyclotides with highly shortened precursors fromand effects of methionine oxidation on bioactivities [J]., 2012, 287(21): 17598-17607.
[46] Chen B, Colgrave M L, Daly N L,. Isolation and characterization of novel cyclotides fromHederaceae: Solution structure and anti-HIV activity of vhl-1, a leaf-specific expressed cyclotide [J]., 2005, 280(23): 22395-22405.
[47] Abdul Ghani H, Henriques S T, Huang Y H,. Structural and functional characterization of chimeric cyclotides from the Möbius and trypsin inhibitor subfamilies [J]., 2017, 108(1): e22927.
[48] Weidmann J, Craik D J. Discovery, structure, function, and applications of cyclotides: Circular proteins from plants [J]., 2016, 67(16): 4801-4812.
[49] Herrmann A, Svangård E, Claeson P,. Key role of glutamic acid for the cytotoxic activity of the cyclotide cycloviolacin O2 [J]., 2006, 63(2): 235-245.
[50] Göransson U, Herrmann A, Burman R,. The conserved glu in the cyclotide cycloviolacin O2 has a key structural role [J]., 2009, 10(14): 2354- 2360.
[51] Wang C K L, Clark R J, Harvey P J,. The role of conserved glu residue on cyclotide stability and activity: A structural and functional study of kalata B12, a naturally occurring glu to asp mutant [J]., 2011, 50(19): 4077-4086.
[52] Pränting M, Lööv C, Burman R,. The cyclotide cycloviolacin O2 fromhas potent bactericidal activity against gram-negative bacteria [J]., 2010, 65(9): 1964-1971.
[53] Troeira Henriques S, Craik D J. Cyclotide structure and function: The role of membrane binding and permeation [J]., 2017, 56(5): 669-682.
[54] Henriques S T, Huang Y H, Chaousis S,. The prototypic cyclotide kalata B1 has a unique mechanism of entering cells [J]., 2015, 22(8): 1087-1097.
[55] Henriques S T, Huang Y H, Rosengren K J,. Decoding the membrane activity of the cyclotide kalata B1: The importance of phosphatidylethanolamine phospholipids and lipid organization on hemolytic and anti-HIV activities [J]., 2011, 286(27): 24231-24241.
[56] Shenkarev Z O, Balandin S V, Trunov K I,. Molecular mechanism of action of β-hairpin antimicrobial peptide arenicin: Oligomeric structure in dodecylphosphocholine micelles and pore formation in planar lipid bilayers [J]., 2011, 50(28): 6255-6265.
[57] Gustafson K R, Sowder R C, Henderson L E,. Circulins A and B. Novel human immunodeficiency virus (HIV)-inhibitory macrocyclic peptides from the tropical tree[J]., 1994, 116(20): 9337-9338.
[58] Hallock Y F, Sowder R C, Pannell L K,. Cycloviolins A-D, anti-HIV macrocyclic peptides from[J]., 2000, 65(1): 124-128.
[59] Daly N L, Clark R J, Plan M R,. Kalata B8, a novel antiviral circular protein, exhibits conformational flexibility in the cystine knot motif [J]., 2006, 393(Pt 3): 619-626.
[60] Svangård E, Göransson U, Hocaoglu Z,. Cytotoxic cyclotides from[J]., 2004, 67(2): 144-147.
[61] Gerlach S L, Yeshak M, Göransson U,. Cycloviolacin O2 (CyO2) suppresses productive infection and augments the antiviral efficacy of nelfinavir in HIV-1 infected monocytic cells [J]., 2013, 100(5): 471-479.
[62] Bokesch H R, Pannell L K, Cochran P K,. A novel anti-HIV macrocyclic peptide fromcondensata [J]., 2001, 64(2): 249-250.
[63] Gerlach S L, Chandra P K, Roy U,. The membrane- active phytopeptide cycloviolacin O2 simultaneously targets HIV-1-infected cells and infectious viral particles to potentiate the efficacy of antiretroviral drugs [J].(Basel), 2019, 6(1): E33.
[64] Herrmann A, Burman R, Mylne J S,. The alpine violet,, is a rich source of cyclotides with potent cytotoxicity [J]., 2008, 69(4): 939- 952.
[65] Svangård E, Burman R, Gunasekera S,. Mechanism of action of cytotoxic cyclotides: Cycloviolacin O2 disrupts lipid membranes [J]., 2007, 70(4): 643-647.
[66] Yeshak M Y, Burman R, Asres K,. Cyclotides from an extreme habitat: Characterization of cyclic peptides fromof the Ethiopian Highlands [J]., 2011, 74(4): 727-731.
[67] Wang C K, Gruber C W, Cemazar M,. Molecular grafting onto a stable framework yields novel cyclic peptides for the treatment of multiple sclerosis [J]., 2014, 9(1): 156-163.
[68] Gerlach S L, Burman R, Bohlin L,. Isolation, characterization, and bioactivity of cyclotides from the Micronesian plant[J]., 2010, 73(7): 1207-1213.
[69] Claeson P, Göransson U, Johansson S,. Fractionation protocol for the isolation of polypeptides from plant biomass [J]., 1998, 61(1): 77-81.
[70] Nguyen G K, Zhang S, Nguyen N T,. Discovery and characterization of novel cyclotides originated from chimeric precursors consisting of albumin-1 chain a and cyclotide domains in the Fabaceae family [J]., 2011, 286(27): 24275-24287.
[71] Tang J, Wang C K, Pan X L,. Isolation and characterization of cytotoxic cyclotides from[J]., 2010, 31(8): 1434-1440.
[72] Wong C T, Taichi M, Nishio H,. Optimal oxidative folding of the novel antimicrobial cyclotide fromrequires high alcohol concentrations [J]., 2011, 50(33): 7275-7283.
[73] Göransson U, Sjögren M, Svangård E,. Reversible antifouling effect of the cyclotide cycloviolacin O2 against barnacles [J]., 2004, 67(8): 1287-1290.
[74] Subramanian G, Palanichamy S, Veeramani P. An eco-friendly process for prevention of biofouling [J]., 2016, 99:474-479.
[75] Yee M S L, Khiew P S, Lim S S,. Enhanced marine antifouling performance of silver-titania nanotube composites from hydrothermal processing [J]., 2017, 520: 701-711.
[76] Fensterseifer I C, Silva O N, Malik U,. Effects of cyclotides against cutaneous infections caused by[J]., 2015, 63: 38-42.
[77] Colgrave M L, Kotze A C, Ireland D C,. The anthelmintic activity of the cyclotides: Natural variants with enhanced activity [J]., 2008, 9(12): 1939-1945.
[78] Colgrave M L, Kotze A C, Kopp S,. Anthelmintic activity of cyclotides:studies with canine and human hookworms [J]., 2009, 109(2): 163-166.
[79] Gran L. Oxytocic principles of[J]., 1973, 36(2): 174-178.
[80] Poth A G, Huang Y H, Le T T,. Pharmacokinetic characterization of kalata B1 and related therapeutics built on the cyclotide scaffold [J]., 2019, 565: 437-446.
[81] Thongyoo P, Bonomelli C, Leatherbarrow R J,. Potent inhibitors of beta-tryptase and human leukocyte elastase based on the MCoTI-II scaffold [J]., 2009, 52(20): 6197-6200.
[82] Sommerhoff C P, Avrutina O, Schmoldt H U,. Engineered cystine knot miniproteins as potent inhibitors of human mast cell tryptase beta [J]., 2010, 395(1): 167-175.
[83] Quimbar P, Malik U, Sommerhoff C P,. High-affinity cyclic peptide matriptase inhibitors [J]., 2013, 288(19): 13885-13896.
[84] Swedberg J E, Mahatmanto T, Abdul Ghani H,. Substrate-guided design of selective FXIIa inhibitors based on the plant-derivedtrypsin inhibitor-II (MCoTI-II) scaffold [J]., 2016, 59(15): 7287-7292.
[85] D’Souza C, Henriques S T, Wang C K,. Using the MCoTI-II cyclotide scaffold to design a stable cyclic peptide antagonist of SET, a protein overexpressed in human cancer [J]., 2016, 55(2): 396-405.
[86] Attah A F, Hellinger R, Sonibare M A,. Ethnobotanical survey of(Violaceae) used in South- Western Nigerian ethnomedicine and detection of cyclotides [J]., 2016, 179: 83-91.
[87] Huang Y H, Chaousis S, Cheneval O,. Optimization of the cyclotide framework to improve cell penetration properties [J]., 2015, 6: 17.
[88] Thell K, Hellinger R, Sahin E,. Oral activity of a nature-derived cyclic peptide for the treatment of multiple sclerosis [J]., 2016, 113(15): 3960-3965.
Research progress on biological activities and action mechanisms of cyclotides in plants
QIN Ting, ZHANG Jun
Guangdong Provincial Key Laboratory of Biotechnology Candidate Drugs, School of Life Science and Biopharmaceutics, Guangdong Pharmaceutical University, Guangzhou 510006, China
Cyclotide is a plant-derived remarkable-stable peptide, which consists of a head-to-tail cyclization skeleton and a cyclic cysteine knot formed by three disulfide bonds. Compared with other similar peptides, the unique topological chemical structure of cyclotides makes them extremely stable to chemical, thermal and biological degradation, and their super-strong stability make them become attractive subject in the field of medicine and pharmacy. Cyclotides in plants are a new field of plant research. Because of their various biological activities, they have attracted extensive attention and exploration from many scientific researchers. The low stability and low delivery efficiency of polypeptide drugs hinder their development, while the existence of cyclotides in plants provides a new way to solve the existing problems of polypeptide drugs. The pharmacological activities and mechanisms of cyclotides in plants are summarized in this paper, which provides theoretical basis for the development of cyclotides in plants into drugs for clinical application.
cyclotides in plants; cyclic cysteine knot; biological activities; mechanism of action; anti-tumor; antibacterial; insecticidal; hemolysis
R284.194
A
0253 - 2670(2021)01 - 0255 - 12
10.7501/j.issn.0253-2670.2021.01.031
2020-04-25
国家自然科学基金资助项目(31570506);广东药科大学创新强校项目(2017KCXTD020)
覃 婷(1995—),女(壮族),硕士研究生,研究方向为植物环肽功能研究。E-mail: Qting016@163.com
张 军(1980—),男,硕士生导师,副教授,研究方向为从事植物药用功能基因研究。E-mail: lsszhangj@gdpu.edu.cn
[责任编辑 崔艳丽]
