高效液相色谱快速分析亚麻籽环肽条件研究
2020-01-14许趁心蔡子哲杜木香
许趁心,蔡子哲,3,杜木香,刘 雪,汪 勇,3,王 瑛,3
(1.暨南大学 食品科学与工程系,广州 510632; 2.广东省粮油副产物生物炼制工程技术研究中心,广州 510632; 3.暨南大学-萨斯喀彻温大学“油料生物炼制与营养”联合实验室,广州 510632)
亚麻(LinumusitatissimumL.)是我国八大油料作物之一[1],亚麻籽总产量约为47.47万t,仅次于加拿大(年产93万t),位居世界第二。亚麻籽含有油脂(40%~45%)、蛋白质(20%~25%)、亚麻籽胶(8%~14%)、亚麻木酚素(1%~5%)、膳食纤维(23%~29%)、多糖、维生素A、维生素E等营养物质外,还富含特有营养成分——亚麻籽环肽[2]。
亚麻籽环肽是亚麻籽及亚麻籽油中的特色脂质伴随物,目前尚未在其他高等植物中发现[3]。现阶段发现的亚麻籽环肽主要有环肽A、C、D、E、F、G[4-5],亚麻籽和亚麻籽油中环肽的总含量分别约为0.1%[2]和0.5~2.0 mg/g[6],其潜在产量约为100 t,具有较大的应用前景。环肽由8~9个氨基酸残基组成,氨基酸首尾连接呈环状,相对分子质量为1 kDa左右,不存在游离氨基,相比线性肽具有一定的稳定性[7-8]。环肽的疏水性质使其在细胞膜之间的运输、组织和器官之间的分散起到重要的作用[9]。据研究报道亚麻籽环肽具有免疫调节,促进神经、淋巴增殖等功效[10-11]。目前,对亚麻籽环肽的研究报道主要集中在亚麻籽环肽的活性研究和潜在的药用价值开发,而对亚麻籽环肽的快速、高效检测研究较少,且现有研究成果存在以下问题:①分析时间长,分析效率较低(一般为30 min,最长可达60 min);②柱效差,在色谱柱的选择上,主要为C18反相色谱柱,没有针对亚麻籽单个环肽峰进行优化,导致无法对样品中环肽组分进行定量;③流速和进样量作为HPLC参数,其变化亦是影响分离度的重要因素,然而目前关于上述参数对环肽分析的影响,尚未见系统性研究。
本研究以含有14种亚麻籽环肽混合标样为样品,从液相色谱柱选择、进样量、初始洗脱体积分数和流速等参数,对亚麻籽环肽的HPLC分析条件进行优化,将优化后的方法应用于亚麻籽、商品亚麻籽油及亚麻籽粕中环肽组成的分析,以期实现对亚麻籽环肽的快速、高效分析。该方法系统的建立,可进一步为亚麻籽产品在不同品种环肽组成指纹图谱、环肽种类分离鉴定、亚麻籽油氧化程度评价等研究领域,提供一定的理论参考。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
14种亚麻籽环肽混合标样(淡黄色粉末),加拿大Prairie Tide化学品公司;亚麻籽、亚麻籽粕产自山西朔州,无霉变,呈自然风干状态,封口袋包装置于4℃低温条件下贮藏备用,山西中大科技有限公司右玉分公司;商品亚麻籽油,陕西碌碌农夫有限公司;乙腈、甲醇,色谱纯,赛默飞世尔科技(中国)有限公司;超纯水,实验室自制;无水乙醇,广东光华科技股份有限公司。
1.1.2 仪器与设备
Waters Alliance Separations Module 2695高效液相色谱仪、Waters 2998PDA二极管阵列检测器,美国Waters公司;Kinetex® Phenyl-Hexyl LC色谱柱(150 mm×4.6 mm,2.6 μm),飞诺美Phenomenex上海谱誉科贸有限公司;Diamonsil C18色谱柱(150 mm×4.6 mm,5 μm),北京迪科马科技术有限公司;UFLC(30AD)-MS(8045)三重四极杆液质联用仪,岛津公司;冷凝旋转蒸发仪;GZX-9240MBE电热鼓风干燥箱;DF-101S集热式恒温加热磁力搅拌器;HC-2518高速离心机;ME104/02电子分析天平;SK8200LHC超声波清洗器;XW-80A微型旋涡混合仪。
1.2 试验方法
1.2.1 HPLC-ESI-MS定性分析亚麻籽环肽组成
色谱条件:Kinetex® Phenyl-Hexyl LC色谱柱(150 mm×4.6 mm,2.6 μm),进样量1 μL,流速0.4 mL/min,流动相A、B分别为乙腈和水,梯度洗脱程序见表1。
质谱条件:ESI离子源,正离子模式Q3扫描,雾化气流量3.0 L/min,干燥器流量10.0 L/min,加热气流量10.0 L/min,接口温度300℃,脱溶剂温度250℃,加热块温度400℃,扫描范围400~1 600。

表1 梯度洗脱程序
1.2.2 HPLC定量分析亚麻籽环肽的组成与相对含量

(1)
(2)
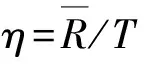
(3)
式中:t1为第一个环肽峰的保留时间;t2为第二个环肽峰的保留时间;w1为第一个环肽峰的峰宽;w2为第二个环肽峰的峰宽;n为环肽个数;T为最后一个峰结束后的总分析时间。
理论上,当R大于等于1.5时,认为相邻的两个峰被分开了[12]。研究重点考察在特定高效液相色谱条件下的分析效率(η)。η越大,则表明分析效率越高。
1.2.3 样品前处理
1.2.3.1 亚麻籽中环肽的提取
将亚麻籽过筛,去除杂质和尘土后,粉碎至约60目,于55℃烘干6 h。按照Gui等[6]的方法提取亚麻籽油。称取25 g亚麻籽粉,以正己烷为试剂索氏抽提5 h后,将提取的亚麻籽油浓缩至恒重。称量2 g亚麻籽油,加入2 mL正己烷,混匀后加入4 mL 60%甲醇水溶液涡旋5 min,离心[4],分离下层澄清溶液。在上层液体中,重复加入4 mL 60%甲醇水溶液进行二次涡旋提取,将两次提取获得的下层滤液合并、过滤、浓缩后,用乙腈溶解、定容至5 mL。使用0.45 μL滤膜过滤后注入1.5 mL Waters进样瓶备用。
1.2.3.2 商品亚麻籽油中环肽的提取
商品亚麻籽油环肽的提取,参照1.2.3.1中对亚麻籽油处理的方法进行操作。
1.2.3.3 亚麻籽粕中环肽的提取
参照连莹君等[13]的方法并作一定修改。10 g亚麻籽粕与140 mL 95%乙醇加入圆底烧瓶中,在70℃条件下回流萃取1 h后冷却至室温,抽滤,将提取液浓缩后取上层澄清油样参照1.2.3.1中对亚麻籽油处理的方法进行操作。
2 结果与讨论
2.1 HPLC-ESI-MS定性分析亚麻籽环肽(见图1)

图1 亚麻籽环肽混合标品的HPLC-ESI-MS谱图
由图1可以看出,较低流速(0.4 mL/min)洗脱时,可以实现所有环肽色谱峰的完全分离,基于Kinetex®色谱柱可以实现环肽F、G的同分异构体(α、β-构型异构体)分离。结合Shim等[5]报道的环肽出峰顺序及相对分子质量信息,确定环肽在该色谱柱中的洗脱顺序。从亚麻籽环肽的出峰顺序可以看出,氧化反应增加了亚麻籽环肽的极性[14],使含一个或两个蛋氨酸亚砜或蛋氨酸砜的氧化态亚麻籽环肽先于其还原态被洗脱(如环肽F先于N)。这表明环肽分子基团的氧化改变了亚麻籽环肽的组成。对亚麻籽环肽的完全分离及测定,尤其是氧化态环肽[15],是利用环肽组成差异评价亚麻籽油氧化程度的重要基础。本方法可用于评价亚麻籽油氧化程度。
2.2 HPLC定量分析亚麻籽环肽的条件优化
2.2.1 不同色谱柱对亚麻籽环肽分离的影响
基于流速1 mL/min,进样量10 μL,洗脱程序为乙腈-水初始体积分数40%-60%,乙腈以5%/min 升至乙腈-水体积分数为90%-10%的条件下,考察不同色谱柱对亚麻籽环肽分离的影响,结果见图2、图3。

图2 亚麻籽环肽混合标品在Diamonsil C18的色谱图

图3 亚麻籽环肽混合标品在Kinetex®的色谱图
从图2和图3可以看出,亚麻籽环肽混合标样在Diamonsil C18色谱柱分离过程中,在8~10 min处所洗脱的色谱峰(环肽H、K、D、J、N),存在重叠现象。Gui等[6]使用ZORBAX Eclipse XDB-C18色谱柱,也存在环肽色谱峰的重叠现象。相比Kinetex®色谱柱,在环肽L(保留时间为12.00 min)后,未见剩余2个环肽色谱峰检出,推测其与环肽A色谱峰同时洗脱。Kinetex®色谱柱在6~8 min处,5个色谱峰(环肽H、K、D、J、N)均实现良好的分离。可以看出,Kinetex®色谱柱柱效高,对结构相近的环肽具有较好的分离效果,同时可以分离含量较低的环肽,获得的亚麻籽环肽变化规律,可作为潜在的亚麻籽产品加工、贮藏方式的数据基础。因此,后续试验选用Kinetex®色谱柱进行环肽的分析测定。
2.2.2 进样量对分析效果的影响
基于Kinetex®色谱柱,流速1 mL/min,洗脱程序为乙腈-水初始体积分数60%-40%,乙腈以5%/min升至乙腈-水体积分数为90%-10%的条件下,考察进样量对分析效果的影响,结果见表2。

表2 进样量对平均分离度及分析效率的影响
由表2可知,随着进样量的减少,平均分离度呈逐步上升趋势。试验发现,随着进样量的增加,各环肽峰面积相应增大,同时相邻的色谱峰产生部分重叠,造成平均分离度下降。然而,随着进样量减少,样品中含量较少的环肽,如环肽H、J、N、K、D等,色谱峰面积过小,已接近基线噪声水平,难以辨认及积分定量。样品中各个环肽的有效分离和检出是实现环肽定性和准确定量的基础。因此,选择样品进样量时,要同时兼顾含量低的色谱峰检出限及相邻色谱峰的分离效果,不能仅追求峰的高度而增大进样量。综合考虑,确定5 μL为最适进样量,可以满足对环肽定量分析的需求。
2.2.3 初始体积分数对分析效果的影响
基于Kinetex®色谱柱,流速1 mL/min,进样量5 μL,乙腈分别以30%、35%、40%、45%、50%和60%的初始体积分数,5%/min速率升至90%的洗脱程序进行分析,考察乙腈初始体积分数对分析效果的影响,结果见表3。
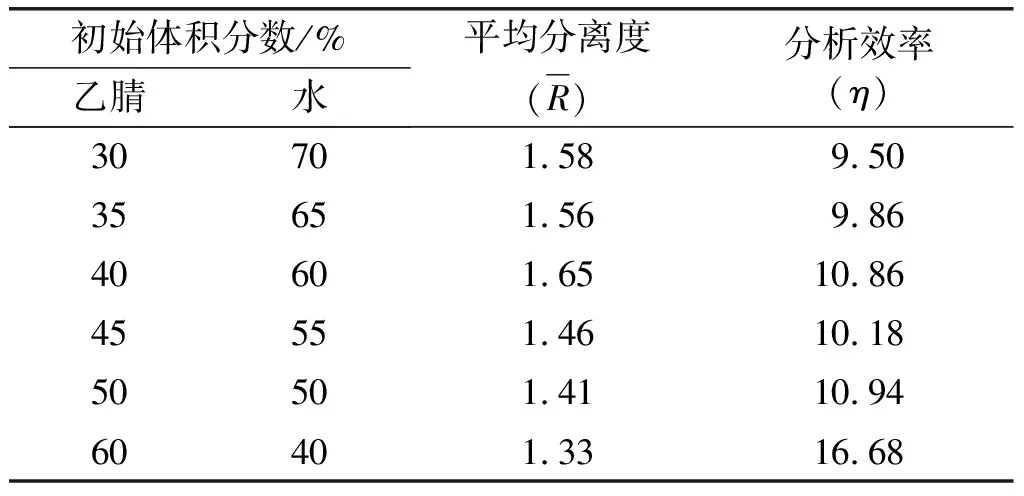
表3 初始体积分数对平均分离度及分析效率的影响
由表3可知,随着乙腈初始体积分数的增大,环肽的整体保留时间缩短,分析效率随之增大。乙腈初始体积分数从30%上升至50%时,分析效率稳步提高。当乙腈初始体积分数为60%时,分析效率上升为16.68,达到最高。从平均分离度看,乙腈初始体积分数从30%上升至40%时,平均分离度呈上升趋势。随着乙腈初始体积分数的继续增加,平均分离度明显下降。当乙腈初始体积分数达到45%时,平均分离度(1.46)已低于理论色谱峰分离度(1.5)[12]。随着乙腈初始体积分数的继续增加,分析效率达到最高时,平均分离度仅有1.33,环肽G与环肽F色谱峰发生重叠,该条件无法适用于环肽的分析。
在提高分析效率的同时,需保证适当的分离度。故40%的乙腈初始体积分数为最优。刘尊[16]、利嘉祥[17]等在初始体积分数为50%乙腈水的梯度洗脱程序下,41 min实现对环肽A、C、D、E洗脱。左洋等[15]在初始体积分数为30%乙腈水的梯度洗脱程序中,30 min内实现对氧化环肽完全洗脱,而还原态环肽出峰时间长达60 min,由于分析时间过长,不利于样品的高效率批量分析。在保证平均分离度的情况下,缩短分析时间,需进一步研究初始洗脱体积分数、进样量、流速与亚麻籽环肽各个峰之间,尤其是关键峰之间的分析效率。
2.2.4 流速对分析效果的影响
基于Kinetex®色谱柱,流动相乙腈-水初始体积分数40%-60%,进样量5 μL,乙腈以5%/min升至乙腈-水体积分数为90%-10%的条件下,考察流速对分析效果的影响,结果见表4。

表4 流速对平均分离度及分析效率的影响
由表4可知,在4种不同流速下,平均分离度变化不明显,最快流速下的分离度并没有明显减小,高流速下各个色谱峰仍能有效分离。说明该方法色谱柱柱效较高是分析时间大幅缩短的主要原因。从分析效率上看,随着流速的增加,出峰时间不断提前,保留时间几近等比例缩短,最后一个色谱峰的保留时间由最长的22.30 min缩短为8.99 min,分析时间缩短了2/3。在平均分离度相差不大的情况下,分析效率从4.50大幅增加至10.86。现有的研究报道中,并未见针对流速的优化研究。同时,为了保护仪器和色谱柱,液相仪器对柱压有一定限制,如接口材料、色谱填充材料的受压极限,确定最优流速为1 mL/min。
2.2.5 乙腈体积分数上升速率对分析效果的影响
基于Kinetex®色谱柱,进样量5 μL,流速0.5 mL/min,流动相乙腈-水初始体积分数40%-60%,最终乙腈-水上升至体积分数为90%-10%的条件下,考察乙腈体积分数上升速率对亚麻籽环肽分离效果的影响,结果见表5。

表5 乙腈体积分数上升速率对平均分离度和分析效率的影响
由表5可知,随着乙腈体积分数上升速率的减小,平均分离度呈增大趋势。在7%/min的上升速率下,平均分离度(1.40)已低于理论上色谱峰的分离度(1.5)要求,并不能对其进行有效积分及定量。随着乙腈体积分数上升速率的提高,分析效率相应上升,当上升速率为7%/min以上时,分析效率的增长趋于平缓,但分离度已大幅下降。综合考虑,以5%/min为最佳乙腈体积分数上升速率。
2.3 最佳分析条件
试验确定了以Kinetex® Phenyl-Hexyl LC柱(150 mm×4.6 mm,2.6 μm)为色谱柱,流动相乙腈-水初始体积分数为40%-60%洗脱,乙腈以5%/min速度升至乙腈-水体积分数为90%-10%,流速1 mL/min,进样量5 μL为最佳分析条件。在该条件下,色谱峰峰型较好,平均分离度为1.65,分析效率为10.86,总分析时间为9.09 min。较文献[15,17]大幅缩短时间,不存在色谱峰重叠现象。
2.4 亚麻籽、商品亚麻籽油及亚麻籽粕中环肽的含量(见表6)
由表6可知,亚麻籽中除环肽F、G、H、K外,其他环肽均有检出,其中环肽A的含量最高,为23.40%,环肽B次之,为23.11%。商品亚麻籽油中除环肽K、N、B外,其他11种环肽均有检出,化学性质最稳定的环肽A的含量最多(36.93%)。亚麻籽粕中还原态的亚麻籽环肽含量较低,环肽B相对含量为1.70%,环肽L相对含量为0.11%,由于压榨等加热工艺对环肽的氧化稳定性有一定影响,使含有蛋氨酸基团的环肽发生氧化[18]。商品亚麻籽油和亚麻籽粕中环肽种类及含量较亚麻籽的多,对于含有两个蛋氨酸砜基团的环肽F、G,亚麻籽粕中相对含量高达6.62%和19.65%,商品亚麻籽油中仅为2.56%和7.40%,而亚麻籽中未检出,可见亚麻籽环肽在亚麻籽中氧化程度较低,这说明亚麻籽壳对其仁具有一定的保护作用,可减缓环肽的氧化。亚麻籽中的环肽种类没有亚麻籽粕中环肽多,亚麻籽粕在保存、加工过程中环肽发生了部分氧化,导致种类增多[19]。通过亚麻籽环肽组成的分析,可以推断亚麻籽产品的来源及氧化程度。
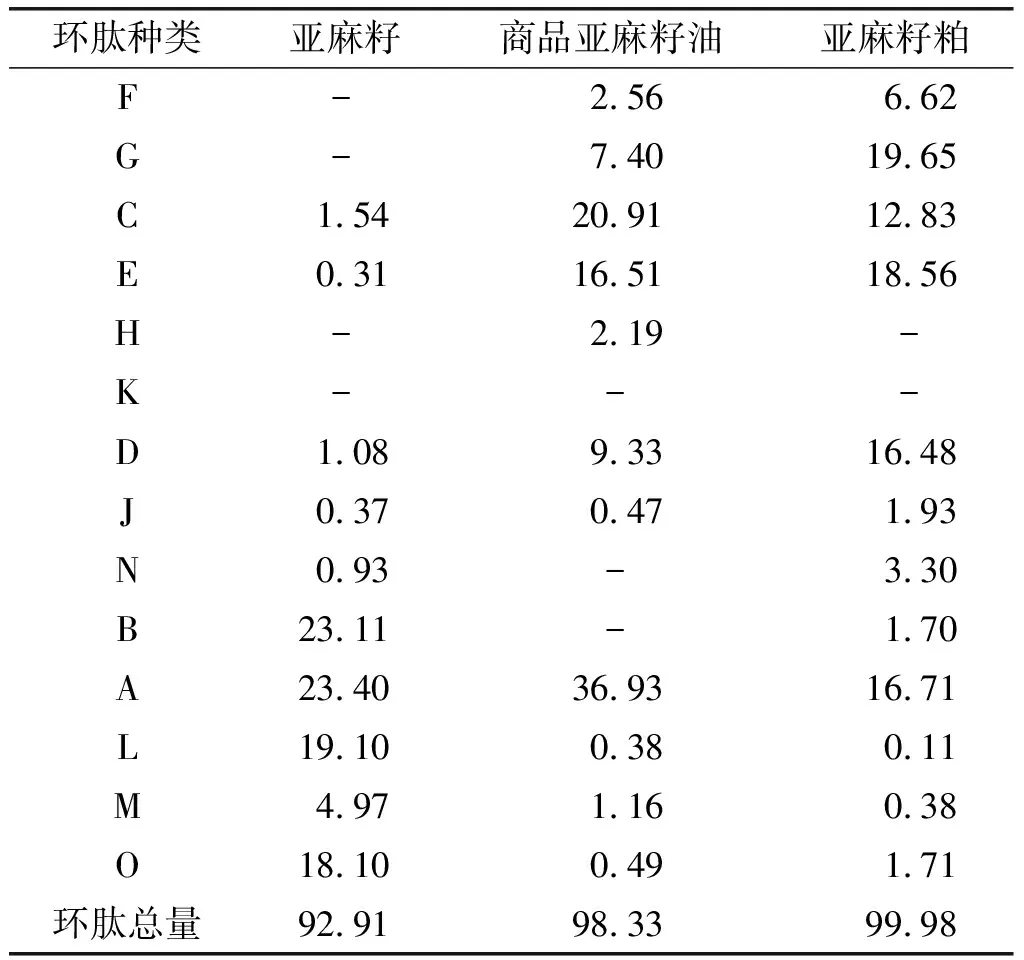
表6 样品中环肽的组成及相对含量 %
3 结 论
本研究通过优化亚麻籽环肽高效液相色谱分析条件,分析了亚麻籽、亚麻籽油及亚麻籽粕中环肽的组成和相对含量,探究了色谱柱、梯度洗脱初始体积分数、进样量、流速和乙腈体积分数上升速率对亚麻籽环肽HPLC分析的影响,并利用HPLC-ESI-MS进行定性分析。HPLC最优条件为:采用Kinetex®色谱柱,流动相乙腈-水初始体积分数为40%-60%,乙腈以5%/min升至乙腈-水体积分数为90%-10%,流速1 mL/min,进样量5 μL。最优条件下环肽混合标样的平均分离度为1.65,分析效率为10.86,分析时间为9.09 min。该方法可有效、快速检测亚麻籽、商品亚麻籽油和亚麻籽粕中的环肽组成。本研究可为今后亚麻籽相关产品的溯源、品质评价等方面,提供一定的分析方法基础。
