蓬莪术吉玛烷型倍半萜化学成分研究
2021-01-05李小翠陈金凤
李小翠,陈金凤,熊 亮,彭 成,郭 力*,刘 菲*
蓬莪术吉玛烷型倍半萜化学成分研究
李小翠1, 2,陈金凤1, 2,熊 亮1, 2,彭 成1,郭 力1, 2*,刘 菲1, 2*
1. 成都中医药大学药学院,中药材标准化教育部重点实验室,四川 成都 611137 2. 成都中医药大学,西南特色药材创新药物成分研究所,四川 成都 611137
研究蓬莪术根茎中吉玛烷型倍半萜化学成分及其抗血小板聚集活性。采用硅胶柱色谱、葡聚糖凝胶Sephadex LH-20柱色谱、反相中压液相色谱、制备薄层色谱及半制备高效液相色谱等技术进行分离纯化,运用现代波谱学手段鉴定各化合物的结构,采用计算电子圆二色谱(ECD)方法确定新化合物的绝对构型;对分离得到的相应化合物分别进行了体外腺苷-5′-二磷酸钠盐(ADP)及花生四烯酸(AA)诱导的抗血小板聚集活性筛选。从蓬莪术茎95%乙醇提取物的中醋酸乙酯及正丁醇萃取部位共分离得到8个吉玛烷型倍半萜,分别鉴定为新蓬莪术环氧酮(1)、curdionolide B(2)、curdionolide A(3)、(−)-phaeocaulin A(4a)、(+)-phaeocaulin A(4b)、heyneanone C(5)、(4,5)-13-hydroxygermacrone 4,5-epoxide(6)、phagermadiol(7),测试了分离所得化合物1~3、6对ADP及AA诱导的抗血小板聚集活性。共从蓬莪术中分离得到8个吉玛烷型倍半萜,其中化合物1为新化合物,并通过计算ECD确定了绝对构型,其对ADP及AA诱导的血小板聚集具有一定的抑制作用;化合物4a和4b为一对对映异构体;化合物2、3、5、6均为首次从蓬莪术中分离得到。
蓬莪术;吉玛烷型倍半萜;计算电子圆二色谱;抗血小板聚集活性;新蓬莪术环氧酮
莪术为姜科植物蓬莪术Val.、广西莪术S. G. Lee et C. F. Liang或温郁金Y. H. Chen et C. Ling的干燥根茎,是传统的活血化瘀中药,药用历史悠久,具有行气破血、消积止痛的功效,临床上常用于治疗痛经、瘀血经闭、胸痹心痛等妇科疾病和心血管疾病[1-3]。现代研究表明,莪术具有抗血小板聚集、抗血栓、抗炎、抗肿瘤等活性,有效成分主要为挥发油和姜黄素类成分,其中挥发油以倍半萜为主[4‑8]。目前对莪术“活血”功效研究多集中于提取物、姜黄素类化合物及莪术二酮等量大的萜类成分,生物活性涉及抗血小板聚集、抗血栓等,可见关于莪术萜类单体成分的活血作用相关研究还明显不足[9-11]。基于此思考,本课题组前期选择川产道地药材蓬莪术进行了一系列探索,通过抗血小板聚集活性筛选发现莪术萜类及姜黄素类成分均具有抗血小板聚集活性,但萜类强于姜黄素类成分。可见,萜类成分可能是莪术传统功效物质基础之一,是除姜黄素类以外非常值得重视的另一类药效物质,其对全面揭示莪术的活血药效物质基础具有重要意义。
因此,为进一步阐明莪术传统功效的药效物质,本课题在前期研究基础上进一步对莪术萜类成分进行了研究,共分离得到8个吉玛烷型倍半萜(图1),经波谱解析分别鉴定为(1,4,5,9,10)- 9-hydroxy-zederone epoxide(1)、curdionolide B(2)、curdionolide A(3)、(−)-phaeocaulin A(4a)、(+)-phaeocaulin A(4b)、heyneanone C(5)、(4,5)-13-hydroxygermacrone 4,5-epoxide(6)、phagermadiol(7)。其中化合物1为新化合物,命名为新蓬莪术环氧酮(neozederone epoxide),利用计算电子圆二色谱(ECD)确定了其绝对构型,化合物4a和4b为一对对映异构体。化合物2、3、5、6均为首次从蓬莪术中分离得到。最后对分离得到的化合物进行了体外腺苷-5′-二磷酸钠盐(ADP)及花生四烯酸(AA)诱导的抗血小板聚集活性筛选。

图1 化合物1~7的结构
1 仪器与材料
1.1 实验仪器
Büchi Gradient Former B-687中压液相色谱仪(Rp C18,40~60 μm,Welch公司);半制备型C18色谱柱(250 mm×10 mm,5 μm,Welch公司);分析型C18色谱柱(150 mm×4.6 mm,4 μm,美国Agilent公司);Chiralpak AD-H手性柱(250 mm×4.6 mm,5 μm,手性拆分柱,日本大赛璐公司);圆二色谱仪(Chirascan CD光谱仪,英国应用光物理公司);Agilent Technologies 1100 Series高效液相色谱仪(美国Agilent公司);Waters Synapt G2高分辨质谱仪(美国Waters公司);Bruker AVIII HD-600核磁共振波谱仪(德国Bruker公司);Anton Paar MCP 200旋光测定仪(美国Anton Paar公司);Agilent cary 600 FT-IR(美国Agilent公司);Milli-Q超纯水仪(美国Milli-pore公司);SC-2000 型血小板聚集测试仪(北京赛科希德科技发展有限公司);Allegra X-30R型超速冷冻离心机(美国Beckman Coulter公司)。
1.2 实验材料
薄层色谱硅胶(GF254硅胶)、柱色谱硅胶(200~300目,H硅胶),青岛海洋化工厂;葡聚糖凝胶Sephadex LH-20(瑞典Amershan Pharmacia公司);色谱甲醇及乙腈(美国Sigma公司);其他常规试剂均为成都市科隆化学品有限公司的分析纯试剂;ADP(批号N0306A)及AA(批号J20713A)均购自大连美伦生物技术有限公司。
新西兰兔,雄性,质量2.2~2.5 kg,购自成都达硕动物科技有限公司,实验动物生产许可证号:SCXK(川)2015-030。动物实验经成都中医药大学实验动物伦理委员会审核,均符合3R原则。
1.3 药材
蓬莪术药材采于四川省崇州市三江镇宋桥村,经成都中医药大学高继海副教授鉴定为蓬莪术Val.的干燥根茎,植物标本(CP-20180303)保存于成都中医药大学西南特色药材创新药物成分研究所。
2 方法与结果
2.1 提取与分离
蓬莪术药材(50 kg)粉碎后用95%乙醇回流提取3次,每次3 h,减压浓缩后将浸膏分散于水中,依次用石油醚、醋酸乙酯、正丁醇萃取。将各部分萃取液浓缩,得到石油醚浸膏(1 kg)、醋酸乙酯浸膏(300 g)和正丁醇浸膏(500 g)。将醋酸乙酯浸膏用硅胶柱色谱分离,以石油醚-醋酸乙酯(5∶1~0∶1)和醋酸乙酯-甲醇(1∶0~0∶1)梯度洗脱得到11个洗脱部分(A~K)。其中D组分经葡聚糖凝胶Sephadex LH-20柱色谱,二氯甲烷-甲醇(1∶1)等度洗脱,得到4个流分(Fr. 1~4)。Fr. 2经反向中压液相色谱,甲醇-水(20∶80~0∶100)梯度洗脱,得到8个流分(Fr.2-1~2-8),其中Fr. 2-2经葡聚糖凝胶Sephadex LH-20柱色谱,石油醚-二氯甲烷-甲醇(5∶5∶1)等度洗脱,再经硅胶柱色谱[二氯甲烷-甲醇(100∶1~1∶1)]梯度洗脱后,进行反相半制备液相色谱分离,以40%甲醇为流动相进行洗脱,体积流量1.5 mL/min,分离得到化合物1(5 mg,R=50 min)。Fr. 2-5经葡聚糖凝胶Sephadex LH-20柱色谱,石油醚-二氯甲烷-甲醇(5∶5∶1)等度洗脱,得到6个流分(Fr.2-5-1~2-5-6)。其中Fr.2-5-1经硅胶柱色谱,二氯甲烷-丙酮(100∶1~1∶1)梯度洗脱后,以23%乙腈为流动相,体积流量1 mL/min,进行液相色谱分离(分析柱),得到化合物2(6 mg,R=12.4 min)。Fr. 2-5-6经高效液相色谱(分析柱),以30%乙腈水为流动相,体积流量1 mL/min,分离得到化合物3(4.6 mg,R=8.9 min)。
E组分经葡聚糖凝胶Sephadex LH-20柱色谱,二氯甲烷-甲醇(1∶1)等度洗脱,得到3个流分(Fr. 1~3),其中Fr. 2经葡聚糖凝胶Sephadex LH-20柱色谱,石油醚-二氯甲烷-甲醇(5∶5∶1)等度洗脱得到7个流分(Fr. 2-1~2-7)。Fr. 2-3经反相中压液相色谱,以10%~100%甲醇溶液进行梯度洗脱得到10个流分(Fr. 2-3-1~2-3-10),其中Fr. 2-3-3经葡聚糖凝胶Sephadex LH-20柱色谱[石油醚-二氯甲烷-甲醇(5∶5∶1)]等度洗脱后,再经液相色谱(分析柱),以45%甲醇等度洗脱,体积流量1 mL/min,分离到到化合物6(10 mg,R=6.2 min)。
F组分经反相中压液相色谱,以5%~100%甲醇梯度洗脱,得到19个流分(Fr. 1~19),其中Fr.8经过葡聚糖凝胶Sephadex LH-20柱色谱,石油醚-二氯甲烷-甲醇(5∶5∶1)等度洗脱得到7个流分(Fr. 8-1~8-7)。Fr. 8-6经硅胶柱色谱分离,二氯甲烷-丙酮(50∶1~1∶1)梯度洗脱得到9个流分(Fr. 8-6-1~8-6-9),其中Fr. 8-6-6经反相半制备液相色谱,以50%甲醇为流动相,体积流量1.5 mL/min,分离得到化合物4(1.3 mg,R=47 min)。外消旋混合物4经Daicel Chiralpak AD-H柱,正己烷-乙醇(10∶1)进行手性拆分,得到对映异构体4a(0.5 mg,R=13.9 min)和4b(0.4 mg,R=15.0 min)。Fr. 9经过葡聚糖凝胶Sephadex LH-20柱色谱,石油醚-二氯甲烷-甲醇(5∶5∶1)等度洗脱得到3个流分(Fr. 9-1~9-3)。Fr. 9-1经半制备薄层色谱[二氯甲烷-丙酮(20∶1)]分离后,再经反相半制备液相色谱,以50%甲醇水洗脱,体积流量1.5 mL/min,分离到到化合物5(0.4 mg,R=41 min)。
正丁醇萃取物经大孔吸附树脂,以不同体积分数乙醇(20%、50%、70%、95%)进行梯度洗脱,回收溶剂得到4个流分(Fr. 1~4)。其中Fr.2经反相中压液相色谱,以30%~85%甲醇梯度洗脱得到12个流分(Fr. 2-1~2-12)。Fr. 2-2经硅胶柱色谱分离,二氯甲烷-甲醇(200∶1~0∶1)梯度洗脱,得到10个流分(Fr. 2-2-1~2-2-10)。Fr. 2-2-3先后经反相中压液相色谱(20%~100%甲醇)和硅胶柱色谱[二氯甲烷-甲醇(100∶1~0∶1)]分离后,以35%甲醇为流动相,体积流量1 mL/min,进行反相半制备液相色谱分离,得到化合物7(0.6 mg,R=63 min)。
2.2 化合物鉴定
为进一步确定化合物1的结构,进行了2D NMR实验(图2),通过化合物1的1H-1H COSY谱中相关信号以及HMBC谱中H3-14与C-1、C-9、C-10相关,OH-9与C-9、C-10相关,H-9与C-1、C-7、C-8、C-10相关,H3-15与C-3、C-4、C-5相关,H-5与C-3、C-6、C-7相关确证了C-1至C-10形成了4,10-二甲基-9-羟基-6-环癸酮。此外进一步根据HMBC谱中H3-13与C-7、C-11、C-12相关以及H-12与C-7、C-8相关确定了结构中C-7、C-8和C-11~C-13形成了11位甲基取代呋喃环。最后结合该化合物的不饱和度及连氧碳情况确定了化合物1的平面结构如图1所示。
在化合物1的NOESY谱中,H3-14与H-5、H-9相关,H-3与H-5相关,以及H3-15与H-1相关,表明H-1和H3-15位于同侧,而与H-5、H-9和H3-14位于异侧。进一步,通过ECD与实验ECD谱对比的方法(图3)确定了化合物1的绝对构型。使用IEFPCM模型在甲醇中针对(1,4,5,9,10)-1和(1,4,5,9,10)-1在CAM-B3LYP/DGDZVP计算水平上计算得到的ECD谱如图3所示。结果表明计算出的(1,4,5,9,10)-1 ECD谱与实验ECD谱吻合,因此化合物1确定为(1,4,5,9,10)-9-hydroxy- zederone epoxide,并命名为新蓬莪术环氧酮。
化合物2:无色油状物。ESI-MS/: 249 [M+H]+。1H-NMR (600 MHz, acetone-6): 5.08 (1H, brs, H-8), 4.87 (1H, brs, H-1), 3.52 (1H, d,= 16.3 Hz, H-6a), 2.91 (1H, brs, H-9a), 2.55 (1H, brs, H-4), 2.29 (1H, m, H-2a), 2.00 (2H, m, H-2b, 3a), 1.95 (1H, m, H-9b), 1.88 (3H, s, H-15), 1.77 (3H, s, H-13), 1.75 (2H, overlapped, H-3b, 6b), 1.04 (3H, d,= 7.0 Hz, H-14);13C-NMR (125 MHz, acetone-6): 209.4 (C-5), 173.8 (C-12), 157.8 (C-7), 133.8 (C-1), 130.7 (C-10), 128.5 (C-11), 80.4 (C-8), 48.3 (C-4), 47.4 (C-9), 42.3 (C-6), 36.7 (C-3), 27.9 (C-2), 18.8 (C-14), 16.0 (C-15), 9.3 (C-13)。以上数据与文献报道基本一致[12],故鉴定化合物2为curdionolide B。
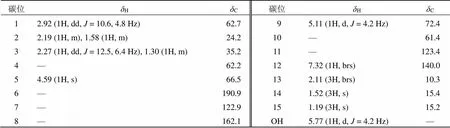
表1 化合物1的1H-NMR及13C-NMR数据 (600/150MHz, acetone-d6)
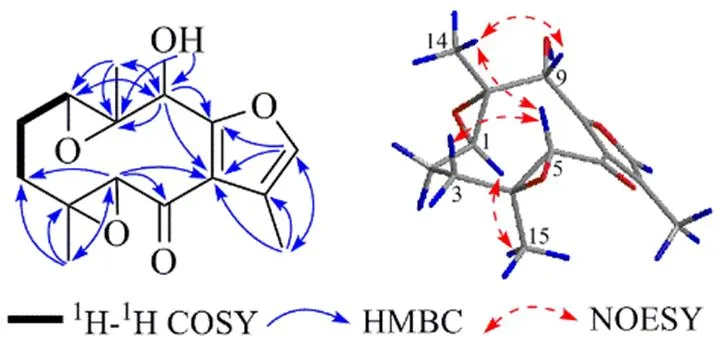
图2 化合物1的1H-1H COSY、HMBC和NOESY相关信号
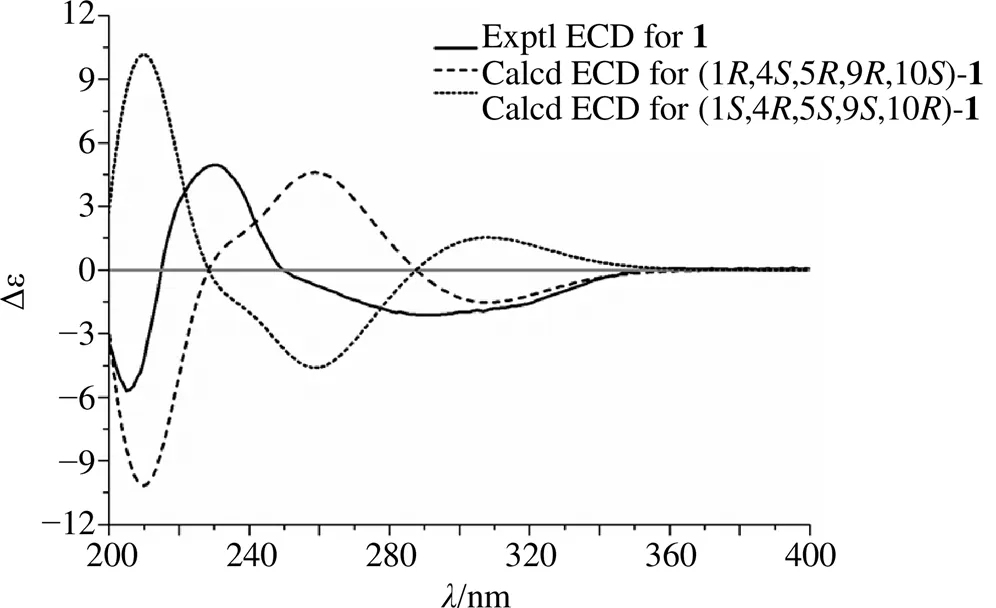
图3 化合物1的实测和计算ECD谱图
化合物3:无色油状物。ESI-MS/: 265 [M+H]+。1H-NMR (600 MHz, acetone-6): 4.85 (1H, d,= 11.7 Hz, H-1), 3.61 (1H, d,= 15.8 Hz, H-6a), 3.51 (1H, d,= 15.8 Hz, H-6b), 2.87 (1H, d,= 13.2 Hz, H-9a), 2.56 (1H, m, H-4), 2.31 (1H, m, H-2a), 2.23 (1H, d,= 13.2 Hz, H-9b), 2.00 (2H, m, H-2b, H-3a), 1.96 (3H, s, H-15), 1.79 (3H, s, H-13), 1.69 (1H, m, H-3b), 1.02 (3H, d,= 6.9 Hz, H-14);13C-NMR (125 MHz, acetone-6): 209.7 (C-5), 171.5 (C-12), 155.4 (C-7), 134.2 (C-1), 131.6 (C-10), 130.0 (C-11), 107.0 (C-8), 50.8 (C-9), 48.2 (C-4), 40.9 (C-6), 36.9 (C-3), 27.9 (C-2), 18.7 (C-14), 16.8 (C-15), 9.4 (C-13)。以上数据与文献报道基本一致[12],故鉴定化合物3为curdionolide A。
化合物4a和4b:无色油状物。ESI-MS/: 262 [M+H]+。1H-NMR (600 MHz, acetone-6): 6.42 (1H, s, H-5), 4.95 (1H, m, H-1), 2.86 (1H, m, H-3a), 2.73 (1H, d,= 12.8 Hz, H-9a), 2.28 (1H, d,= 12.8 Hz, H-9b), 2.22 (1H, m, H-2a), 2.15 (1H, m, H-3b), 2.07 (1H, m, H-2b), 1.88 (6H, m, H-13, 14), 1.69 (3H, s, H-15);13C-NMR (125 MHz, acetone-6) δ: 193.1 (C-6), 169.2 (C-12), 151.5 (C-7), 146.1 (C-4), 137.7 (C-10, 11), 129.9 (C-5), 127.1 (C-1), 91.1 (C-8), 49.6 (C-9), 29.6 (C-3), 25.6 (C-2), 24.1 (C-14), 17.7 (C-15), 9.1 (C-13)。以上数据与文献报道的 phaeocaulin A[13]基本一致。化合物4为外消旋混合物,经手性高效液相色谱分离得到一对对映异构体4a和4b,其ECD数据分别为{ECD (MeCN)max(Δε) 236 (+30.7), 293 (−18.0), 360 (+2.2) nm; 4a}; {ECD (MeCN)max(Δε) 236(−30.4), 293 (+17.9), 360 (−2.1) nm; 4b}。通过与文献中(+)/(−)-phaeocaulin A[13]的ECD数据进行对比分析,最终确定化合物4a为(−)-phaeocaulin A,4b为(+)-phaeocaulin A。
化合物5:无色油状物。ESI-MS/: 269 [M +H]+。1H-NMR (600 MHz, acetone-6): 5.64 (1H, s, H-9), 4.33 (1H, m, H-1), 3.51 (1H, dd,= 13.2, 3.8 Hz, H-5), 2.88 (1H, t,= 13.2 Hz, H-6a), 2.64 (1H, dd,= 13.2, 3.8 Hz, H-6b), 2.32 (1H, m, H-2a), 2.09 (3H, s, H-13), 1.90 (3H, s, H-12), 1.86 (1H, m, H-2b), 1.76 (3H, s, H-15), 1.70 (1H, m, H-3a), 1.49 (1H, m, H-3b), 1.17 (3H, s, H-14);13C-NMR (125 MHz, acetone-6): 198.1 (C-8), 145.5 (C-11), 144.9 (C-10), 132.6 (C-7), 128.4 (C-9), 83.3 (C-5), 74.1 (C-1), 69.3 (C-4), 32.7 (C-6), 29.0 (C-3), 27.6 (C-14), 23.6 (C-12, 13), 22.3 (C-15), 21.6 (C-2)。以上数据与文献报道基本一致[14],故鉴定化合物5为heyneanone C。
化合物6:无色油状物。ESI-MS/: 251 [M+H]+。1H-NMR (600 MHz, acetone-6): 5.26 (1H, m, H-1), 4.26 (2H, m, H-13), 4.18 (1H, m, H-5), 1.87(3H, s, H-12), 1.71 (3H, s, H-15), 0.96 (3H, s, H-14);13C-NMR (125 MHz, acetone-6): 204.0 (C-8), 138.2 (C-11), 135.6 (C-10), 130.6 (C-1), 127.2 (C-7), 64.8 (C-5), 62.6 (C-13), 60.7 (C-4), 55.6 (C-9), 38.3 (C-3), 29.5 (C-6), 25.2 (C-2), 18.4 (C-12), 17.2 (C-15), 16.2 (C-14)。以上数据与文献报道基本一致[15],故鉴定化合物6为(4,5)-13-hydroxygermacrone 4,5- epoxide。
化合物7:无色油状物。ESI-MS/: 267 [M+H]+。1H-NMR (600 MHz, CD3OD): 6.16 (1H, s, H-9), 3.20 (1H, dd,= 13.8, 6.3 Hz, H-5), 2.54 (1H, dd,= 12.7, 6.3 Hz, H-6a), 2.49 (1H, m, H-3a), 2.43 (1H, m, H-3b),2.20 (3H, s, H-15), 2.16 (2H, m, H-2), 2.05 (1H, dd,= 13.8, 12.7 Hz, H-6b), 1.31 (3H, s, H-12), 1.30 (3H, s, H-13), 1.26 (3H, s, H-14);13C-NMR (125 MHz, CD3OD): 166.7 (C-8), 160.8 (C-10), 126.7 (C-9), 120.9 (C-7), 96.6 (C-1), 74.5 (C-11), 71.8 (C-5), 71.3 (C-4), 48.0 (C-3), 32.5 (C-2), 29.3 (C-6), 25.0 (C-12, 14, 15), 23.4 (C-13)。以上数据与文献报道基本一致[16],故鉴定化合物6为phagermadiol。
在分离纯化过程中,除化合物1~3、6外,其余化合物量较少,所以本实验对化合物1~3、6进行了抗血小板聚集活性筛选。
2.3 抗血小板聚集实验[17]
家兔心脏取血,3.8%枸橼酸三钠溶液抗凝,血液与抗凝剂比例为9∶1,收集于离心管中,轻轻颠倒混匀。800 r/min离心10 min,取上清液,共离心2次,合并即得富血小板血浆(PRP)。下层血液以3500 r/min离心10 min,取上清液即为贫血小板血浆(PPP)。实验分为对照组、阿司匹林阳性对照组(100、50、25 μmol/L)及实验组(100、50、25 μmol/L),重复5次。取比浊管,分别加入290 μL PPP后,再分别加入各组对应溶液10 μL,作为空白溶液。另取比浊管,各加入280 μL PRP,再分别加入各组对应剂量溶液10 μL,作为相应的待测溶液。血小板聚集仪预热至37 ℃,以空白溶液调零后,换为对应待测溶液,预热60 s,加入ADP(10 μmol/L)或AA(0.5 mmol/L)10 μL诱导血小板聚集,测定各待测溶液组血小板聚集率,计算血小板聚集抑制率。
聚集抑制率=(对照组血小板聚集率-给药组血小板聚集率)/对照组血小板聚集率
蓬莪术作为传统活血化瘀中药莪术的重要来源之一,具有抗血小板聚集、抗血栓等活性[18-19],因此对分离得到的相应单体化合物(1~3、6)进行了抗血小板聚集活性筛选。实验结果显示,100 μmol/L阳性药阿司匹林对ADP及AA诱导的血小板聚集抑制率分别为(44.83±1.24)%和(72.74±7.54)%,化合物1在100 μmol/L时对ADP及AA诱导的血小板聚集具有一定的抑制作用,抑制率分别为(21.07±8.67)%和(27.73±6.42)%,而其余3个化合物(2、3、6)在100 μmol/L时均无抑制作用。
3 讨论
蓬莪术为传统的川产活血化瘀中药,药用历史悠久,对妇科疾病及心脑血管疾病具有显著疗效,且现代研究表明这些疾病均与活血化瘀功效密切相关。因此,进行蓬莪术活血化瘀功效的现代研究具有深远的科学意义和社会价值。本研究采用现代分离手段和有机波谱学技术,共从蓬莪术中分离鉴定8个吉玛烷型倍半萜,其中1为新化合物,并通过计算ECD确定了其绝对构型。现代研究表明莪术具有较好的抗血小板聚活性,而抑制血小板聚集的异常发生,对血栓栓塞性心血管疾病的防治具有重要意义[18-20]。因此,对分离所得化合物进行了ADP及AA诱导的抗血小板聚集活性筛选,试验结果表明,除化合物1在100 μmol/L时对ADP及AA诱导的血小板聚集具有一定抑制作用外,其余化合物(2、3、6)均无明显抑制血小板聚集的作用。可见,蓬莪术中吉玛烷型倍半萜在抗血小板聚集方面活性欠佳,活性较强的成分有待进一步探究。本研究丰富了蓬莪术倍半萜类化合物,且为后续继续寻找与其活血功效相关的药效物质奠定了基础和方向。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2015: 274-275.
[2] 王菊. 醋制莪术对CYP450酶的调控及入肝机制的初步研究 [D]. 南京: 南京中医药大学, 2013.
[3] 李瑶, 吴建华, 谢艳华. 莪术油的研究进展 [J]. 陕西中医药大学学报, 2017, 40(3): 118-121.
[4] 陈金凤, 熊亮, 刘菲, 等. 蓬莪术姜黄素类化学成分研究 [J]. 中草药, 2020, 51(1): 16-20.
[5] 彭炳先, 陈受惠. HPLC测定不同产地莪术中3种有效成分的含量 [J]. 中国药学杂志, 2009, 44(22): 1742-1744.
[6] Zhu J J, An Y W, Hu G,. Simultaneous determination of multiple sesquiterpenes inherbal medicines and related products with one single reference standard [J]., 2013, 18(2): 2110-2121.
[7] 赵志梅, 张立杰, 夏天, 等. 莪术主要单体成分抗炎、抗肿瘤作用研究进展 [J]. 药物评价研究, 2017, 40(1): 119-124.
[8] 彭炳先, 周欣, 王道平, 等. 中药蓬莪术化学成分的研究 [J]. 时珍国医国药, 2005, 16(11): 1091-1092.
[9] 陈晓军, 韦洁, 蒋珍藕, 等. 广西莪术乙酸乙酯部位的抗血栓作用 [J]. 中成药, 2018, 40(6): 1238-1242.
[10] 徐雨静. 广西醋莪术活血化瘀物质基础研究 [D]. 广州: 广东药科大学, 2017.
[11] 王秀. 莪术二酮抗血栓和抗血小板聚集作用研究 [D]. 合肥: 安徽医科大学, 2012.
[12] Lou Y, Zhao F, Wu Z H,. Germacrane-type sesquiterpenes from[J]., 2009, 92(8): 1665-1672.
[13] Xia G Y, Sun D J, Ma J H,. (+)/(–)-Phaeocaulin A-D, four pairs of new enantiomeric germacrane-type sesquiterpenes fromas natural nitric oxide inhibitors [J]., 2017, 7: 43576.
[14] Saifudin A, Tanaka K, Kadota S,. Sesquiterpenes from the rhizomes of[J]., 2013, 76(2): 223-229.
[15] Kuroyanagi M, Ueno A, Koyama K,. Structures of sesquiterpenes ofSalisb. II. Studies on minor sesquiterpenes [J]., 1990, 38(1): 55-58.
[16] Ma J H, Wang Y, Liu Y,. Four new sesquiterpenes from the rhizomes ofand their iNOS inhibitory activities [J]., 2015, 17(5): 532-540.
[17] Liu F, Chen J F, Qiao M M,. Seven pairs of new enantiomeric sesquiterpenoids from[J]., 2020, 99: 103820.
[18] 毛春芽, 谢辉, 陆兔林. 莪术炮制品的抗血小板聚集及抗凝血作用 [J]. 中药材, 2000, 23(4): 212-213.
[19] 王秀, 夏泉, 许杜娟, 等. 莪术中莪术二酮抗凝血和抗血栓作用的实验研究 [J]. 中成药, 2012, 34(3): 550-553.
[20] Showkathali R, Natarajan A. Antiplatelet and antithrombin strategies in acute coronary syndrome: State-of-the-art review [J]., 2012, 8(3): 239-249.
Study on germacrane-type sesquiterpenoids from
LI Xiao-cui1, 2, CHEN Jin-feng1, 2, XIONG Liang1,2, PENG Cheng1, GUO Li1, 2, LIU Fei1, 2
1. Key Laboratory of Standardization of Chinese Herbal Medicine, Ministry of Education, School of Pharmacy, Chengdu University of TCM, Chengdu 611137, China 2. Institute of Innovative Medicine Ingredients of Southwest Specialty Medicinal Materials, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
To study the chemical constituents and anti-platelet aggregative activities of germacrane-type sesquiterpenoids from the rhizome of.Ethyl acetate and-butanol fractions were separated and purificated by silica gel column, sephadex LH-20 column, reversed-phase medium pressure chromatography, preparative thin-layer chromatography, and semi-preparative high performance liquid chromatography. The structures of isolates were determined by modern spectroscopy techniques, and the absolute configuration of new compound was identified by calculating ECD. The isolates were tested for their effects on ADP- and AA-induced platelet aggregation.Eight germacrane-type sesquiterpenoids were isolated from the rhizome of, and identified as neozederone epoxide (1), curdionolide B (2), curdionolide A (3), (−)-phaeocaulin A (4a), (+)-phaeocaulin A (4b), heyneanone C (5), (4,5)-13-hydroxygermacrone 4,5-epoxide (6), phagermadiol (7). The anti-platelet aggregation effects of compounds 1—3 and 6 were tested by suppressing ADP- and AA-induced platelet aggregation.Eight germacrane-type sesquiterpenoids were isolated from. Compound 1 is a new compound, and the absolute configuration of 1 is determined by calculating ECD, and compound 1 has a certain inhibitory effect on ADP- and AA-induced platelet aggregation. Compounds 4a and 4b are a pair of enantiomers. Furthermore, compounds 2, 3, 5 and 6 are isolated from the rhizome offor the first time.
Val.; germacrane-type sesquiterpenoids; ECD calculation; anti-platelet aggregative activity; neozederone epoxide
R284.1
A
0253 - 2670(2021)01 - 0028 - 07
10.7501/j.issn.0253-2670.2021.01.005
2020-09-23
国家自然科学基金项目(81903777);国家自然科学基金项目(82022072);中国博士后科学基金资助项目(2019M653362);成都中医药大学“杏林学者”学科人才科研提升计划(BSH2018009);四川省青年科技创新研究团队专项计划项目(2017TD0001,2016TD0006)
李小翠(1994—),在读硕士,从事中药药效物质基础研究。E-mail: 1527407972@qq.com
刘 菲(1989—),博士,从事中药药效物质基础研究。E-mail: feifeifly555@126.com
郭 力(1964—),男,教授,博士生导师,从事中药化学成分及药效物质基础研究。E-mail: gli64@sina.com
[责任编辑 王文倩]
