山药麸炒前后有效成分含量及UPLC指纹图谱差异性研究
2021-01-05王碧君黄上书梁慧杨文惠罗宇琴孙冬梅陈向东
王碧君,黄上书,梁慧,杨文惠,罗宇琴,孙冬梅,陈向东
(广东一方制药有限公司/广东省中药配方颗粒企业重点实验室,广东 佛山 528244)
山药为薯蓣科植物薯蓣DioscoreaoppositaThunb. 的干燥根茎,主要分布于山西,河北安国,陕西朝邑、华县、同州,河南新乡等地,以河南为道地产区。山药作为药食两用佳品,味甘,性平,具有补脾养胃、生津益肺、补肾涩精之功,临床用于脾虚食少、肺虚喘咳、肾虚遗精、虚热消渴等症[1]。山药生品长于补虚,麸炒后健脾和胃功效增强,临床上麸炒山药主要作为滋阴或补阳的臣药,功偏补益[2-6]。现代研究表明,山药主要含有山药多糖、黄酮、山药碱、尿囊素、腺苷、甾体化合物等成分[7-8],具有抗氧化、抗衰老、调节免疫、抗肿瘤、降血糖的作用。
目前,2015年版《中国药典》对山药的质量控制缺乏有效成分的限定,本研究对不同产地山药及其麸炒品进行研究,建立山药和麸炒山药饮片尿囊素的HPLC含量测定方法,及山药和麸炒山药饮片UPLC指纹图谱方法及腺苷的含量测定方法,并结合相似度分析对山药及其炮制品的指纹图谱差异进行评价,为全面评价山药的质量提供参考。
1 仪器与材料
1.1 仪器
Waters e2695高效液相色谱仪;Waters H-class超高效液相色谱仪;ME204E万分之一电子分析天平(梅特勒-托利多公司);XP26百万分之一电子分析天平(梅特勒-托利多公司);KQ500DE超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
乙醇(天津市永大化学试剂有限公司)、甲醇(广东光华科技股份有限公司)为分析纯;乙腈(默克股份有限公司)、磷酸(天津市科密欧化学试剂有限公司)为色谱纯;水为超纯水(实验室自制)。腺苷(批号110879-201703,质量分数99.7%,中国食品药品检定研究院);尿囊素(批号111501-200202,质量分数100%,中国食品药品检定研究院);麸皮(批号FH1810001,温县三方农贸有限公司)。
10批山药生品来源于全国不同产地,经广东一方制药有限公司魏梅主任中药师鉴定为薯蓣科植物薯蓣DioscoreaoppositaThunb.的干燥根茎。麸炒山药为同批山药的炮制加工品,炮制工艺:每100 kg山药片用麸皮10~15 kg。样品采集信息见表1。
2 方法与结果
2.1 山药及麸炒山药指纹图谱的建立
2.1.1 色谱条件 色谱柱:YMC Triart 色谱柱(100 mm×2.1 mm,1.9 μm);流动相:乙腈(A)-0.2%磷酸水溶液(B),梯度洗脱(0~4 min,1%A;4~10 min,1%→3%A;10~25 min,3%→20%A);流速:0.20 mL/min;柱温:30 ℃,检测波长:258 nm;进样量:1 μL。
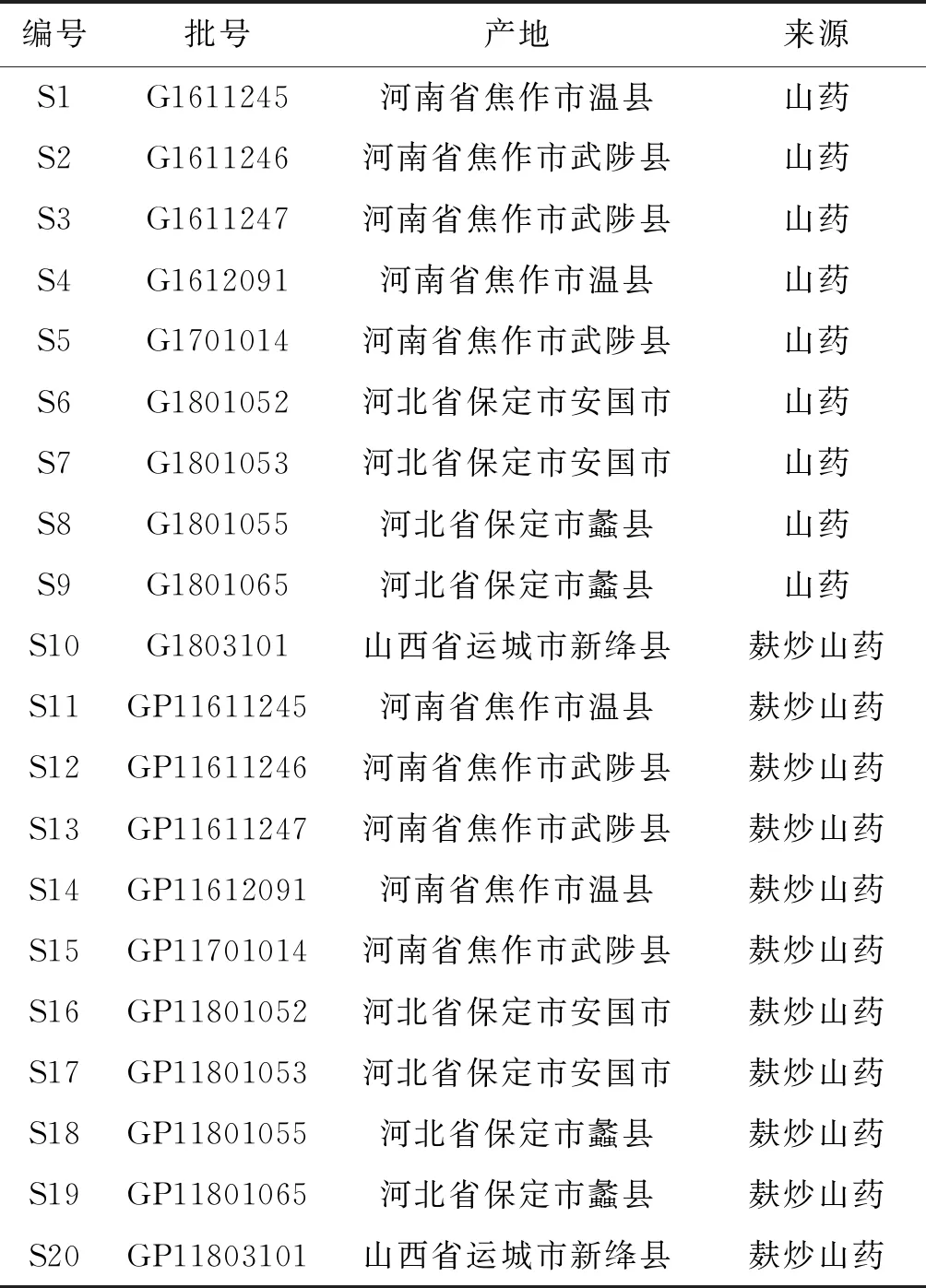
表1 样品信息
2.1.2 供试品溶液的制备 取饮片粉末(过四号筛)约0.5 g,精密称定,置具塞锥形瓶中,加入10%(体积分数,下同)甲醇15 mL,超声处理(功率300 W,频率40 kHz)30 min,放冷,离心,取上清液,残渣再加入10%甲醇10 mL,超声处理(功率300 W,频率40 kHz)30 min,放冷,离心,合并2次上清液,定容至25 mL,摇匀,滤过,取续滤液,即得。
2.1.3 对照品溶液的制备 取腺苷对照品适量,加10%甲醇制成质量浓度为0.227 mg/mL的对照品溶液。
2.1.4 精密度试验 日内精密度:取同一批饮片粉末(S1),按“2.1.2”项方法制备供试品溶液,并按“2.1.1”项色谱条件连续进样6次,以1号腺苷色谱峰为参照峰S,计算得到各共有峰相对峰面积及相对保留时间RSD值均小于1.0%,表明仪器精密度良好。日间精密度:取同一批饮片粉末(S1),按“2.1.2”项方法制备供试品溶液,分别在不同日期内按“2.1.1”项色谱条件进样测定,以腺苷峰为参照峰S,计算得到各共有峰相对峰面积及相对保留时间RSD值均小于2.0%,表明仪器精密度良好。
2.1.5 重复性试验 取同一批饮片粉末(S1),按“2.1.2”项方法平行制备6份供试品溶液,并按“2.1.1”项色谱条件依此进样测定,以腺苷峰为参照峰S,计算得到各共有峰相对峰面积及相对保留时间RSD值均小于2.0%,表明方法重复性良好。
2.1.6 稳定性试验 取同一批饮片粉末(S1),按“2.1.2”项方法制备供试品溶液,按“2.1.1”项色谱条件分别于0、2、4、6、8、12、24 h进样测定,以腺苷峰为参照峰S,计算得到各共有峰相对峰面积及相对保留时间RSD值均小于2.5%,表明供试品溶液在24 h内稳定性良好。
2.1.7 UPLC指纹图谱的建立 取上述10批山药生品和10批麸炒山药饮片,按“2.1.2”项方法制备供试品溶液,并按“2.1.1”项色谱条件测定。使用《中药色谱指纹图谱相似度评价系统》进行分析,采用多点校正后进行自动匹配(时间窗0.1 min),提取吸收信号较强、峰形明显、稳定性较好的共有峰,按中位数法生成对照图谱,结果见图1~4。
根据数据分析,10批山药生品标定了4个共有峰,10批麸炒山药饮片标定了7个共有峰,2号峰为腺苷峰,其分离度良好,峰面积较大,在图谱中较稳定且为所有样品共有,所以确定腺苷为参照峰(S)。
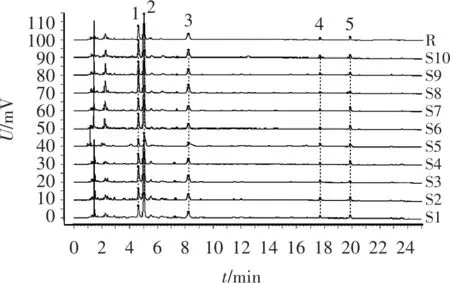
图1 10批山药生品的UPLC叠加图谱
2.1.8 指纹图谱相似度计算 分别通过10批山药和麸炒山药生成的共有模式为对照指纹图谱,计算各批次之间的相似度,结果见表2。可见,10批次山药生品与对照指纹图谱的相似度范围为0.997~1.000,10批次麸炒山药饮片与对照指纹图谱的相似度范围为0.950~0.999,表明山药与麸炒山药质量稳定,生品与生品、炮制品与炮制品之间组内组成成分差异小。
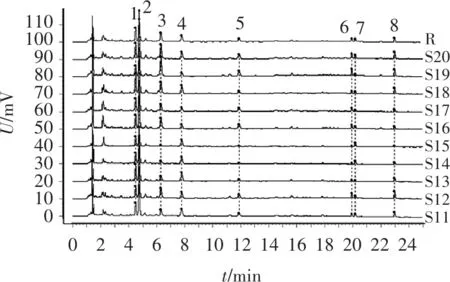
图2 10批麸炒山药样品的UPLC叠加图谱

图3 山药生品对照指纹图谱
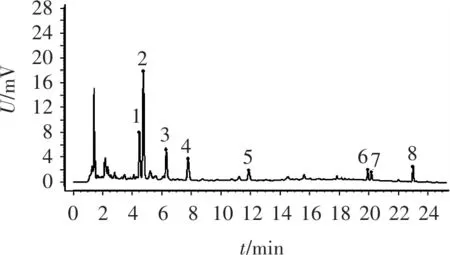
图4 麸炒山药样品对照指纹图谱
2.1.9 山药麸炒前后UPLC指纹图谱比较 取炮制用辅料麸皮,按“2.1.2”项方法制备供试品溶液,并按“2.1.1”项色谱条件测定,将图谱结果与上述山药、麸炒山药UPLC指纹图谱进行比较,结果见图5。
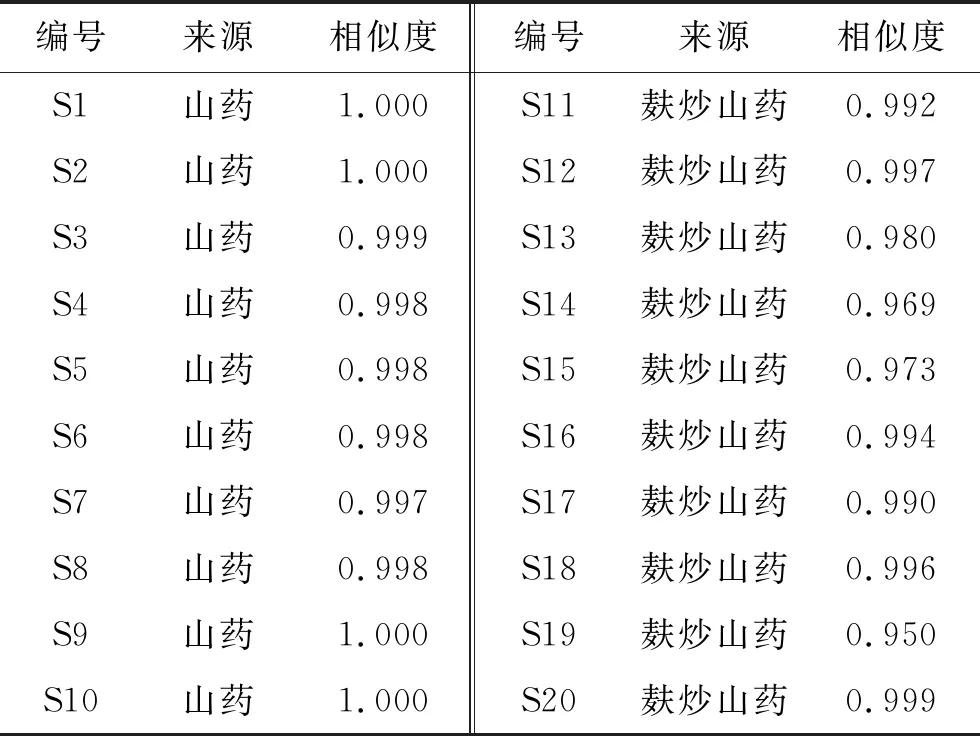
表2 山药生品及麸炒山药饮片相似度
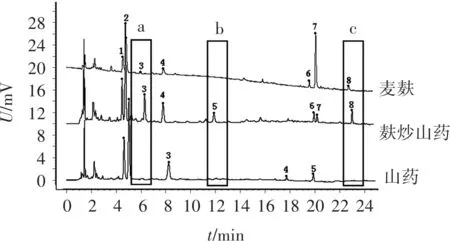
图5 山药麸炒前后UPLC指纹图谱比较
可见,麸炒后的山药图谱由5个共有峰增加至8个共有峰,其主要差异在a、b、c 3个区域。其中,a所示区域麸炒品中明显增加了峰3,而山药生品在该积分条件下未能识别,且辅料麦麸中响应极低;b所示区域麸炒品中明显增加了峰5,而山药生品在该积分条件下未能识别,且辅料麦麸中无响应;c所示区域麸炒品中明显增加了峰8,而山药生品在该积分条件下未能识别,且辅料麦麸中响应较低,进一步说明了麸炒前后山药与麸炒山药差异较大,表明该指纹图谱方法能应用于山药与麸炒山药的质量控制。
2.2 腺苷质量分数的测定方法
2.2.1 供试品溶液的制备 同“2.1.2”项下方法。
2.2.2 对照品溶液的制备 同“2.1.3”项下方法。
2.2.3 色谱条件 同“2.1.1”项下色谱条件。分别精密吸取腺苷对照品、山药(S1)供试品和麸炒山药(S11)供试品溶液 1 μL,进样测定,色谱图见图6。

A.腺苷对照品; B.山药样品; C.麸炒山药样品; 1.腺苷。
2.2.4 线性关系考察 精密吸取“2.2.2”项下对照品溶液适量,分别置10 mL容量瓶中,用10%甲醇稀释至刻度,摇匀,制得质量浓度分别为0.114、0.056 8、0.022 7、0.005 68、0.002 27、0.001 14 mg/mL的对照品溶液,按“2.2.3”项色谱条件进样,记录色谱峰面积;以对照品质量浓度为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线,得回归方程y=1.590×107x- 2.389×103,r=0.999 9,线性范围为0.00 114~0.114 mg/mL。
2.2.5 精密度试验 日内精密度:取同一批饮片粉末(S1),按“2.2.1”项方法制备供试品溶液,并按“2.2.3”项色谱条件连续进样6次,计算得到腺苷峰面积RSD值为0.37%,表明仪器精密度良好。日间精密度:取同一批饮片粉末(S1),按“2.2.1”项方法制备供试品溶液,分别在不同日期内按“2.2.3”项色谱条件进样测定,计算得到腺苷峰面积RSD值为1.18%,表明仪器精密度良好。
2.2.6 重复性试验 取同一批饮片粉末(S1),按“2.2.1”项方法平行制备6份供试品溶液,分别进行测定,连续进样6次,计算得到腺苷的质量分数为0.337 mg/g,RSD值为0.37%(n=6),表明方法重复性良好。
2.2.7 稳定性试验 精密吸取同一批供试品溶液(S1),按“2.2.3”项色谱条件分别于0、2、4、6、8、12、24 h进样测定,计算得到腺苷峰面积的RSD值为0.71%,表明供试品溶液在24 h内稳定性良好。
2.2.8 回收率试验 取同一批(S1号)已知含量的样品约0.25 g,精密称定,按高、中、低3种浓度分别加入腺苷对照品溶液,分别“2.2.1”项方法制备供试品溶液,按“2.2.3”项色谱条件分别进样测定,计算回收率。计算得到腺苷平均加样回收率分别为104.65%,结果见表3。
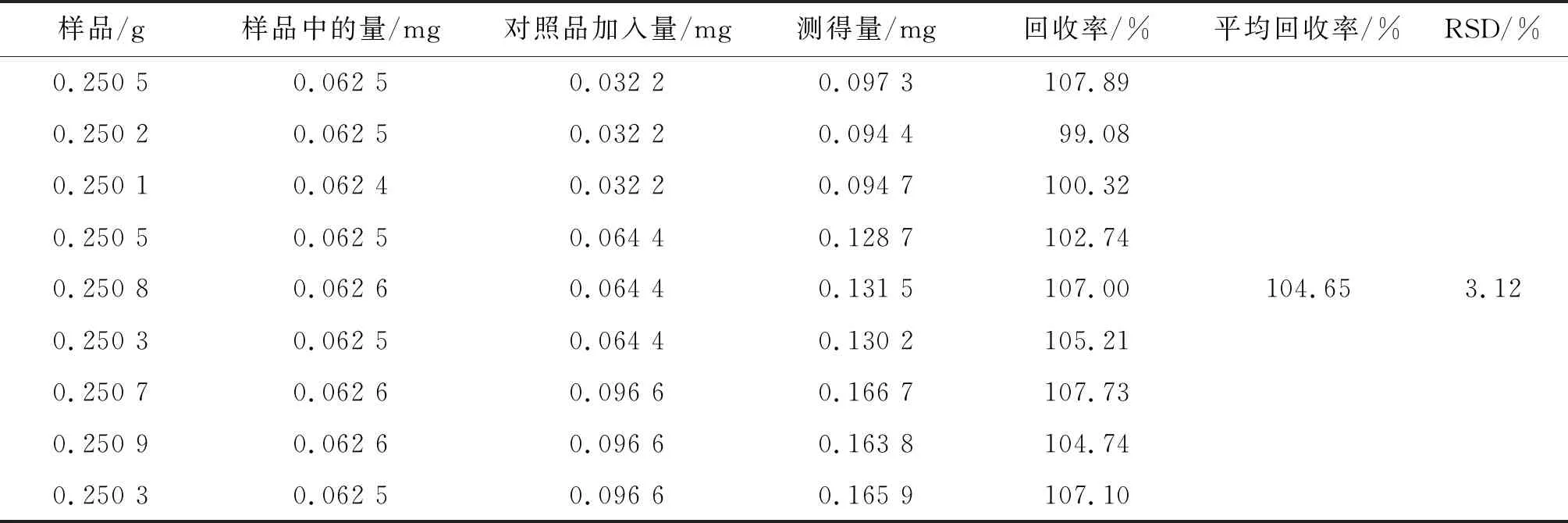
表3 腺苷加样回收率试验结果
2.3 尿囊素质量分数的测定方法
2.3.1 供试品溶液的制备 取饮片粉末(过四号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入稀乙醇25 mL,称定质量,超声处理(功率300 W,频率40 kHz)30 min,放冷,用稀乙醇补足减失的质量,滤过,取续滤液,即得。
2.3.2 对照品溶液的制备 取尿囊素对照品适量,加稀乙醇使溶解,定容至刻度,制成2.497 mg/mL尿囊素对照品储备溶液。
2.3.3 色谱条件 色谱柱:Waters SPHERISORB NH2(250 mm×4.6 mm,5 μm)色谱柱;流动相:乙腈-水(体积比90∶10);流速:1.0 mL/min;柱温:30 ℃;检测波长:224 nm;进样量:10 μL。分别精密吸取尿囊素对照品、山药(S1)供试品和麸炒山药(S11)供试品溶液 10 μL,进样测定,色谱图见图7。
2.3.4 线性关系考察 精密吸取“2.3.2”项对照品溶液适量,分别置5、10、10、20、10、25 mL容量瓶中,用稀乙醇稀释至浓度,摇匀,制得质量浓度分别为1.248、0.624、0.250、0.125、0.075、0.030 mg/mL的对照品溶液,分别按“2.3.3”项色谱条件进样,记录色谱峰面积;以对照品质量浓度为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线,得线性回归方程y=1.824×106x+2.800×103,r=0.999 9,线性范围为0.030 0~1.248 mg/mL。
2.3.5 精密度试验 日内精密度:取同一批饮片粉末(S1),按“2.3.1”项方法制备供试品溶液,并按“2.3.3”项色谱条件连续进样6次,计算得到尿囊素峰面积RSD值为1.01%,表明仪器精密度良好。日间精密度:取同一批饮片粉末(S1),按“2.3.1”项方法制备供试品溶液,分别在不同日期内按“2.3.3”项色谱条件进样测定,计算得到尿囊素峰面积RSD值为1.28%,表明仪器精密度良好。
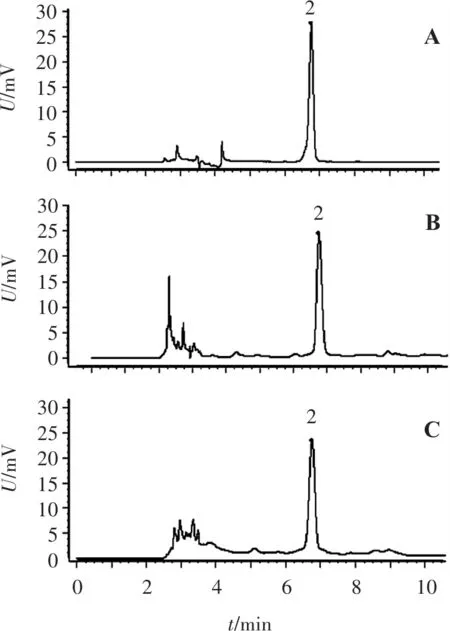
A.尿囊素对照品; B.山药样品; C.麸炒山药样品; 2.尿囊素。
2.3.6 重复性试验 取同一批饮片粉末(S1),按“2.3.1”项方法平行制备6份供试品溶液,分别进行测定,连续进样6次,计算得到尿囊素的质量分数为6.997 mg/g,RSD值为0.72%(n=6),表明方法重复性良好。
2.3.7 稳定性试验 精密吸取同一批供试品溶液(S1),按“2.3.3”项色谱条件分别于0、2、4、6、8、12、24 h进样测定,计算得到尿囊素峰面积的RSD值分别为1.03%,表明供试品溶液在24 h内稳定性良好。
2.3.8 回收率试验 取同一批(S1号)已知含量的样品约0.25 g,精密称定,按高、中、低 3 种浓度分别加入尿囊素对照品溶液,分别按“2.3.1”项方法制备供试品溶液,按“2.3.3”项色谱条件分别进样测定,计算回收率。结果计算得到尿囊素的平均加样回收率分别为 96.17%,见表4。
2.4 样品测定
基于上述建立的腺苷及尿囊素的质量分数测定方法,对10批山药和10批麸炒山药样品进行测定,计算样品中的腺苷、尿囊素的质量分数,结果见表5。可见,山药生品、麸炒山药饮片中腺苷的质量分数分别为0.196~0.421、0.260~0.410 mg/g,尿囊素的质量分数分别为6.200~9.160、6.240~8.340 mg/g。
运用SPSS22.0软件对山药生品和麸炒山药尿囊素、腺苷质量分数测定结果进行独立样本t检验,结果见表6。可见,山药炒制前后尿囊素、腺苷含量差异无统计学意义。
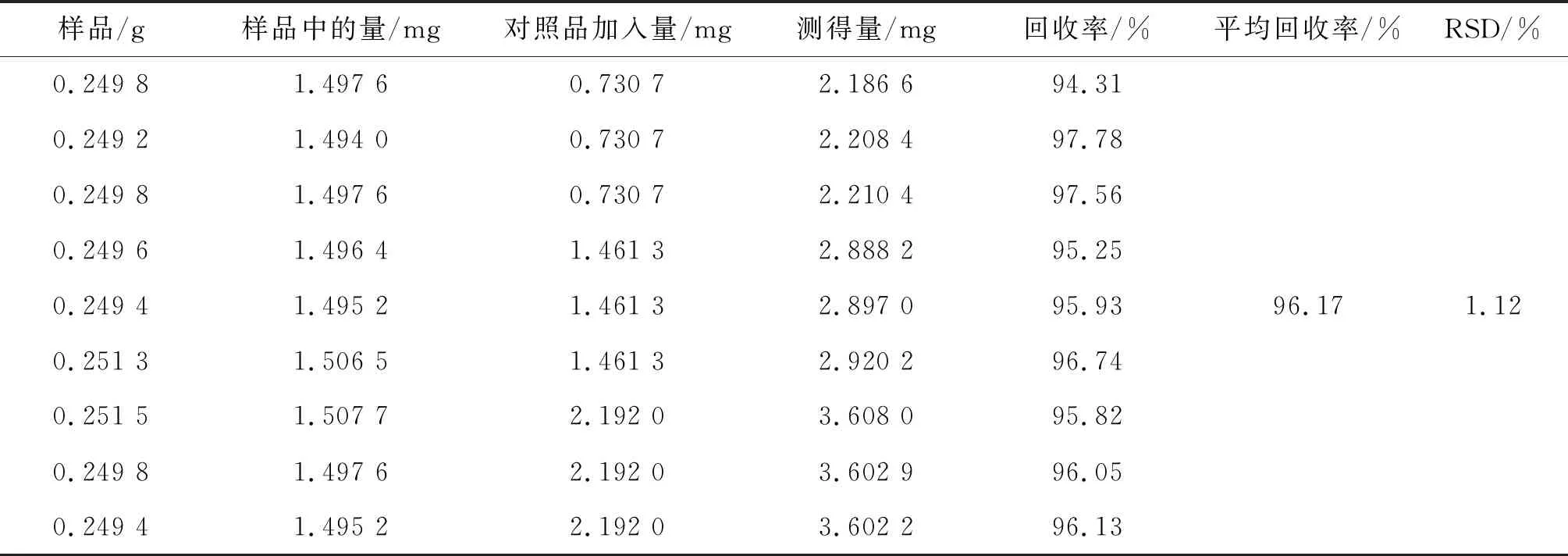
表4 尿囊素加样回收率试验结果
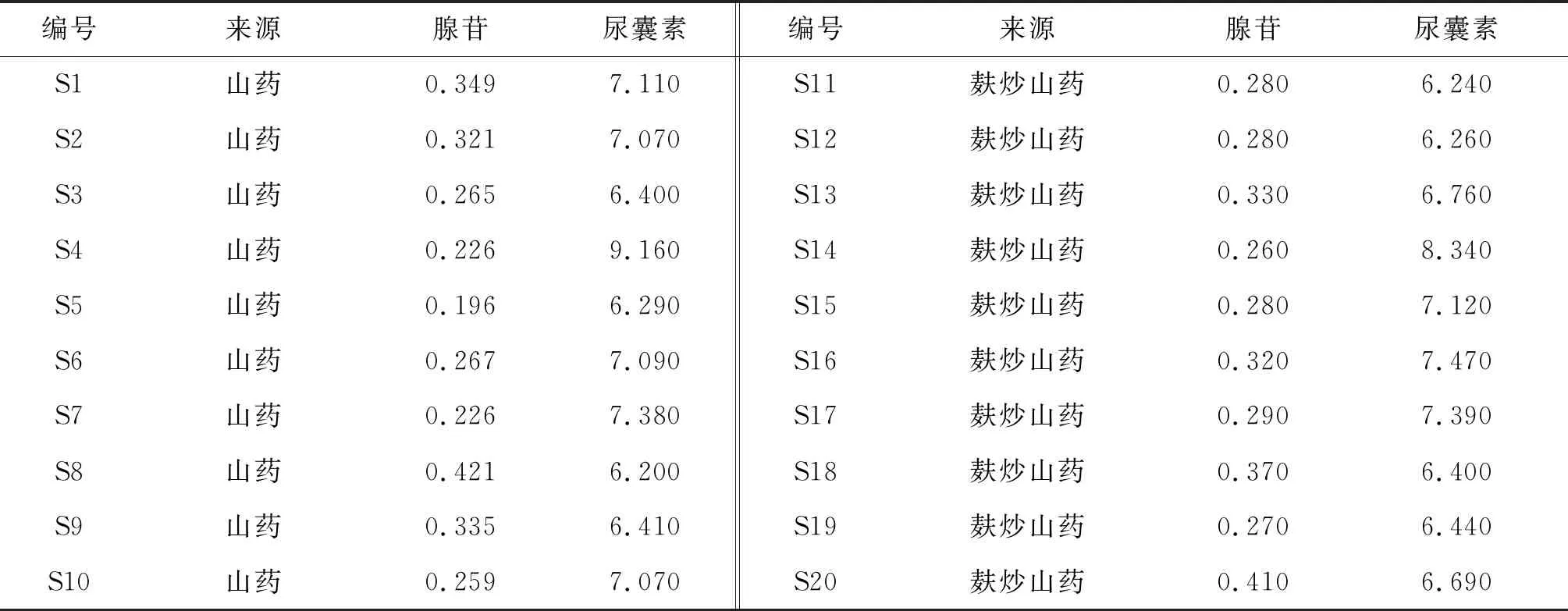
表5 山药生品及麸炒山药饮片中腺苷与尿囊素的质量分数测定结果
表6 山药及麸炒山药腺苷、尿囊素含量独立样本检验结果
3 讨论
本文对山药及麸炒山药的含量测定方法及指纹图谱进行了研究,建立了山药和麸炒山药饮片UPLC指纹图谱方法,可同时测定腺苷的质量分数。由于尿囊素极性较大,在反相色谱柱上保留时间极短,参考文献[9-10]选用氨基柱进行研究,考察不同乙腈-水比例对尿囊素分离度的影响,当乙腈-水比例为(体积比90∶10)时,能较好分离得到样品中的尿囊素。
曾对不同提取方法(超声、回流)及不同提取溶剂(甲醇、乙醇、70%甲醇、70%乙醇、50%甲醇、稀乙醇)进行考察,结果发现采用10%甲醇超声提取的色谱图信息量最多,峰响应较高,且腺苷提取较充分,故选用10%甲醇超声提取腺苷及指纹图谱;采用稀乙醇超声提取时,尿囊素提取较充分,故选用稀乙醇超声提取尿囊素。
麦麸含有黄酮类、尿囊素等多种成分,炮制过程可能会对山药中尿囊素质量分数产生影响[11],而本文结果显示麸炒后尿囊素、腺苷质量分数变化不明显,可能与麦麸在炒制过程中,麦麸起中间传热作用有关。杨连菊等[12]发现麸炒前后山药中的尿囊素质量分数差异不大,与本文结论一致。另外,刘应蛟等[13]比较不用炮制方法对山药尿囊素、腺苷质量分数的影响,发现麸炒后尿囊素、腺苷质量分数变化不明显,而土炒后显著增大,后续将对不同炮制方法下山药有效成分的变化情况进行研究。
本研究试验过程中发现,麸炒后山药特征峰数量增多,说明麸炒后山药的成分出现一定的变化,在炮制辅料麦麸中能找到其增加3号、7号和8号色谱峰,不能找到5号色谱峰,说明麸炒后增加的3号、7号和8号色谱峰可能由麦麸带入;而增加的5号色谱峰,可能因加热引起某些成分的转化。结合炒制前后质量分数结果,推测麸制后补益作用的增强可能不依赖尿囊素、腺苷质量分数的增加,而麸炒的作用可能使二者的质量分数维持在一定范围内发挥作用。另外,山药归脾、肺、肾经,而麦麸含有丰富的氨基酸等成分,麸制后可能作为引经药促进山药对脾胃的亲和力,增强其补脾益肺的功效。
