封闭群比格犬微卫星的筛选及初步应用∗
2020-12-31李银银李长龙李方正王冬冬杜小燕陈振文
蒋 辉 李银银 李长龙 郭 萌 李方正 王冬冬 杜小燕 陈振文
(1.首都医科大学实验动物部,北京 100069)(2.首都医科大学基础医学院,北京 100069)(3.青岛农业大学动物医学院,青岛 266109)
比格犬(Beagle)又称米格鲁猎犬或小猎兔犬,原产英国,是猎犬中较小的一种,1880年传入美国[1],是国际通用的品种犬之一。它具有体型小、性格温顺、反应均一、重复性好、大脑发达和适应性强等优点,非常适合用于生命科学和医学研究,是L想的实验动物,也是国际公认的实验用犬。比格犬在急性毒性试验等药物非临床研究中的应用十分广泛,而使用比格犬复制口腔、泌尿系统疾病的动物模型也有报道[2-3]。此外,比格犬还是用于遗传学、微生物学和生物学等多个研究领域。2015年,全国比格犬年用量为1.96万只,占全国实验犬用量的80%[4]。据专家估计,2018年我国比格犬的用量已达到10万余只。虽然比格犬具有对实验反应均一性、重复性和可比性良好等特点,但由于我国早在八十年代就正式引进比格犬,经过近30年的繁殖已基本形成适应与国内饲养环境的封闭群,受种群、饲养环境等对多方面因素的影响,其遗传信息和生物学特性相比于国外种群也发生了一定程度的变化。面对多地域、多学科、大数量的比格犬市场需求,为了保证比格犬的质量,建立比格犬遗传质量检测方法,进而建立其遗传质量标准已成为比格犬生产质量保障体系的当务之急。
微卫星(microsatellite)又称为短串联重复(short tandem repeat,STR),是指由 1~6个碱基组成的简单串联重复序列,它大量分布于绝大多数真核生物基因组中 Hearne等[5]和Li等[6]。该序列由核心序列如(CT)n、(TAT)n等[7]和相对保守的侧翼序列组成。根据侧翼序列设计引物,扩增结果能够反映出不同品系或不同个体的实验动物的核心序列重复个数的差异,即等位基因的不同。微卫星DNA的这种特殊结构使其具有多态性、共显性等特点,可作为分子标记应用于多种动物遗传多样性研究[8-9]、遗传质量控制中[10],其检测效果优于采用生化标记检测法的国家实验动物遗传质量检测标准GB/T 14927.1—2008[11]。目前,已有许多科技工作者尝试使用微卫星作为多种实验动物、实验用动物选择遗传检测的分子标记。我国有关比格犬的微卫星方面的研究相对较少,孙兆增等[12]用24个微卫星位点引物在12只比格犬中的研究发现有7对引物扩增结果具有较好的多态性和重复性。闫志峰等[13]用16个微卫星座位共检测到175个等位基因,平均为10.875个,平均多态信息含量为 0.6768~0.8743,群体杂合度为 0.7505~0.8807。国际动物遗传学会(International Society of Animal Genetics,ISAG)在2001—2002年首次验证不同微卫星 DNA标记在犬亲权鉴定中的有效性及可靠性,并推荐22个位点供不同实验室参考使用[14]。这些研究为我们选取代表性微卫星位点提供了参考。我们选用这些位点以及文献中其他犬种的微卫星位点120个作为候选位点[12-17],进行 PCR扩增条件的筛选,并在小比格犬群体中进行了初步的应用。
1 材料与方法
1.1 实验样本
小型比格犬样本30个,非同窝,性别不限。中型和大型比格犬样本各6个。所有样本均随机选取自青岛博隆实验动物有限公司的群体。静脉抽取血液样本5 m L于抗凝采血管中,保存于4℃冰箱备用。本实验经过首都医科大学动物实验与实验动物伦L委员会审查(批准号AEEI-2019-022)。
1.2 实验方法
1.2.1 比格犬血液样本基因组DNA的提取与检测:使用血液基因组 DNA提取试剂盒(德国Qiagen公司),按照说明书进行比格犬血液样本基因组DNA的提取。
1.2.2 比格犬的微卫星位点检索与选择:本研究从已发表的文献中筛选犬微卫星位点,根据国内相关文献报道[5,7-11],选取120个犬微卫星位点进行预实验,包括23个已知比格犬的微卫星位点和用于其他多种犬遗传检测的微卫星位点97个。
1.2.3 普通PCR反应扩增进行微卫星位点的初筛:由文献中获取微卫星位点PCR引物序列,退火温度、扩增效果不好时进行退火温度的梯度优化。选取小型、中型和大型比格犬各6只犬的基因组DNA进行混合,制备6个DNA池,每个DNA池中包含3种型体的样本各一个。PCR采用20μL反应体系,其中50~100 ng/μL基因组 DNA池样品2μL,上、下游引物(10μmol/μL)各 1μL,10×PCR buffer 2μL,dNTP Mg2+plus(100μmol/L)4μL,Taq酶(5 U/μL)0.2μL,补充 9.8μL的双蒸水(ddH2O)。反应程序为:94℃预变性5 m in;94℃变性45 s,退火1 min(120个位点53~60℃不同温度,温度具体参考于文献),72℃延伸1 m in;循环35次;72℃继续延伸10 min;扩增产物于4℃保存。琼脂糖凝胶电泳初步检测PCR产物,凝胶成像系统进行图像采集和分析。筛选能够成功扩增的位点,无非特异性的杂带,产物条带较为集中,位点来源较均匀分布于犬39对染色体上。
1.2.4 荧光引物扩增微卫星位点进行STR扫描:根据普通引物筛选,对有阳性扩增的73个微卫星位点重新合成荧光标记引物(上海生工有限公司合成),分别于上游引物 5′端标记为 FAM、HEX、TAMRA。73个微卫星位点引物及荧光标记、退火温度等信息见表1。

表1 73个比格犬微卫星位点名称、荧光标记、染色体位置及退火温度Table 1 Fluorescent marked primers,names,location and annealing temperature of 73 microsatellite loci of Beagle dogs
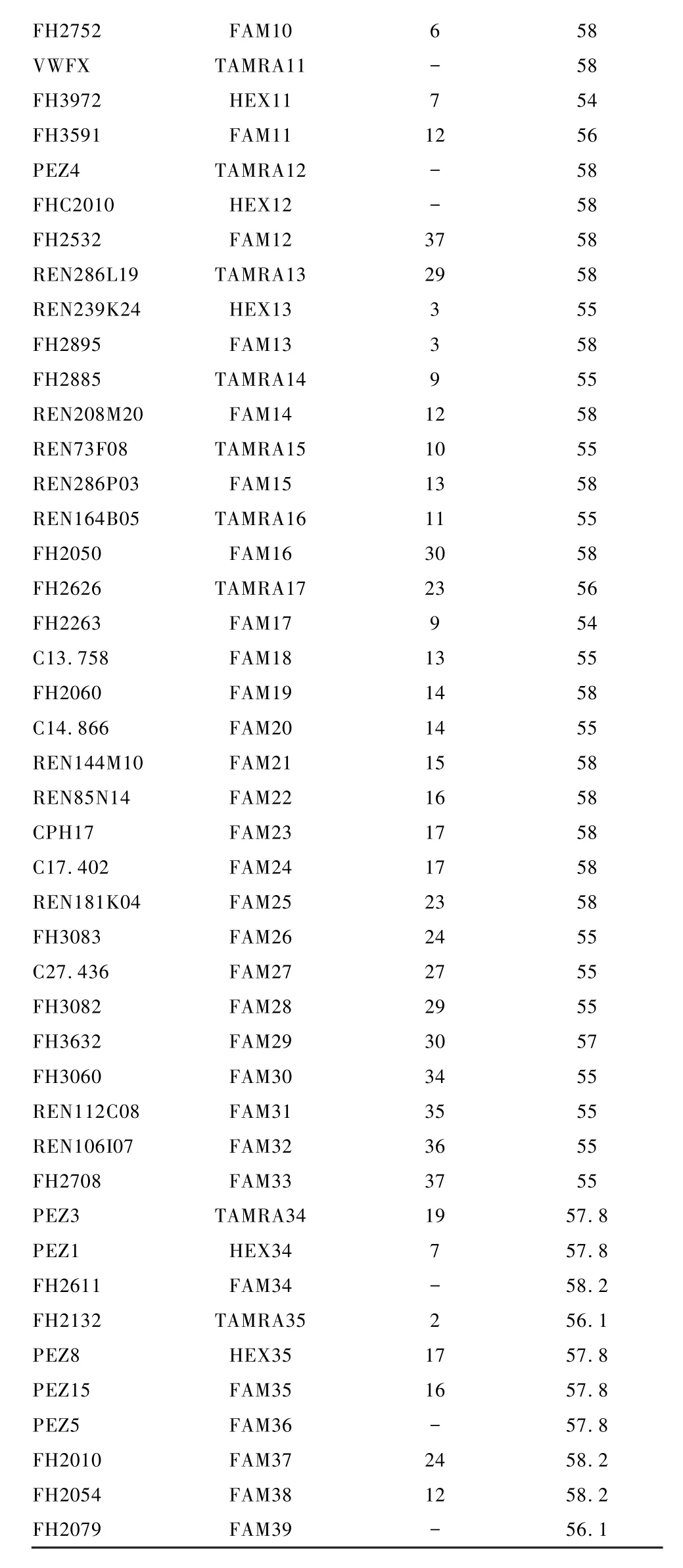
FH2752 FAM 10 6 58 VWFX TAMRA11 - 58 FH3972 HEX11 7 54 FH3591 FAM 11 12 56 PEZ4 TAMRA12 - 58 FHC2010 HEX12 - 58 FH2532 FAM 12 37 58 REN286L19 TAMRA13 29 58 REN239K24 HEX13 3 55 FH2895 FAM13 3 58 FH2885 TAMRA14 9 55 REN208M 20 FAM 14 12 58 REN73F08 TAMRA15 10 55 REN286P03 FAM 15 13 58 REN164B05 TAMRA16 11 55 FH2050 FAM16 30 58 FH2626 TAMRA17 23 56 FH2263 FAM17 9 54 C13.758 FAM18 13 55 FH2060 FAM19 14 58 C14.866 FAM 20 14 55 REN144M 10 FAM 21 15 58 REN85N14 FAM 22 16 58 CPH17 FAM 23 17 58 C17.402 FAM 24 17 58 REN181K04 FAM 25 23 58 FH3083 FAM 26 24 55 C27.436 FAM 27 27 55 FH3082 FAM 28 29 55 FH3632 FAM 29 30 57 FH3060 FAM 30 34 55 REN112C08 FAM 31 35 55 REN106I07 FAM 32 36 55 FH2708 FAM 33 37 55 PEZ3 TAMRA34 19 57.8 PEZ1 HEX34 7 57.8 FH2611 FAM34 - 58.2 FH2132 TAMRA35 2 56.1 PEZ8 HEX35 17 57.8 PEZ15 FAM35 16 57.8 PEZ5 FAM 36 - 57.8 FH2010 FAM 37 24 58.2 FH2054 FAM 38 12 58.2 FH2079 FAM39 - 56.1
用荧光引物对小型比格犬的30个样品进行PCR扩增,扩增体系等条件同普通引物实验过程。然后经琼脂糖凝胶电泳初步检测荧光引物PCR产物,合格后送天一辉远公司进行STR扫描。
1.2.5 统计方法:扫描结果由Gene Marker V2.2.0软件分析30个样本在73个比格犬微卫星位点的扩增片断大小。每个位点的等位基因根据扩增片断大小从大到小顺序排列记录为 a、b、c、d、e等,每个样本的基因型即可记录为aa、ab、ac、ad等形式。
2 结果
2.1 比格犬血液基因组DNA的提取
经血液基因组DNA提取试剂盒提取比格犬血液样本基因组DNA,经微量紫外分光光度计测得浓度,所有样品的A260/A280值均在 1.8~2.0。将 DNA原液稀释成50~100 ng/μL备用。经 0.8%琼脂糖电泳检测显示完整性良好。核酸蛋白分析仪检测典型的电泳图如图1所示。结果表明,基因组DNA比较完整,可用于下一步PCR分析。
图1 比格犬基因组DNA 0.8%琼脂糖电泳结果注:M为50 bp marker,1~10:为动物编号Fig.1 The results of 0.8% electrophoresis of genome DNA from Beagle dogsNote:M:50 bp marker,1-10:number of animals
2.2 比格犬的微卫星位点检索与选择
通过检索相关文献,查找到候选的120个犬微卫星位点,使用来自大、中、小三个比格犬群体的DNA样本池进行普通PCR引物扩增,经电泳检测其扩增情况及在3个群体中多态性状况。结果在120个犬微卫星位点有101个能够成功扩增,获得阳性条带。其中部分微卫星位点电泳图如2所示。选择在3个群体中多态性高的(即电泳检测条带较粗,或者有明显多条主要条带),并且在犬39对染色体上较均匀覆盖的位点(保证每对染色体上含有两个位点),最终获得73个微卫星位点,进行后续荧光引物标记分组。
2.3 小型比格犬73个微卫星位点STR扫描分析
运用所选的73个微卫星位点对小型比格犬30个样本进行STR扫描分析和基因分型,统计分析30个样本中73个微卫星位点的等位基因数和片段大小范围,有64个微卫星位点成功分型,检出率较高,结果详见表2,说明这些位点可以用于比格犬群体遗传结构分析。

图2 10个微卫星位点在比格犬DNA池中扩增PCR产物琼脂糖凝胶电泳结果注:M为50 bp marker,1~10为位点编号Fig.2 The results of electrophoresis of 10 microsatellite loci from Beagle dogsNote:M:50 bp marker,1-10:the number of loci
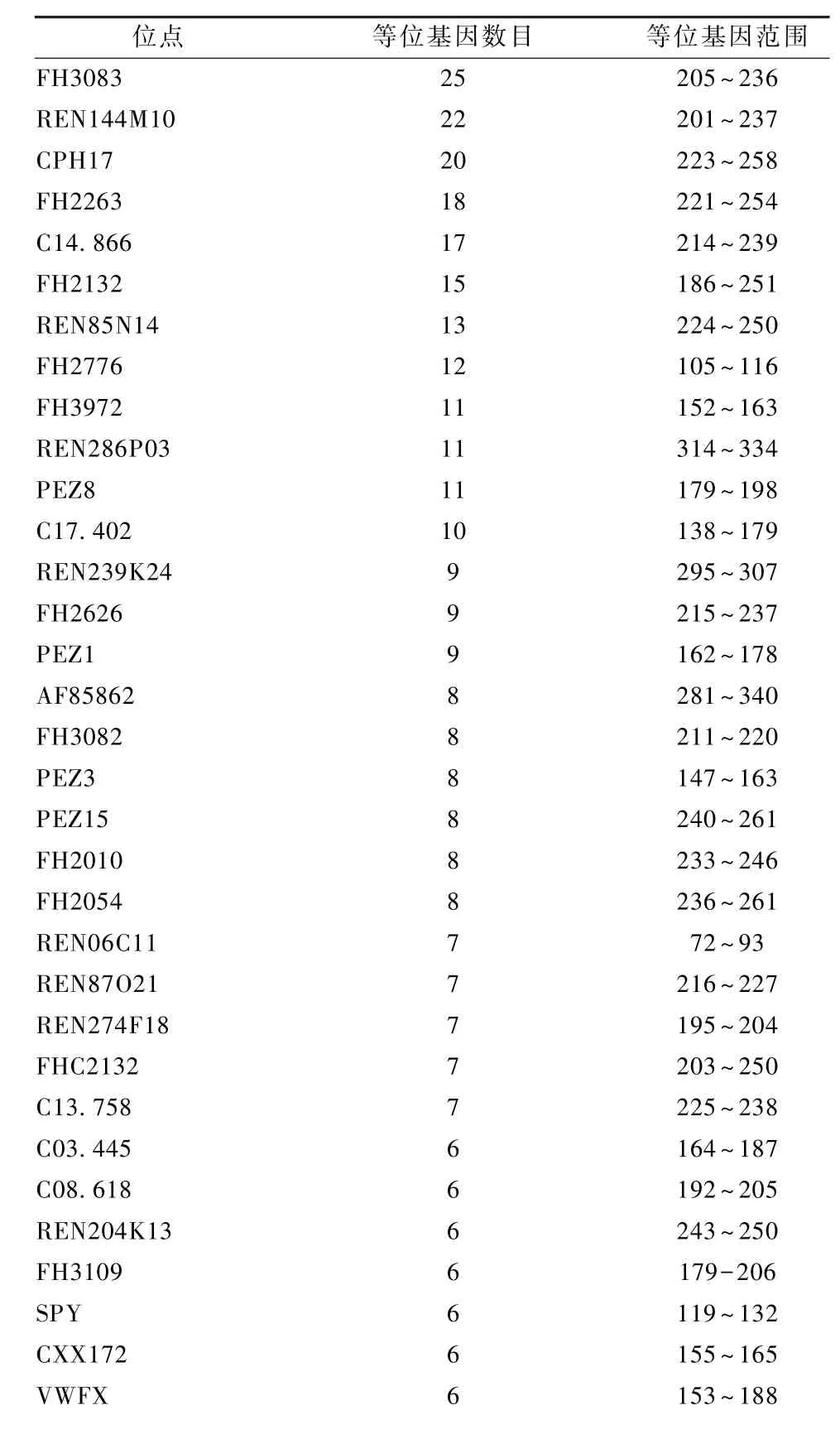
表2 64个比格犬微卫星位点名称、检测到的等位基因数及等位基因范围Table 2 Numbers of alleles and allele size range of 64 microsatellite loci of Beagle dogs

REN73F08 6 197~205 C09.173 5 103~111 FH2313 5 181~189 PEZ2 5 111~135 REN314H10 5 168~174 FH2752 5 204~220 FH2895 5 354~371 REN208M 20 5 316~331 FH2062 4 131~140 FH2890 4 191~198 FH2326 4 258~272 REN106I06 4 241~256 REN107H05 4 155~181 FH2885 4 199~212 REN164B05 4 224~229 FH2060 4 218~223 FH2708 4 200~207 C10.781 3 180~188 FH3393 3 98~100 REN285I23 3 236~240 FHC2010 3 233~245 FH2532 3 83~107 FH2050 3 248~258 REN181K04 3 217~232 REN112C08 3 219~224 FH2783 2 192~196 REN286L19 2 218~220 FH3060 2 193~196 FH3069 1 160 PEZ4 1 133 FH3632 1 230
2.4 小型比格犬群体遗传变异分析
我们进一步选取等位基因数目≥4的比格犬微卫星位点,共49个。对小型比格犬群体遗传结构特征分析(表3)结果表明,49个微卫星位点在小型比格犬中共检测到413个等位基因,平均每个微卫星位点有8.4个。其中等位基因数最多的是FH 3083位点,有25个等位基因,最少的是FH2062、FH2890、FH2326、REN106I06、FH2885、REN164B05、FH 2060和FH2708,这8个微卫星位点都只有4个等位基因型。检测出不同位点的扩增片段大小范围不同,表明这些位点在该群体中的多态性具有差异。
群体的杂合度由不同微卫星位点的等位基因频率计算所得,不同微卫星位点的群体杂合度各不相同。在FH3083该微卫星位点上检测的平均杂合度显示为最高(0.9367),而在FH 2062位点检测到的平均杂合度显示为最低(0.3361)。最终所选的49个微卫星位点的整体平均杂合度达到0.7375。

表3 小型比格犬封闭群49个微卫星位点上的等位基因数、平均杂合度和多态性信息含量Table 3 Number of allele,average heterozygosity and polymorphism in formation content(PIC)of 49 microsatellite loci in miniatu re Beagle dogs
小型比格犬群体中在所选的49个微卫星位点中,高度多态性位点(PIC>0.5)有46个,中度多态性位点(0.25 利用Popgen 1.32,计算小型比格犬49个微卫星位点的Hardy-Weinberg遗传平衡检验的P值。结果有12个微卫星位点非常显著偏离Hardy-Weinberg遗传平衡(P<0.01),其中3个微卫星位点显著偏离Hardy-Weinberg遗传平衡(0.01 微卫星DNA作为第二代分子遗传标记,其多态性高是其突出的特点,在基因组范围分布广,能够稳定遗传,在分析生物群体内的遗传变异和不同群体间遗传关系及个体的鉴别研究等方面均存在重要的意义和影响。微卫星位点的选取就成为比格犬遗传质量检测的关键。孙兆曾等[12]采用12只比格犬选取了13个位点进行分析,发现 VWFX、SPY、PEZ6、CHRl.X、PEZ8、PEZl和 FHC2132扩增重复性和多态性都较好。本次实验也对以上7个位点进行重复测试,发 现 只 有 VWFX、SPY、PEZ8、PEZl和FHC2132。而 PEZ6、CHRl.X则因等位基因数小于4而未被选择。入选的5个位点的平均杂合度0.78,说明群体杂合性较好。闫志峰等(2004)[13]对三地120只比格犬选取40位点进行筛选,最终选取16个位点进行分析,本次实验也对上述位点进行了小型比格犬群体中的检测分析,结果显示在本次实验中仅有9个位点(9/16)获得比较好的结果,其中一个位点因等位基因数过少为入选进行群体结构分析。通过对比选择的位点,本次实验发现动物群体的不同,同一位点的多态性上存在较大的变化。因此,如何选择位点代表比格犬甚至某种实验动物来进行遗传检测应当进行更多验证和分析。 关于遗传检测微卫星位点的选择目前主流选择方法是根据位点的等位基因数量多少、平均杂合度高低作为主要的选择依据,本次实验选择的位点也是如此。这种选择方法也取得了较好的结果。但也存在一定的弊端,例如本次实验中,同一位点在DNA池中扩增时表现为杂合度较高和等位基因数较多,而在一群体中则扩增效果不佳,因此这种只在某个群体中杂合度非常高的位点是否适用于作为检测该物种的遗传检测位点尚存疑问。另外,香农指数作为一个常见的遗传多样性参数,在遗传分析中经常被提及[18]。香农指数越大,说明位点在群体中的分布越广,也说明生物多样性越高。香农指数来源于信息熵,香农指数越大,表示不确定性大。不确定性越大,表示这个群体中未知的因素越多,也就是多样性高。在49个位点计算的小型比格犬群体遗传参数中,香农指数为1.6625,远高于小鼠(ICR和KM两个封闭群)的0.47~0.69的数值[19],也高于另一个微卫星位点组合所检测的KM小鼠封闭群的香农指数(0.9716)[20],这说明我们所选的位点在群体中的分布非常均一,个体偏差较小。我们进一步计算香农指数发现,本次实验中利用文献报道的13个比格犬位点计算出的小型比格犬群体遗传香农指数为1.66,与49位点、或者去除这13个位点后其余36个位点计算的香农指数一致,均为1.66,但是等位基因数、有效等位基因数存在一定差别。这表明,从群体遗传学的角度看,如果遗传检测位点选择恰当,个别位点的等位基因数和有效等位基因数对群体的杂合性以及香农指数影响不大,等位基因数的小幅变化对群体杂合度的影响可能有限。综合本次实验,我们发现采用微卫星检测封闭群比格犬的关键是选择微卫星位点。一旦微卫星位点选择准确,其系统的杂合性表现将趋于稳定,受单个微卫星的杂合性变化影响不大。由于国内报道的实验动物遗传检测时微卫星位点的选择方法不多,思路也不尽相同,是否可以用香农指数作为选择位点的依据,还有待于我们用所选的49个位点对更多的比格犬群体进行分析和反复验证,这些位点在不同群体遗传检测中的通用性也有待进一步优化。3 讨论
