吲哚菁绿荧光染色技术在腹腔镜精准肝切除术中的应用体会
2020-12-18关斌颖杨国际刘天锡
关斌颖,杨国际,刘天锡
(曲靖市第二人民医院肝胆外科,云南 曲靖,655000)
精准肝切除术是继解剖性肝切除术提出的一种全新外科理念与技术体系,目的在于彻底清除病灶的同时确保剩余肝脏解剖结构完整及功能性体积最大化,并最大限度控制手术出血及全身性创伤侵袭,最终使患者获得最佳康复效果[1-2]。病灶的切除通过解剖进入拟切除肝段门静脉、肝动脉的分支,并加以阻断,肝外通过缺血线及肝内通过肝静脉分支的走行而共同决定切除界面,但因肝实质内肝段间的解剖并不是一个规则的平面,是参差不齐的,往往导致多切或少切;通过吲哚菁绿(indocyanine green,ICG)荧光染色引导技术,可提供实时导航,能更精准地确定切除界面。我科将ICG荧光染色引导技术应用于腹腔镜精准性肝切除术中,取得了满意效果。本研究回顾性分析2016年9月至2019年10月曲靖市第二人民医院肝胆外科在ICG荧光染色引导下为31例患者行腹腔镜下精准性肝切除术的临床资料,现将结果报道如下。
1 资料与方法
1.1 临床资料 本组共31例患者,其中男19例,女12例;34~74岁,平均(46.82±12.63)岁;胆石症16例,原发性肝细胞癌9例,肝血管瘤1例,其他肝脏良性占性病变5例。手术方式包括腹腔镜下左半肝切除术13例,左肝外叶切除术6例,右半肝切除7例,不规则肝段切除5例。肝功能Child-Pugh分级均为A级,3例有上腹部手术史,9例合并高血压,6例合并糖尿病。胆石症患者中5例术中见左肝外叶萎缩,2例术后病检示肝内胆管已癌变;肝癌患者术前检查确定无邻近器官侵犯及远处转移,术前检查提示3例并发肝硬化,术中发现2例并发肝硬化,肝硬化患者剩余肝脏体积需占标准肝脏体积的40%以上,无肝硬化患者30%以上,肿瘤分期为Ⅰa期、Ⅰb期、Ⅱa期。患者均无严重心、肺疾病及ICG过敏。本研究经我院伦理委员会批准,患者及家属术前均签署手术知情同意书。
1.2 手术方法 患者取仰卧位,头高脚低。全身麻醉,建立气腹,压力维持在10~14 mmHg,脐下置入腹腔镜,探查腹腔,判断肝脏病变的可切除性。分别于剑突下、右锁骨中线、右腋前线肋缘下及左锁骨中线肋缘下偏内侧做4个操作孔,具体位置根据患者体型进行适当调整,常规经温氏孔预置自制腹腔镜下第一肝门入肝血流阻断器(专利号:ZL 201721738984.9)。ICG荧光染色采用以下4种方法:(1)术中正染法:解剖第一肝门左横沟、右横沟或劈开肝实质,分离供应预切除半肝、肝叶或肝段的门静脉[3-4],注入ICG 0.25 mg。注射30 s~1 min后预切除肝脏可见荧光[5](图1)。(2)术中反染法:解剖第一肝门左横沟、右横沟或劈开肝实质,找到预切除半肝、肝叶或肝段的入肝门静脉及动脉分支并阻断,阻断后通过外周血管注入ICG 0.25 mg,注射30 s~1 min后需保留的正常肝脏可见荧光,而预切除肝脏未见荧光(图2、图3)。(3)术前给药肿瘤染色法:术前数天(2~7 d)经患者外周静脉注射ICG(2.5~3 mg),术中见肿瘤组织荧光染色(图4)。(4)超声引导穿刺正染法:如果病灶局限于肝段或亚肝段,且供应该病灶的门脉少于两支且直径在3 mm以上,可考虑行超声引导穿刺目标门脉注入ICG 0.25 mg,可见预切除肝段或亚肝段染色(图5)。对于肝内外胆管结石的胆石症患者需合并胆道镜探查取石:断肝后,腹腔镜下解剖并切开胆总管,用直径0.5 cm纤维胆道镜经胆总管或肝断面胆管残端取尽肝内外胆管结石,再次探查胆管无结石残留后,置“T”管引流,术后长期口服熊去氧胆酸预防结石复发。断肝全程在染色导航下进行。本课题患者术后定期随访,随访时间为首次术后3个月、第2次6个月,此后每12个月一次。随访方式采用门诊检查,行B超、CT、MRI、肝功、经T管胆道造影等检查。
2 结 果
ICG辅助腹腔镜完成肝切除术31例。31例患者中26例染色成功,5例失败。2例染色失败发生于术前提前染色中,其原因为肿瘤为高分化腺瘤,代谢较快,注入ICG的时间较长(5~7 d),导致ICG很快代谢,而未见明显染色。1例因患者肝硬化较重,在提前染色中,出现肝脏多处局灶性染色,无法辨认病灶。1例行不规则肝段切除术,超声引导穿刺目标门脉,因目标门静脉分支较细,穿刺困难,导致染色失败。1例反染中,因目标肝段血管阻断不彻底或存在交通支,病灶也被染色,导致染色失败。手术时间平均(269.62±126.03)min,术中出血量(560.52±532.63)mL。术后并发症发生率41.94%,术后平均住院(10.2±2.63)d。肝内胆管结石患者中3例结石残留,通过再次胆道镜取尽,结石一次清除率81.25%(13/16),术后复查,肝肿瘤及其他良性病变患者病灶无残留。术后发生胆漏4例,胸腔积液9例,均通过引流痊愈。术后未发生出血、死亡等并发症。术后1~5 d、平均(2.63±0.75)d肛门排气,恢复进食,入院后5~21 d,平均(12.23±7.32)d痊愈出院。25例获得随访,随访截至2020年2月31日,随访3~41个月,平均(23.21±11.23)个月,胆石症及肝血管瘤、肝脏良性占位性病变患者未见复发。肝脏恶性肿瘤患者中6例获得5~33个月随访,失访3例,2例肝内复发,占22.22%(2/9);1例行肝动脉化疗栓塞治疗,1例拒绝再次治疗;1例(11.11%)死于肿瘤进展。
3 讨 论
精准肝切除术是一个完整的治疗体系,包括积极的术前准备、详细的术前评估与手术规划、精细的手术操作、精心的术后管理及出院后康复指导。体现在围手术期纠正患者低蛋白血症、电解质混乱、肝功能不全,使患者内环境达到相对稳定状态,能安全耐受手术创伤;术前通过各种影像学检查及计算机三维立体成像技术制定最佳手术方案;减轻手术入路创伤,以腹腔镜手术为主,避免开腹手术;避免全肝血流阻断,必要时行目标肝段的血流阻断,减少阻断次数及阻断时间,减轻患者肝脏缺血再灌注损伤。彻底切除病灶的同时最大限度保留正常肝组织,术中体现操作精细化,减少术中失血及术中、术后输血。实现“有效性、安全性、微创化”的理想目标。对于精密的术前规划,过去由于对于病灶的解剖定位、与肝内脉管结构的毗邻关系及肝脏储备功能难以量化分析,因而对于适当肝切除范围、肝切除术式及肝脏分割平面的把握主要依赖临床经验确定,尤其面对复杂的肝切除病例,往往需要剖腹探查才能最后决定手术方案。目前可采用计算机三维立体成像技术,可精准定位病灶,掌握其与邻近脉管的解剖关系,并进行模拟切除,判断病灶的可切除性。
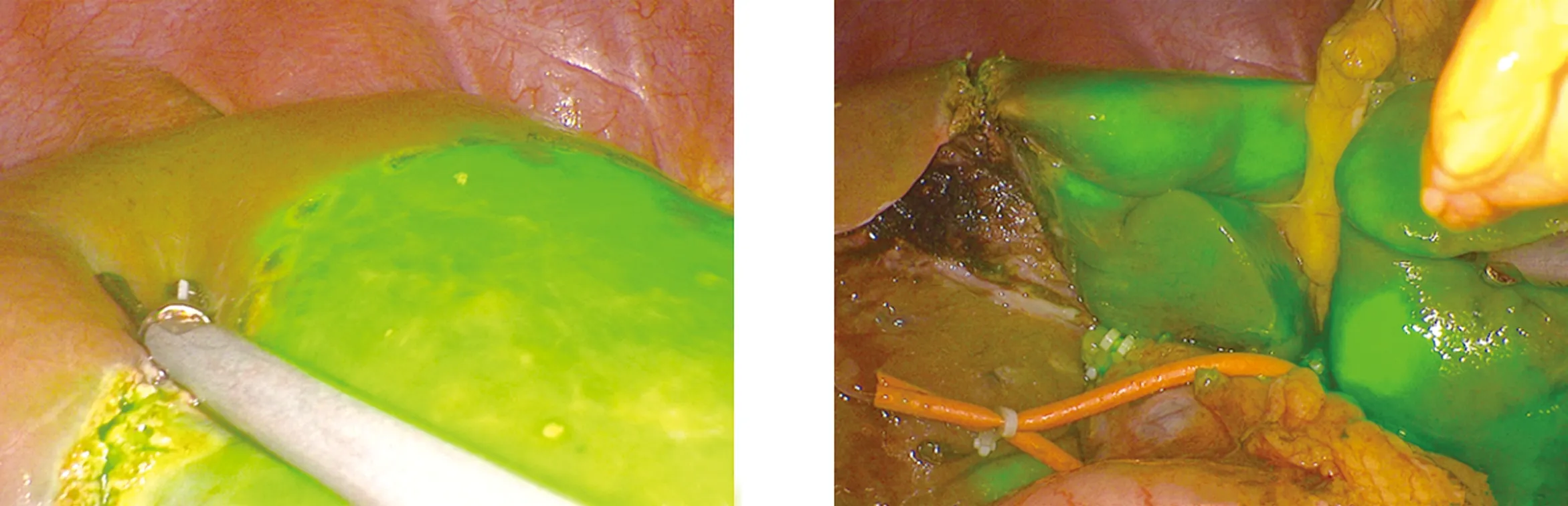
图1 左半肝术中正染 图2 右半肝术中反染
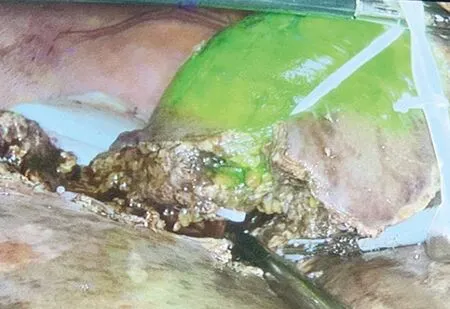
图5 Ⅶ、Ⅷ段良性肿瘤超声引导穿刺正染
在实际的切肝过程中,辨认目标肝段的方法主要有[6]:解剖进入拟切除肝段的门静脉、肝动脉的分支,并加以阻断,肝外通过缺血线及肝内通过肝静脉分支的走行而共同决定切除界面;或结扎相应门静脉、肝动脉分支后注入靛蓝染色,通过染色及缺血线决定切除界面;也可采用术中超声引导肝切除。然而,这些方法均有各自的局限,靛蓝染色持续时间较短,只能在肝脏表面根据染色范围划定边界,肝切除过程中在断肝平面上不能持续追踪染色。而解剖Glisson鞘[7],结扎目标肝段、叶的门静脉与肝动脉分支,通过缺血线确定切肝界面,只能确定肝外缺血线,肝内无法见到明确的缺血线,且因肝硬化、肝转位、肝增生等病变,使肝脏解剖移位或肝表面缺血线不明显、肝内静脉变异寻找困难,限制了精准性肝切除术的进一步发展。而术中超声引导,对肝脏表浅、微小肝脏病灶分辨力不佳,且大多数小肝癌分化较好,缺乏明显的超声特征,术中超声对其检出能力有限,术者需具备丰富的超声诊断经验,也限制了其进一步发展。
吲哚菁绿荧光融合影像技术在肝脏切除过程中,可帮助术者精准确定切除界面,正逐渐得到广泛应用[8-9]。ICG是一种被FDA批准使用的安全药物,已在检查肝功能储备、肝脏血流量等领域应用了50余年。ICG静脉注射后可快速与血浆蛋白、脂蛋白结合,可被波长750~810 nm的外来光激发,发射波长约为830 nm的近红外光,经特殊装置接收后可在显示屏上显示绿色或紫色荧光影像(根据使用设备决定),其信号不被胆红素或水吸收,可穿透较深的肝组织显影。与靛蓝染色相比,ICG具有以下优点:(1)ICG有肝脏特异性摄取并经胆道排泄的特性,无肠肝循环、淋巴回流,不会形成二次污染;(2)可使肝表面及实质内产生清晰、持久的荧光染色,断肝过程中可根据染色随时调整切肝平面,在彻底切除病灶的同时最大限度保留剩余肝脏;(3)ICG染色无需阻断肝动脉,因ICG被肝细胞特异性摄取,并通过胆汁排泄,不会被肝动脉血流洗脱,从而简化了染色流程[10]。肝脏切除范围可通过荧光染色、缺血线及肝静脉走行,必要时辅助术中超声共同确定。
本研究采用4种肝脏ICG荧光染色方式[10],包括术中正染法、术中反染法、术前给药肿瘤染色法、超声引导穿刺正染法。我们的经验是,局限于左半肝、左肝外叶、右半肝的肝肿瘤与肝内胆管结石,需行标准左半肝、左肝外叶、右半肝切除术,可通过解剖第一肝门左横沟、右横沟或劈开肝实质,较精准地找到供应预切除肝组织的门静脉分支、肝动脉分支,既可采用正染法,通过门静脉分支远端注入ICG 0.25 mg,注射后30 s~1 min预切除肝脏可见确切的荧光,也可采用反染法,Glisson鞘内或鞘外结扎预切除肝组织的门静脉、肝动脉分支,并通过外周血管注入ICG 0.25 mg,注射后30 s~1 min预切除肝脏未见荧光,而需保留的肝脏见确切的荧光染色。该方法的优点主要在于可于肝实质内实时追踪、确定切肝界面。如仅通过缺血线判断切肝界面,肝外可通过缺血线判断,但肝内未见明确的缺血线,且肝段间的界面是凸凹不平的,已往切肝过程中,在肝实质内无法准确地界定切肝平面,仅凭术者经验及肝中静脉走行大致判断,往往切肝面为一平整的界面,但它与肝段间的实际界面有一定误差,造成肝组织多切或少切,违背了精准肝切除的理念。
本研究中,15例肝脏占位性病变包括肝细胞腺瘤2例、错构瘤2例、脂肪瘤1例、血管瘤1例、原发性肝细胞癌9例。肝脏良性病变的治疗,以完整切除病灶同时尽量不切或少切除正常肝组织为宜。而肝癌治疗领域的特点是多种方法、多个学科共存,包括术前疾病的筛查与诊治、术前评估与治疗、手术治疗、术后追踪及继续治疗等,其中手术治疗包括肝切除与肝移植,肝切除仍是肝癌患者获得长期生存最重要的手段[11]。能否完整切除肿瘤、降低肿瘤复发率,同时尽可能多地保留正常肝组织及其血供、胆道回流,从而降低术后肝功能衰竭的发生,是术者追求通过手术为患者获取最大利益的目标。ICG荧光染色引导肝切除术治疗肝脏恶性肿瘤,使切肝过程更精准、更精细,在切除病灶的同时使患者承受最小的伤害,9例原发性肝细胞癌患者,术后检查未见肿瘤残余,未出现肝功能衰竭,表明此术式的可行性。因肿瘤组织虽有其自身血供,但往往伴随胆道排泄功能障碍,可使ICG残留而染色,然而对于不同部位及不同分化肿瘤的切除,我们采用不同的染色方法。(1)位置较表浅的肿瘤,如病灶为高分化肿瘤,因其组织结构、形态与正常肝组织肉眼直视下很难区分,甚至术中超声也分辨困难,在实际切肝过程中往往很难判断其确切位置,在术前恰当的时间(2~7 d)经外周静脉注入ICG 2.5~3 mg,术中可见肿瘤均匀染色,为术中切除提供精确定位及切除范围。低分化肿瘤,术中组织形态与正常肝组织区别较大,肉眼直视下很容易区分,但通过术前ICG染色,可发现较小的肿瘤病灶或肿瘤卫星病灶,使肿瘤切除相对彻底,并同时保留较多的正常肝组织,符合精准肝切除的理念[12]。(2)位置较深的肿瘤,往往通过肝脏表面无法看到病灶,只有切开肝实质后才能发现,以往通过术前影像学检查在肿瘤周围劈开肝实质寻找病灶,但因术中出血污染手术视野或肿瘤分化高与正常组织区别较小,使术中判断肿瘤与周围正常肝组织的界限困难,甚至寻找病灶较困难,导致切除困难甚至误切正常肝组织,而真正肿瘤未切除。但通过术前ICG荧光染色,必要时结合术中超声在病灶周围劈开肝实质后可见到明确的荧光,可实时追踪切肝界面[13],为精准肝切除提供了保障。(3)局限于肝段或亚肝段的病灶,我们可采用超声引导穿刺正染法[14]。如病灶限于肝段或亚肝段,且供应该病灶的门脉少于两支、直径在3 mm以上,可行超声引导穿刺目标门脉注入ICG 0.25 mg,可见预切除肝段或亚肝段染色,根据染色判断切除界面,此术式难度较大,国内开展较少,需通过术前计算机三维立体成像分析供应目标肝段的门脉分支,且能通过术中超声引导精准穿刺目标门脉分支,完成染色。其优点在于,对于局限于肝段或亚肝段的较小病灶或患者本身肝硬化较重需保留较多肝组织的患者,可精准定位病灶,根据染色范围导航,可在彻底切除病灶的同时尽可能多地保留正常肝脏,较以往的标准肝段切除术更精细、更有效。此术式我科仅开展2例,1例因目标门静脉分支较细,穿刺困难,导致染色失败。
本研究中5例原发性肝细胞癌合并乙型病毒性肝炎患者,术后长期口服替诺福韦酯,并定期复查乙肝DNA,2例肿瘤复发。回顾2例患者资料,术中见结节性肝硬化较重,除包块外多个结节轻度染色,染色结节术中冰冻切片为良性,则仅行染色明显的包块切除,患者术后肿瘤复发,考虑术中病灶诊断困难,尤其高级别的内瘤变染色效果不理想,表明ICG荧光染色在肝硬化较重的患者中容易造成误判,导致少切或多切。复发患者中,1例术后又行肝动脉化疗栓塞治疗,另1例拒绝治疗,终因多器官功能衰竭死亡。
因肝内胆管结石行肝切除术的患者占据了基层医院肝切除术的很大比例,往往需行解剖性半肝或肝叶切除术才能彻底清除病灶。我们的经验是既可采用正染法也可采用反染法,具体方法前文已述,但断肝后需联合胆道镜探查取石。腹腔镜下解剖并切开胆总管,直径0.5 cm纤维胆道镜经胆总管切口或肝断面胆管残端取尽肝内外胆管结石,再次探查胆管无结石残留后留置T管。本研究中联合腹腔镜下胆道镜探查取石术16例,术后3例存在胆总管结石残留,3个月经窦道再次胆道镜取石,胆总管残余结石考虑系肝内残余小结石经肝内次级小胆管排入胆总管所致。肝内胆管结石的病因仅少数继发于胆道感染、胆道蛔虫、Oddi括约肌功能异常引起肠液反流等,多由胆道狭窄引起,往往狭窄的胆道多发生于各肝叶、肝段的起始分叉处,在ICG荧光染色的引导下行精准肝切除术,可解剖性切除含有狭窄胆道的肝叶、肝段,去除了术后结石再发的主要病因。本组3例残余结石患者,考虑为肝内胆管结石残留,而不是结石再发,随访未见结石复发,表明ICG荧光染色导航肝切除术治疗胆石症的效果确切。
ICG荧光染色的实际应用也存在许多限制:(1)ICG的穿透能力有限,仅能穿透肝实质5 mm,对于肝脏实质内的病变显影往往不明显,此时需术者通过术前影像学检查,大体判断病变位置后劈开肝实质,才能看到染色,或通过术中超声定位病灶,术者需具备术中超声使用能力。(2)在反染中,如阻断进入病灶的门静脉分支不彻底,或存在交通支,使目标肝同时染色,导致染色失败,本组中1例反染患者因此未能染色成功。(3)肿瘤染色中,具体给药时间尚无明确标准,多凭术者经验判断。对于高分化肿瘤,如给药时间较早,ICG已代谢,术中未见染色;肝硬化患者,如给药时间较短,因硬化肝组织的ICG代谢较慢,往往出现ICG残留,容易将硬化肝结节误认为肿瘤组织,而出现假阳性,或全肝染色无法分辨肿瘤,导致染色失败。本组中1例患者因肝硬化较重,在术前6 d染色,仍出现肝脏多处局灶性染色,无法辨认肿瘤与硬化肝结节;2例高分化腺瘤患者术前注入的ICG时间较长(5~7 d),导致ICG很快代谢,而未见明显染色,也限制了ICG在肿瘤切除中的应用。(4)在超声引导下术中对肝段或亚肝段的染色难度较大,需将穿刺针扎入目标肝段的门静脉中,往往这类门静脉较细且与周围血管、胆管毗邻关系复杂,实际操作困难,但如果染色成功则可很好地显示目标肝段,再根据染色范围切除肝脏,做到真正的精准肝切除。(5)ICG荧光染色需通过特殊的摄像头及显示器才能看到,在腹腔镜肝切除中可随时转换普通模式与荧光模式,实现实时导航,但在常规开腹手术中肉眼无法看到染色,需引入该设备,操作繁琐且摄像头位置固定困难,实际应用意义不大[15]。
通过本次临床观察,我们对于需行术前染色的肝肿瘤患者,术前检查明确提示患者伴有肝硬化,因硬化肝结节ICG代谢较慢,容易出现假阳性,可考虑减少ICG用量并延长术前用药时间(至少大于1周);对于术前B超、CT等检查考虑为肝脏高分化腺瘤、结节性增生等良性病变时,适当减少术前给药时间,我们一般于术前2 d给药,病灶得到很好的染色。关于ICG的用量尚无统一标准[16],我们在术中正染与反染中通过门静脉注入ICG 0.25 mg,术前染色中经外周血管注入ICG 2.5~3.0 mg(0.05 mg/kg),也取得了较好的效果,但具体用法、用量尚需不断经验总结及参考国内外专家的指导。
综上所述,ICG荧光染色是近年在精准性肝切除术中,继术前计算机三维立体成像、术中超声后出现的又一种新的辅助手段,为肝切除提供了实时导航及有力保障,值得进一步研究与推广。
