血必净注射液对急性胰腺炎大鼠肺损伤及肺组织TLR4、NF-κB、TNF-α表达的影响
2020-12-13董小鹏王丽娟赵春霖张建平潘海邦易剑锋石育弘
董小鹏王丽娟 赵春霖张建平潘海邦易剑锋石育弘
(1.甘肃中医药大学,甘肃兰州 730000;2.甘肃省中药药理与毒理重点实验室,甘肃兰州 730000;3.甘肃中医药大学附属医院,甘肃兰州 730020)
急性胰腺炎(acute pancreatitis,AP)是以胰腺外分泌部的炎症为特征,其发生发展与腺泡细胞损伤和局部和全身炎症反应有关。根据发病速度和病情严重程度,在2012年亚特兰大国际共识修订分类中将其分为3种类型:轻度胰腺炎 (mild acute pancreatitis,MAP)、中度胰腺炎(moderately severe acute pancreatitis,MSAP)和重度胰腺炎(severe acute pancreatitis,SAP)[1]。AP一般起病较急,尤其SAP病情进展迅速,且伴有多种并发症。其中,以急性肺损伤(acute lung injury,ALI)和急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)最为常见,这也是胰腺炎引起死亡的主要原因[2-3]。近年来,AP发病率逐年增高,每年增幅3.4%左右[4],与此同时对于AP各种并发症尤其ALI缺少有效安全的药物,因此迫切需要积极开始实验及临床研究寻找研发相应治疗药物。血必净注射液属于国家二类新药,临床研究表明血必净注射液可显著改善SAP患者体内氧化应激状态,抑制炎症反应,用于SAP患者的治疗并具有潜在肺功能保护作用[5-7]。实验研究结果提示血必净注射液能够降低AP大鼠血清细胞因子TNF-α、IL-1β (白细胞介素-1β)和IL-6 (白细胞介素-6)的水平,通过抑制炎症反应来改善胰腺组织病理损伤[8],但对于AP引发肺损伤的治疗机制研究报道较少。因此,本研究首先利用生物信息学方法分析出AP肺损伤发病过程中可能的靶点及其功能,同时建立AP大鼠模型观察血必净注射液对肺组织TLR4、NF-κB、TNF-α 表达水平的影响,以期为今后血必净注射液的临床推广及治疗机制研究提供一定的实验依据。
1 材料
1.1 高通量芯片数据库 从GEO数据库[9](https://www.ncbi.nlm.nih.gov/geo/)中检索与AP与ALI相关的高通量转录组芯片数据。根据研究物种和样本数量,选择Hedegger K等提交的GSE121038数据集和XU W等提交的GSE48787数据集。GSE121038存储用雨蛙肽制备的AP模型小鼠和正常小鼠胰腺组织转录组芯片数据,每组各4个样本,样本编号分别为GSM3424904~GSM3424907及GSM3424908~GSM3424911。GSE48787存储用脂多糖制备的ALI模型小鼠和正常小鼠肺组织转录组的芯片数据,每组各选3个样本,样本编号分别为GSM118462~GSM118462及GSM1184630~GSM1184632。
1.2 实验动物 SPF级SD大鼠48只,雌雄各半,体质量(220±20)g。由甘肃中医药大学SPF级动物实验中心提供。实验动物生产许可证号SCXK (甘)2015-0002。
1.3 药物及主要试剂 血必净注射液(天津红日药业股份有限公司,批号1809101,规格10 mL/支,主要成分是红花、赤芍、川芎、丹参、当归);牛磺胆酸钠(北京索莱宝公司,批号20200909,规格25 g,使用前用0.9%生理盐水配成5% 质量浓度);TLR4 (bs-20594R)、NF-κB (bs-2695R)、TNF-α (bsm-0387M)双抗体夹心酶联免疫吸附试验(ELISA)试剂盒(北京博奥森生物技术有限公司)。
1.4 主要仪器 BS110电子天平(德国赛多利斯公司);TEC5组织包埋机(北京怡康勇佳科技有限责任公司);QPJ-1C型石蜡切片机(天津爱华医疗器械有限公司);olympusVanox型光学显微镜(日本Olympus公司);DZF-1AS真空干燥箱(北京科伟永兴仪器有限公司)。
2 方法
2.1 疾病相关高通量芯片数据DEGs筛选及相关通路分析 DEGs是在转录水平发生表达量改变的一些基因,可能在疾病的发生发展中发挥重要作用。在GSE121038和GSE48787数据集中,利用GEO数据库自带的在线分析工具GEO2R分别筛选AP相关的DEGs及ALI相关的DEGs。筛选标准为①adj P<0.05;② | log FC| ≥1.5。分别选取2个数据集的上调DEGs和下调DEGs取交集,作为AP伴发ALI的DEGs进行后续分析。在KEGG数据库[10](https://www.kegg.jp/kegg/mapper.html)输入上述筛选的DEGs及相应物种信息,检索DEGs相关的信号通路。
2.2 动物分组、疾病模型制备及给药 大鼠按体质量分层随机分为假手术组、AP模型组、血必净注射液组,16只/组。适应性喂养1周。造模前各组大鼠均禁食12 h,自由饮水。本实验采用牛磺胆酸钠制备AP实验动物模型。采用10%水合氯醛3 mL/kg腹腔注射麻醉大鼠后仰卧位固定于无菌手术台上。腹部备皮、消毒,开腹后在胰腺被膜下多点注射5%牛磺胆酸钠,当胰腺颜色由淡粉色变为深红色时关闭腹腔。假手术组在开腹后仅轻轻翻动胰腺及十二指肠数次即可关腹。造模结束后,将大鼠以右侧卧位放回鼠笼,禁食、水,并注意保温,同时密切观察其生命状态。血必净注射液组大鼠造模前12 h、造模后10 min内、6、24 h分别腹腔注射血必净注射液4 mL/kg,其余各组大鼠在相同时间点腹腔注射等体积生理盐水。
2.3 样本采集及指标检测 于造模后6、24 h 2个时间点每组随机选取8只大鼠心脏取血,分离血清用于AMY检测。处死大鼠后取出胰腺和肺脏,用于组织病理学观察及肺脏组织TLR4/NF-κB表达水平的检测。
2.3.1 血清AMY检测 利用AMY ELISA试剂盒检测各组大鼠血清AMY活性,具体操作严格按照说明书进行。
2.3.2 胰腺及肺脏组织病理学观察 处死大鼠开腹后,观察腹水颜色、胰腺组织及胰周组织器官的形态变化。取出部分胰腺经甲醛固定。打开胸腔后观察肺脏病理学变化,取出部分右肺经甲醛固定。甲醛固定的组织经梯度酒精脱水,二甲苯浸透和石蜡包埋,切片,进行HE常规组织学染色。
2.3.3 肺脏TLR4、NF-κB、TNF-α 表达水平检测 取出大鼠部分左肺制备组织匀浆,利用相应ELISA试剂盒检测肺脏中TLR4、NF-κB、TNF-α 表达水平,严格按照说明书进行操作。
2.4 统计学分析 使用SPSS 23.0统计学软件对实验所得数据进行分析,采用单因素方差分析方法。正态分布计量资料采用均数±标准差表示。检验水准取α=0.05,P<0.05为差异有统计学意义。
3 结果
3.1 AP肺损伤DEGs筛选结果及相关通路分析 本研究从GSE121038数据集中筛选到相关DEGs 809个(上调基因562个,下调基因247个)。从GSE48787数据集中筛选到相关DEGs 613个(上调基因319个,下调基因294个)。将两个数据集的上调基因和下调基因分别取交集,共获得54个DEGs (上调基因40个,下调基因14个)。火山图见图1。在KEGG数据库中,分析结果显示DEGs主要集中在Toll样受体、TNF-α、HIF-1等信号通路且以上调基因为主,提示ALI发病过程中这些通路可能被异常激活。见图1~4。
3.2 血清AMY活性检测结果 ELISA检测结果显示,造模后6 h及24 h AP组及血必净注射液组血清AMY活性显著高于假手术组,但在24 h血必净注射液组AMY活性低于AP组,提示血必净注射液对重症AP肺损伤可能有一定治疗作用,但需联用其他药物以加强疗效。结果见表1。
表1 血必净对AP大鼠血清AMY活性的影响(n=8,)
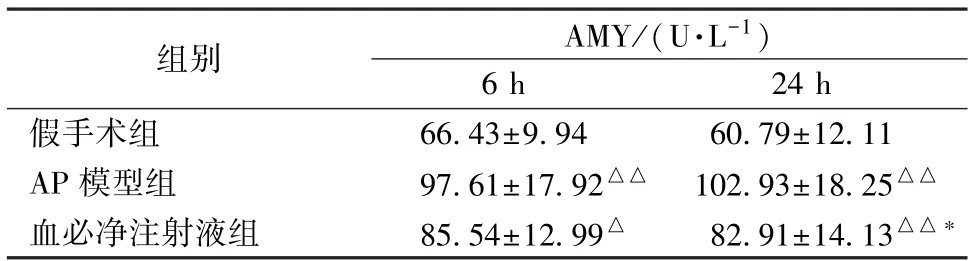
表1 血必净对AP大鼠血清AMY活性的影响(n=8,)
注:与假手术组比较,△P<0.05,△△P<0.01;与AP模型组比较,*P<0.05。
3.3 血必净对AP大鼠胰腺及肺脏组织病理学的影响 胰腺组织切片HE染色镜下观察显示假手术组胰腺结构完整清晰,无胰腺腺叶崩解破坏,未见有炎症细胞浸润。造模后6 h时AP模型组大鼠胰腺腺叶出现崩解破坏,有炎症细胞浸润,24 h时炎症细胞浸润增多;血必净注射液组胰腺结构与假手术组不同,也可见胰腺腺叶损坏、炎症细胞浸润等情况,但其病损程度与AP模型组比较明显好转,见图5。肺组织切片HE染色镜下观察显示假手术组肺组织结构完整,肺泡腔清晰,肺泡内未见炎症细胞及水肿。造模后6 h时AP模型组肺组织出现破坏,结构不完整,肺泡腔内出现炎症细胞浸润及水肿并可见到肺间质充血水肿及增厚,24 h时炎症细胞略有增多。血必净注射液组6 h和24 h也有一定程度病理改变,但较AP模型组减轻,见图6。
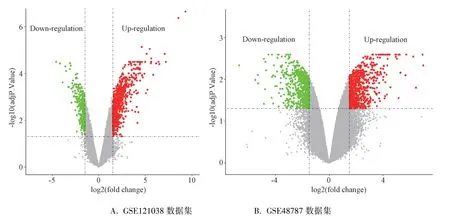
图1 GSE121038和GSE48787数据集DEGs火山图
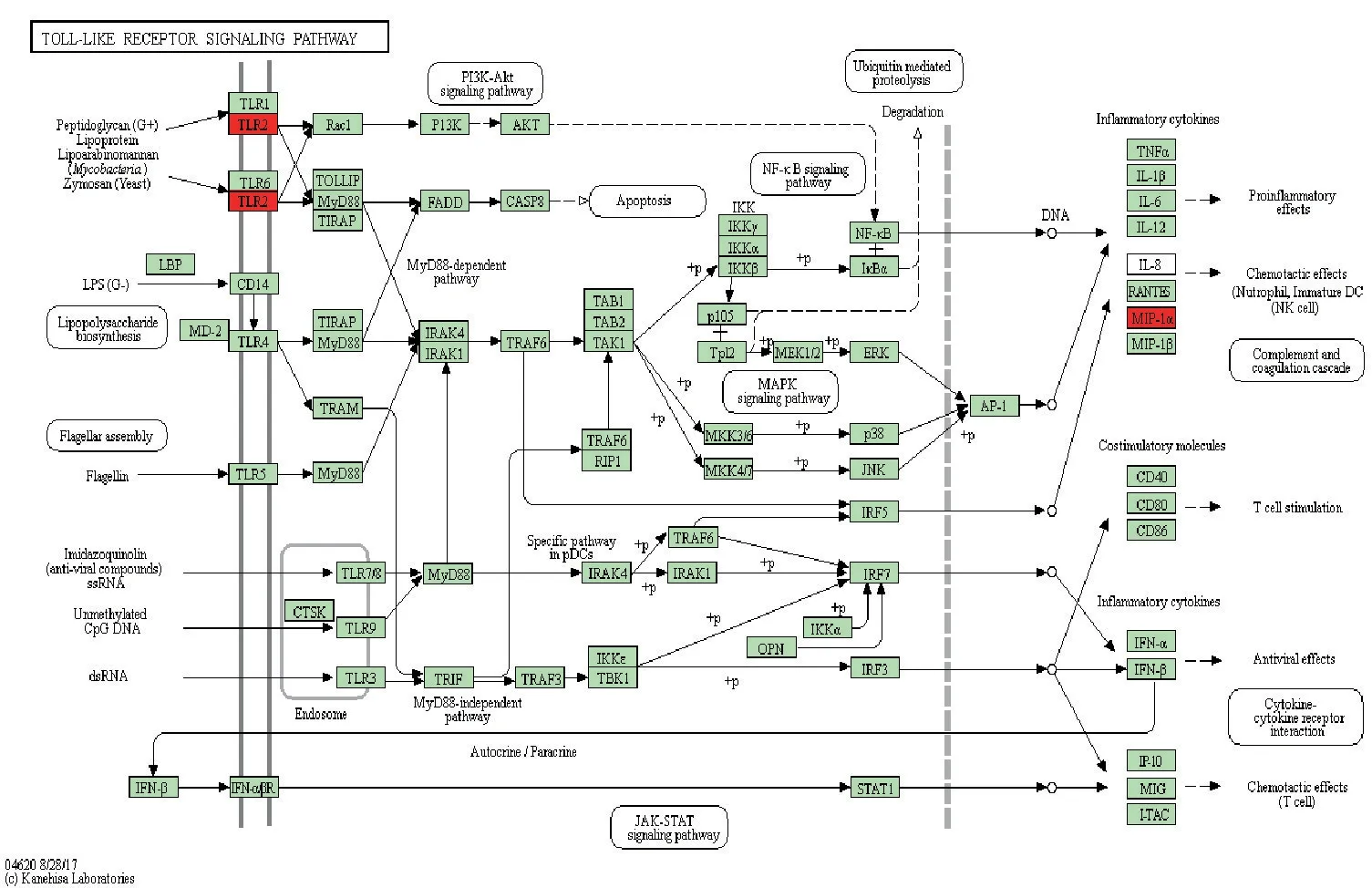
图2 Toll样受体信号通路

图3 TNF信号通路
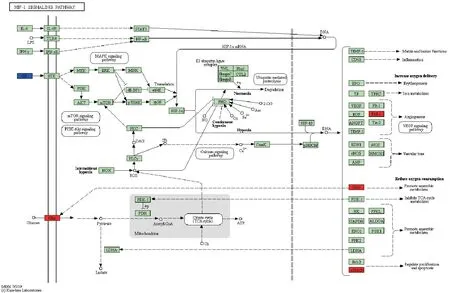
图4 HIF信号通路
3.4 血必净对AP大鼠肺脏TLR4、NF-κB、TNF-α 表达水平的影响 ELISA检测结果显示,在造模后6 h,与假手术组比较,AP模型组大鼠肺脏TLR4、NF-κB、TNF-α 表达水平显著升高。血必净注射液组大鼠TLR4、NF-κB、TNF-α表达水平也显著升高,比AP模型组有降低趋势但无统计学差异(P>0.05),见表2。造模后24 h,AP模型组大鼠肺脏TLR4、NF-κB、TNF-α 表达水平进一步升高,血必净注射液组大鼠TLR4、NF-κB、TNF-α 表达水平较AP模型组有所下调,其中以TNF-α 表达水平下降最为显著(P<0.01),见表3。
表2 造模后6 h肺脏TLR4、NF-κB、TNF-α 表达水平(n=8,)

表2 造模后6 h肺脏TLR4、NF-κB、TNF-α 表达水平(n=8,)
注:与假手术组比较,△P<0.05,△△P<0.01。
表3 造模后24 h肺脏TLR4、NF-κB、TNF-α 表达水平(n=8,)

表3 造模后24 h肺脏TLR4、NF-κB、TNF-α 表达水平(n=8,)
注:与假手术组比较,△P<0.05,△△P<0.01;与AP模型组比较,*P<0.05,**P<0.01。
4 讨论
AP是一种临床常见的外科急腹症,主要病因是胆道疾病和酒精,但近年来高脂血症继发的胰腺炎比例也越来越高[11]。此外,自身免疫性胰腺炎、药物性胰腺炎也开始普遍受到关注[12]。AP主要特征是全身炎症和胰腺坏死/凋亡[13]。目前研究认为AP发病机制的关键就是体内促炎反应与抗炎反应的失衡,大量炎症因子不仅损害胰腺而且可以损伤胰腺以外的远隔脏器,如肺脏、肝脏、肾脏腺等。其中以ALI最为突出,并且可以演变成为呼吸衰竭,是胰腺炎引起死亡的主要原因[14]。因此,不断深入研究SAP引发ALI的发病机制和治疗方法是医学领域研究的重要课题。
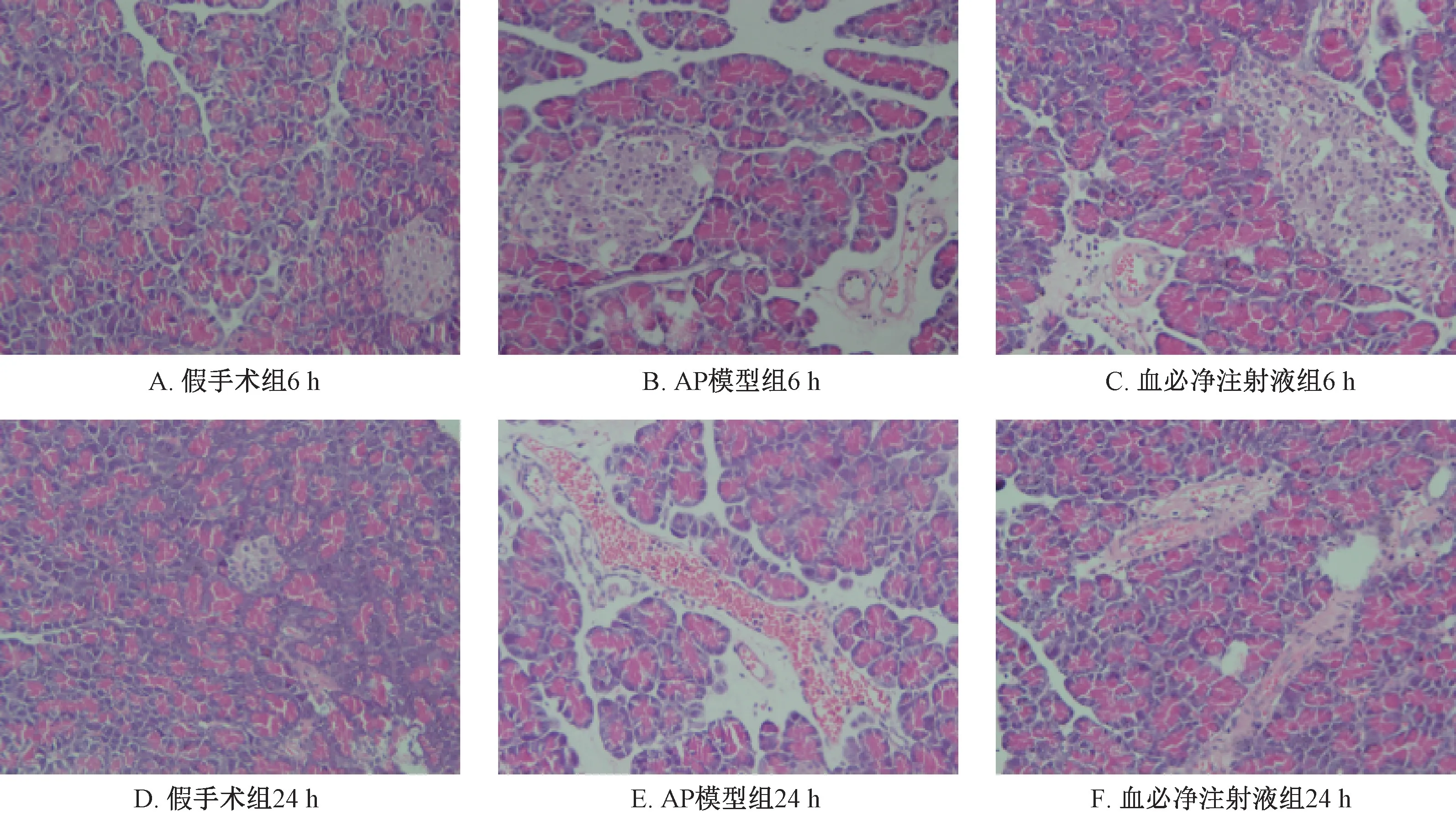
图5 血必净注射液对AP大鼠胰腺病理形态改变的影响(HE×400)
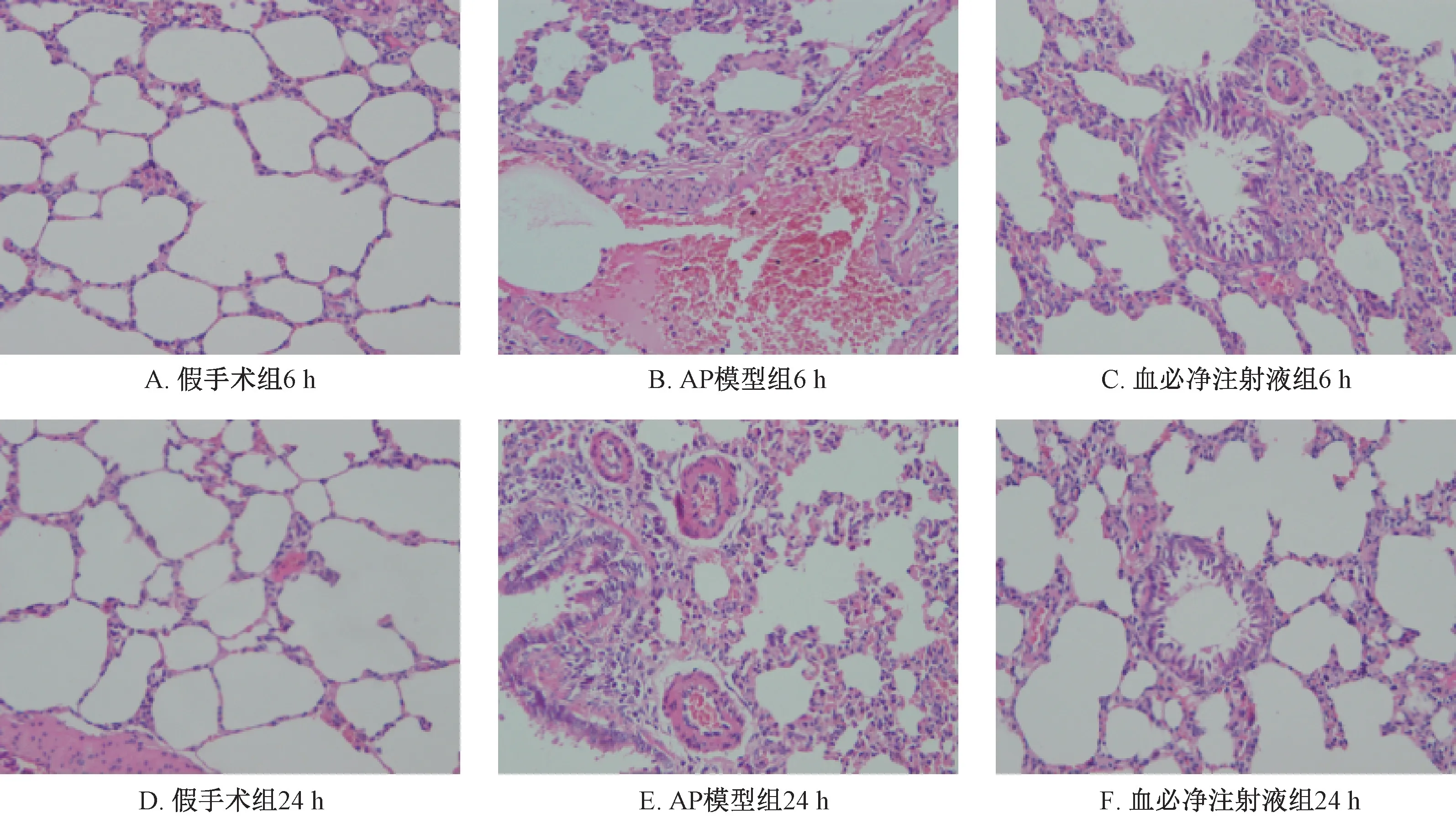
图6 血必净注射液对AP大鼠肺脏病理形态改变的影响(HE×400)
GEO数据库是由美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)开发并维护的一个基因表达数据仓库和在线资源,收录了世界各国研究机构及研究者提交的各种高通量数据,是生物信息学研究分析的重要数据来源,对于疾病发病机制的研究、潜在靶点的筛选提供了重要信息[15-16]。本研究从GEO高通量数据库中筛选AP及ALI样本和正常对照样本之间具有差异表达的基因,共筛选出的54个主要参与促进炎症反应、IL-1及TNF介导的细胞反应、凋亡过程、中性粒细胞趋化过程等,并且富集在HIF-1信号通路、TNF信号通路、趋化因子信号通路、PI3K-Akt (磷脂酰肌醇三激酶-蛋白激酶B)等信号通路。其中,TNF信号通路是典型的炎症反应相关通路。已有大量研究证实AP引发的ALI主要就是由于炎性介质和细胞因子如IL-1β、TNF-α 大量释放所致[17],且TLR4/NF-κB信号通路处于激活状态[18],TLR-4可介导NF-κB的活化,从而诱导产生大量炎症因子如IL-1β、TNF-α、IL-6等,这些炎症因子又可以激活TLR4/NF-κB通路,进而引起炎症“瀑布式反应”。
AP并发ALI发病机制复杂,单一的抗炎药物难以取得良好的疗效。血必净注射液由当归、红花、川芎、赤芍、丹参5味中药组成,具有多成分多靶点的作用特点[19],主要用于脓毒症治疗,其作用机制主要是通过抑制炎症因子的产生[20],此外还与抗内毒素、抑制炎症、恢复凝血和免疫功能调节有关[21-22]。血必净注射液在临床使用时给药途径为静脉注射,但在动物实验中考虑到大鼠尾静脉较细,注射时药物易渗漏于周围组织影响实验结果,有研究表明腹腔注射可代替尾静脉注射[23],所以一些动物实验中以大鼠腹腔注射方式给予血必净治疗[24-25]。根据血必净注射液临床每日使用剂量,结合大鼠与人药物剂量折算系数6.25[26]及本研究中的给药间隔时间,故而计算出大鼠腹腔注射给药剂量为4 mL/kg,也见其他研究给予大鼠腹腔注射4 mL/kg血必净注射液进行治疗[27-28]。本研究利用常见的胰腺被膜下注射5% 牛磺胆酸钠的方法制备AP大鼠模型[29],分别利用血清AMY含有量和肺组织病理学改变、TLR4/NF-κB信号通路关键分子TLR4、NF-κB、TNF-α 的表达水平初步观察血必净注射液对于AP大鼠ALI的保护作用及可能机制,结果表明血必净注射液可能通过抑制TLR4/NF-κB炎症信号通路发挥一定的治疗效果。
综上所述,本研究利用生物信息筛选AP并发ALI的相关靶点及富集的信号通路,同时观察血必净注射液对AP并发ALI模型大鼠的治疗作用及可能机制,以期为该病机制的深入研究及血必净注射液作用机制的探讨提供依据。
