膈下逐瘀汤对慢性盆腔炎大鼠TLR4/NF-κB信号的影响
2020-12-13姚春娣朱澄漪郁金芬蒋志涛
姚春娣,朱澄漪,温 玲,郁金芬,蒋志涛
(南京中医药大学附属张家港医院,江苏张家港 215600)
盆腔炎性疾病 (pelvic inflammatory disease,PID)是指女性上生殖道及其周围组织的一组感染性疾病,主要包括子宫内膜炎、输卵管炎、输卵管卵巢脓肿、盆腔腹膜炎等[1]。慢性盆腔炎(chronicpelvic inflammatory disease,CPID)是指盆腔炎性疾病未得到及时正确的治疗而继发的一系列后遗症,故又称为盆腔炎性疾病后遗症,其主要临床表现为反复发作的盆腔疼痛、腰骶酸痛、痛经等,如不及时治疗,易导致不孕不育、异位妊娠等[1-2]。慢性盆腔炎是临床常见病、多发病,也是迁延不愈的疑难病。由于慢性盆腔炎病程长,易复发,严重影响着女性的身心健康,是临床上亟待解决的一大妇科难题,截止至目前,西医对此没有理想的治疗药物和方法,中医药对慢性盆腔炎有独特的治法治则和独到的疗效,而且不会产生明显的耐药现象。
膈下逐瘀汤来源于清代王清任的 《医林改错》,是历代医家治疗气滞血瘀型慢性盆腔炎及痛经的经典名方。全方由当归、川芎、赤芍等药味组成,具有活血化瘀、行气止痛之效,对慢性盆腔炎气滞血瘀证有显著疗效[3]。临床与药理研究已证实,膈下逐瘀汤对慢性盆腔炎疗效确切,可改善患者血液流变学,抑制患者TNF-α 水平[4-5],但其机制仍不清楚。本研究探讨膈下逐瘀汤是否可通过调控TLR4/NF-κB信号抑制慢性盆腔炎模型大鼠炎症,改善其血液流变学参数,以期为该方用于妇科炎性疾病的治疗提供科学依据。
1 材料
1.1 动物 50只SPF级SD雌性大鼠,8周,体质量180~220 g,购自南京青龙山动物养殖场,使用许可证号SYXK (苏)2017-0001。自由饮水饮食,室温(22±1)℃,保持12 h昼夜交替。
1.2 药物与试剂 膈下逐瘀汤由川芎12 g、桃仁9 g、丹皮9 g、赤芍9 g、红花6 g、乌药9 g、延胡索12 g、五灵脂6 g、当归15 g、香附9 g、枳壳6 g、甘草6 g组成,上述饮片均购自苏州市天灵中药饮片有限公司(批号分别为170606、171106、170925、170812、170908、170521、170412、170718,170408、170723、170628、170508),上述饮片经张家港市中医医院余辉主任中药师鉴定为正品,按处方比例取膈下逐瘀汤各药味适量,加水煎煮2次,每次1 h,合并煎液,浓缩至每1 mL相当于2 g饮片的流浸膏(2.0 g/mL),备用,各味药材由苏州市天灵中药饮片有限公司提供,经张家港市中医医院余辉主任中药师鉴定均符合要求。大鼠IL-1β ELISA检测试剂盒 (英国Abcam公司,货号ab100768);大鼠IL-6 ELISA检测试剂盒 (英国Abcam公司,货号ab100772);大鼠TNF-α ELISA检测试剂盒(英国Abcam公司,货号ab100785);TLR4抗体 (英国Abcam公司,货号ab22048);NF-κB p65 (phospho S536)抗体(英国Abcam公司,货号ab86299);β-actin抗体(英国Abcam公司,货号ab8227);HRP-山羊抗兔IGg (英国Abcam公司,货号ab6721);DAB显色试剂盒(碧云天生物技术有限公司,货号P0203);其他试剂为分析纯,购自国药集团化学试剂有限公司。
1.3 仪器 BSA124S分析天平(德国塞多利斯科仪器有限公司);MicroCL17R高速低温离心机(美国赛默飞世尔科技公司);LB-2A系列全自动血流变分析仪(天津市唐宇医疗器械科技发展有限公司);DMI3000B光学显微镜 (德国莱卡公司);ELx800酶标仪 (美国伯腾仪器有限公司);EG1160石蜡包埋机(德国莱卡公司);RM201石蜡切片机(德国莱卡公司);ABI 7500实时荧光定量PCR系统(美国ABI公司)。
2 方法
2.1 慢性盆腔炎大鼠模型的建立 各组大鼠腹部常规消毒后用10% 水合氯醛腹腔注射麻醉(350 mg/kg),仰卧位固定后,腹部用碘伏消毒,下腹部正中切口约2 cm,暴露子宫,除假手术组外,用1 mL注射器在子宫分岔处分别向左右两侧卵巢方向缓慢注入25%苯酚胶浆0.06 mL,假手术组,注入0.06 mL生理盐水。注毕,分层缝合伤口,消毒手术区域。
2.2 分组与给药 50只SPF级成年未孕SD雌性大鼠,适应性饲养后,随机分为假手术组、模型对照组及膈下逐瘀汤低、中、高剂量组,每组10只。采用苯酚胶浆法复制慢性盆腔炎大鼠模型,造模1周后,各治疗组灌胃给药3周,治疗组大鼠给予膈下逐瘀汤流浸膏 (低、中、高剂量分别为2.5、12.5、25 g生药/kg),1次/d,连续21 d,假手术组和模型对照组同步灌胃给予等容量生理盐水。
2.3 标本采集 给药治疗结束后(前1天禁食不禁水),麻醉大鼠后,颈部主动脉采血,分别用血清管及肝素抗凝管收取全血,取部分肝素抗凝管中的全血分离血浆,用于检测血浆黏度,其余抗凝全血用于血液流变学检测,血清管中分离血清用于检测炎症因子。剖开大鼠腹腔,取双侧子宫,一侧组织于10%中性甲醛中固定,于4 ℃保存,用于HE染色和免疫组化检测;另一侧组织置于冻存管中,标号后存于-80 ℃超低温冰箱中,用于RT-PCR检测。
2.4 血液流变学检测 使用天津市唐宇医疗器LB-2A系列全自动血流变分析仪测定各组大鼠血液流变学指标。检测在高切、中切、低切变率下各组大鼠的全血黏度及血浆黏度。
2.5 炎症因子检测 使用购买的大鼠IL-1、IL-6及TNF-αELISA检测试剂盒,检测大鼠血清中炎症因子的水平。参考各个试剂盒的说明书对标准品和样本进行稀释,并将不同浓度的标准品和待检测样品分别加入包被了不同抗体的96孔检测板中,重复反应后,加入对应试剂盒中的显色底物,显色后加入反应终止液。将96孔板置于酶标仪中,450 nm波长检测各板的吸光度值,根据不同浓度标准品的吸光度值绘制标准曲线,根据标准曲线计算各大鼠血清中IL-1、IL-6及TNF-α 的水平。
2.6 HE染色 取固定于10%福尔马林的各组大鼠子宫,垂直切取一段放于一次性包埋框中使用不同浓度的乙醇进行梯度脱水。脱水后,将子宫浸泡于二甲苯中30 min,之后将子宫放于融化的石蜡中1 h,使用包埋机将大鼠子宫包埋成蜡块,子宫横截面朝下。使用轮转切片机将含有大鼠子宫的蜡块切成5 μm的蜡片,展片后,将切片放于烤片机上使石蜡融化。将切片放入二甲苯中溶解石蜡。之后将切片使用从高到低浓度的乙醇进行复水。最后将蜡片置于去离子水中。获得复水的切片后,使用苏木素染色液进行染色,使用盐酸乙醇溶液分化后,自来水冲洗反蓝,使用尹红染色液进行染色后,对切片进行快速脱水并封片。封片后,使用光学显微镜对大鼠子宫组织进行拍照。
2.7 免疫组织化学染色 获得复水的大鼠子宫组织切片后,使用3%的H2O2孵育切片以阻断组织中的内源性过氧化物酶。PBS缓冲液清洗切片后,使用0.01 mol/L柠檬酸盐缓冲液在95 ℃的水浴锅中孵育切片20 min,以修复大鼠子宫组织中的抗原。使用正常山羊血清孵育切片20 min以封闭非特异性的抗原结合位点,将TLR4和NF-κB抗体稀释100倍后,4 ℃孵育切片过夜。之后使用HRP修饰的第二抗体在室温孵育切片1 h。清洗后,滴加DAB显色液,再次清洗后,使用苏木素复染。将切片脱水、透明封片后置于光学显微镜下对样本进行拍照。TLR4和NF-κB阳性表达处呈棕色,使用Image pro plus软件,对TLR4和NF-κB阳性表达处的平均光密度进行统计。
2.8 RT-PCR检测 冷冻保存的大鼠子宫组织,使用TRIzol法提取总的RNA。按照逆转录试剂盒的操作说明书将提取的大鼠子宫组织总RNA逆转录成cDNA。以获得的cDNA为模板,参考SYBR Green实时荧光定量PCR试剂盒说明书,使用ABI7500系统检测大鼠子宫组织中TLR4和NF-κBmRNA表达。GAPDH购买于生工生物工程 (上海)股份有限公司。目的基因使用的引物序列如下。 TLR4正向5′-GCTTGAATCCCTGCATAGAGG-3′,反向5′-TGTCTCCACAGCCACCAGATTCTC-3′;NF-κB正向5′-AACACTGCCGAGCTCAAGAT-3′,反向5′-CATCGGCTTGAGAAAAGGAG-3′; GAPDH正向 5′-GTGCTGAGTATGTCGTGGAG-3′,反向 5′-GTCTTCTGAGTGGCAGTGAT-3′。
2.9 统计学分析 免疫组织化学图片数据应用Image pro plus软件进行平均光密度的计算,计量数据以 ()表示,数据结果采用Graph Pad Prism7软件进行方差分析和作图。多组间的比较采用单因素方差分析,组件比较采用t检验,P<0.05为有统计学意义。
3 结果
3.1 膈下逐瘀汤改善慢性盆腔炎模型大鼠血液流变学参数 与假手术组比较,模型组大鼠在不同切变率的情况下全血黏度及血浆黏度升高(P<0.01);与模型组比较,膈下逐瘀汤各剂量组均降低大鼠全血黏度及血浆黏度(P<0.05,P<0.01)。见图1。
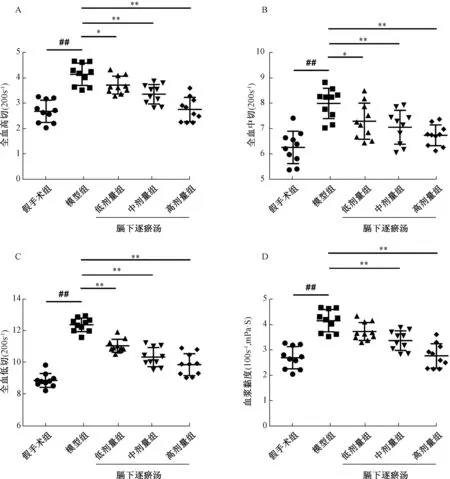
图1 膈下逐瘀汤对慢性盆腔炎模型大鼠血液流变学的影响(n=10)Fig.1 Effects of Gexia Zhuyu Decoction on hemorheology of chronicpelvic inflammatory disease model rats (n=10)
3.2 膈下逐瘀汤降低慢性盆腔炎模型大鼠血清中炎症因子的水平 与假手术组比较,模型组大鼠血清中的IL-1β、IL-6及TNF-α 水平升高 (P<0.01)。给药后,与模型组比较,除膈下逐瘀汤低剂量组血清IL-1β 水平未变化外(P>0.05),膈下逐瘀汤各剂量组IL-1β、IL-6及TNF-α 水平降低(P<0.01)。见图2。
3.3 膈下逐瘀汤改善慢性盆腔炎模型大鼠子宫病理学变化 HE染色结果显示,慢性盆腔炎模型大鼠子宫炎细胞浸润严重,膈下逐瘀汤给药后减轻模型大鼠子宫内的炎症。子宫HE染色进行组织学评分结果显示,膈下逐瘀汤中、高剂量组改善大鼠子宫的病理组织学评分(P<0.01)。见图3。
3.4 膈下逐瘀汤抑制慢性盆腔炎模型大鼠子宫内TLR4及NF-κB表达 免疫组织化学染色结果显示,与假手术组比较,大鼠子宫中TLR4及p-NFκB p65表达升高(P<0.01),膈下逐瘀汤给药后降低两者表达(P<0.05,P<0.01)。RT-PCR结果显示,大鼠子宫中TLR4及NF-κBmRNA表达升高,膈下逐瘀汤治疗后降低两者mRNA表达(P<0.05,P<0.01)。见图4。
4 讨论
不同于PID早期时以细菌感染为主,多数慢性盆腔炎患者并无细菌感染的临床证据,但病情仍持续进展,西医运用抗菌治疗对于急性期PID效果较好,但对慢性盆腔炎效果不明显,尤其对细菌等病原体所致的一系列病理损害非但无效,还会因抗生素长期大量使用甚至滥用而造成严重的耐药性,致使病情反复发作,迁延难愈[6-7]。西医抗生素治疗难以发挥作用,然而此病却是中医的优势病种,中医对其有独特的治法治则,中药对其有独到的疗效。因此,在慢性盆腔炎的临床治疗上应充分发挥中医药的优势,以造福于广大患者[8]。
源自清代王清任《医林改错》 中的膈下逐瘀汤为其五大活血化瘀代表方之一,是历代医家治疗气滞血瘀型慢性盆腔炎及痛经的经典名方,该方由当归、川芎、赤芍、牡丹皮、延胡索、乌药、五灵脂、桃仁、红花、香附、积壳、甘草组成,方中当归、川芎、赤芍、牡丹皮养血活血,清热凉血,祛瘀止痛;延胡索、乌药、五灵脂行气活血,散瘀止痛;桃仁、红花破血行瘀,活血调经;香附、枳壳疏肝理气,调经止痛;甘草调和诸药,缓急止痛。诸药合用,共奏活血化瘀、行气止痛之效[3]。对慢性盆腔炎而言,气行血活则瘀阻自除,胀坠自消,疼痛自止,数百年的临床实践已充分证明,膈下逐瘀汤对慢性盆腔炎气滞血瘀证有显著疗效[3]。

图2 膈下逐瘀汤对慢性盆腔炎模型大鼠血清中IL-1β、IL-6及TNF-α 水平的影响(n=10)Fig.2 Effects of Gexia Zhuyu Decoction on serum levels of IL-1β,IL-6 and TNF-α in chronicpelvic inflammatory disease model rats (n=10)

图3 膈下逐瘀汤对慢性盆腔炎模型大鼠子宫病理组织学的影响(n=10)Fig.3 Effects of Gexia Zhuyu Decoction on uterus histopathology of chronicpelvic inflammatory disease model rats(n=10)

图4 膈下逐瘀汤对慢性盆腔炎模型大鼠子宫组织TLR4及NF-κB表达的影响(n=10)Fig.4 Effects of Gexia Zhuyu Decoction on protein expressions of TLR4 and NF-κB in uteruses of chronic pelvic inflammatory disease model rats (n=10)
慢性盆腔炎的主要病理变化是免疫性病理损伤,表现为盆腔局部炎性渗出、粘连和增生,这是导致病情进展的主要原因[9]。谢芳等[10]认为瘀血阻滞为慢性盆腔炎的关键病机,治疗上应注重活血化瘀;慢性盆腔炎的病机关键在于血瘀,治疗上亦主张采用活血化瘀法[11]。现代医学认为,血液流变性异常是导致血液循环和微循环障碍的前提和基础,也是中医“血瘀证” 的重要实验指标[12]。慢性盆腔炎患者的血液呈明显的“浓、黏、凝” 状态,属于典型的血液流变学指标异常[13]。通过改变血流动力学状态,可改善血液循环和微循环障碍,并能减轻局部缺血、缺氧,促进局部损伤组织修复,抑制组织异常增生[14]。慢性盆腔炎长期的炎性刺激易引起周围组织粘连,局部血液循环障碍。研究显示,膈下逐瘀汤能够显著改善慢性盆腔炎模型大鼠血液流变学参数,提示膈下逐瘀汤对慢性盆腔炎模型大鼠可能具有治疗作用;同时,膈下逐瘀汤能够显著降低慢性盆腔炎模型大鼠血清中炎症因子的水平,提示膈下逐瘀汤能够改善慢性盆腔炎的炎性症状及“血瘀” 症状。
Toll样受体(Toll-like receptors,TLRs)是一类重要的天然免疫模式识别受体,在天然免疫和获得性免疫中均发挥重要作用[15]。TLR是一组跨膜受体蛋白,其配体与TLR聚合活化后,会激活NFκB炎症信号通路。TLR介导的信号诱导编码促炎因子相关基因的大量表达[16-17]。人类TLRs家族有12名成员已被发现,其中以TLR4为主。NF-κB作为普遍存在的转录因子,是多种信号转导途径的交汇点,不仅参与介导免疫应答、病毒复制、细胞凋亡和增殖的多种基因表达,在调节炎症反应的基因表达中也起关键作用。现已证实NF-κB可高效诱导多种细胞因子,包括IL-1β、IL-6和TNF-α 的表达,同时对参与炎症级联瀑布效应的多种酶的基因表达也具有重要的调控作用[18]。
虽然炎症因子在慢性盆腔炎中的形成机制目前尚未被完全揭示和阐明,但可以确定的是炎症反应对机体的损害主要是通过释放炎症因子来实现的[19]。IL-1β 可诱导IL-6的释放,IL-6又可增强组织细胞对IL-1β 的敏感性[20];TNF-α 作为促炎症因子和免疫调节因子,在炎症反应中起核心作用,是启动炎症的重要细胞因子,参与调节免疫应答与炎症反应[21]。结果表明,膈下逐瘀汤可以显著降低慢性盆腔炎模型大鼠血清中IL-1β、IL-6和TNF-α 等炎症因子的水平,这与临床研究的报道一致[22]。同时,研究还显示,膈下逐瘀汤对TLR4和NF-κB在慢性盆腔炎模型大鼠子宫中的表达就有显著的抑制作用。膈下逐瘀汤对慢性盆腔炎模型大鼠子宫中TLR4/NF-κB信号的抑制,导致IL-1β、IL-6和TNF-α 等炎症因子水平的下降,可能是其改善慢性盆腔炎模型大鼠血液流变学,发挥治疗“血瘀” 症状原因。
综上所述,以历代医家治疗气滞血瘀型慢性盆腔炎及痛经的经典名方膈下逐瘀汤为研究对象,揭示其对慢性盆腔炎模型大鼠的抗炎作用机制,以期阐明其临床上治疗慢性盆腔炎的作用机理,为膈下逐瘀汤广泛用于妇科炎性疾病的治疗提供科学依据。
