酱香型白酒中生物活性物质抗幽门螺杆菌作用评价
2020-12-07罗强刘杰刘志刚
罗强 刘杰 刘志刚


摘 要:目的:评价酱香型白酒中生物活性物质(Bio-active compounds, BAC)抗幽门螺杆菌(Helicobacter pylori, Hp)活性及潜在的作用机制。方法:BAC处理Hp菌液,观察Hp的活性及形态变化。RT-PCR分析BAC对Hp基因及相关毒力蛋白的表达影响。检测BAC处理Hp對胃黏膜上皮细胞GES-1活性、细胞凋亡的影响。结果:BAC可抑制Hp生长,但Hp形态未见明显改变;BAC可抑制Hp外膜蛋白基因(BabA)和毒力基因(CagA和VacA)的表达;抑制毒力蛋白(CagA和VacA)的表达;BAC可抑制Hp所致的GES-1细胞活性降低及细胞凋亡(p<0.05)。结论:BAC对Hp有一定的抑制作用,可通过降低Hp外膜蛋白基因(BabA)和毒力基因(CagA和VacA)及毒性蛋白(CagA和VacA)的表达抑制Hp对胃上皮细胞的损伤。
关键词:酱香型白酒;幽门螺杆菌;外膜蛋白;毒力蛋白
Abstract:Objective: To evaluate the anti-helicobacter pylori (Hp) potency and mechanism of bio-active compounds (BAC) in Maotai flavor liquor. Methods: The activity and the morphological changes of Hp were observed after the co-culture with BAC. RT-PCR was used to evaluate the effect of BAC on the expression of Bab A, CagA and VacA genes. The effect of Hp on the cell viability and apoptosis of gastric mucosal epithelial GES-1 cells was evaluated with CCK8 method and flow cytometry. Results: BAC inhibits the growth of Hp, and inhibits the expression of Bab A, CagA and VacA genes; BAC also attenuates the expression of CagA and VacA proteins; BAC significantly inhibits the decrease of cell viability and cell apoptosis of GES-1 cells induced by Hp infection (p<0.05). Conclusion: BAC can attenuate Hp induced gastric epithelial cells apoptosis and cell viability decrease by inhibiting the Bab A, Cag A and Vac A expressions.
Key words:Maotai flavor liquor; Helicobacter pylori; CagA; VacA
中图分类号:TS262.3
酱香型白酒是我国重要的白酒香型之一,具有与其他香型的白酒所不同的气味与口感。酱香型白酒的生产工艺复杂、耗时长、产量低,但其具有的独特香味受到人们的喜爱。文献报到,通过2D-GC-MS技术检测发现,酱香型白酒中至少含有500多种化合物[1]。众所周知,过量饮酒会导致肝脏疾病,但研究发现,适量饮用酱香型白酒未对肝脏造成损伤,推测是酱香型白酒具有的独特的化学成分起到了一定的减轻酒精对肝脏的损伤作用[2]。
世界范围内有超过50%的人群感染过幽门螺杆菌(Helicobacter pylori, Hp),而Hp感染会引起一系列诸如胃黏膜炎症、胃癌等的胃部疾病[3-4]。Hp对人胃黏膜的黏附在其定植和致病中起着关键作用,Hp粘附定植过程是根治Hp感染的重要靶点[5]。迄今为止,Hp感染的最好的治疗方案依然是使用抗生素,但Hp现已显示出对大部分抗生素的耐药性,同时抗生素的使用会引起一系列的副作用[6]。
研究表明,乙醇摄入与Hp感染具有一定的关系,而酱香型白酒中除乙醇外富含醛类物质(肉桂醛、辛醛、3-呋喃甲醛,2-噻吩甲醛等)[1],这些醛类物质(Aldehydes, ALDs)是否具有抑制Hp感染的作用的相关报道很少。因此,本文将酱香型白酒中的生物活性物质及醛类化合物体外抗Hp活性及降低Hp对胃黏膜上皮细胞损伤活性进行评价,并对潜在的机制进行研究。
1 材料与方法
1.1 材料与试剂
Hp标准菌株为Sydney Strain 1(SS1)H.pylori标准菌株,深圳大学医学院病原微生物系惠赠。胃上皮GES-1细胞株(ATCC,美国),胎牛血清(FBS)(Hyclone公司,美国),青-链霉素(HyClone公司,美国),PBS(广州瑞舒生物科技有限公司,中国),RPMI 1640培养基(HyClone公司,美国),NO、ROS、IL-8、IL-1β、IL-6等试剂盒均购于碧云天生物科技有限公司,CCK-8试剂(同仁公司,日本),Cag A和VacA抗体(Santa Cruz Biotechnology公司,美国),哥伦比亚琼脂、布氏肉汤(Oxoid,英国),RPMI 1640(Hyclone,美国)。酱香型白酒(Moutai-flavour liquor,MTL)(购于贵州茅台集团,贵州)。酱香型白酒中生物活性成分(Bio-active compounds in Moutai-flavour liquor, BAC)参考文献方法提取获得。酱香型白酒中醛类化合物(Aldehydes reported in Moutai flavour liquor, ALDs),标准品购于阿拉丁试剂有限公司[7]。
1.2 仪器
三菱C-31厌氧培养盒(三菱,日本);恒温培养箱、超净化工作台(上海实验仪器厂);超净工作台(SW-CJ-IC型,苏州);CO2培养箱(INCO2108型,Memmert,德国);酶标仪(TECAN infinite M200多功能酶标仪,德国);低温高速离心机(2K15型,Sigma公司,美國);PCR扩增仪(Bio-Rad PCR仪T100,美国)。
1.3 方法
1.3.1 ALD细胞毒性检测
GES-1细胞接种于96孔板中(5 000 cells/well),浓度为2.000、1.000、0.500、0.250、0.125、0.064、0.032及0.016 mg·mL-1的BAC、MTL、乙醇(Ethanol)及ALDs溶液加入96孔板中,培养24、48 h,CCK-8法检测细胞活力。
1.3.2 体外抑菌实验
将冻存的Hp复苏,接种于哥伦比亚琼脂固体培养基,置于37 ℃微需氧环境(体积分数为5%的O2,体积分数为10%的CO2,体积分数为85%的N2)中培养。72 h后转至布氏肉汤液体培养基,置于37 ℃微需氧环境(体积分数为0.05的O2,体积分数为0.10的CO2,体积分数为0.85的N2),在100 r·min-1的摇床上振荡,扩大培养。取用Hp时,将培养3 d的Hp菌株挑起一部分,用无菌生理盐水洗下后,配成布氏肉汤菌悬液,再用标准比浊管比浊,校正菌液浓度,使其菌液浓度相当于1×108 cfu·mL-1[8]。
用PBS作为溶剂溶解BAC、MTL、Ethanol及ALDs至终浓度为0.064 mg·mL-1。将培养的Hp菌液用PBS重悬至1×107 CFU·mL-1,取0.1 mL Hp的PBS混悬液加入配制好的BAC、MTL、Ethanol及ALDs溶液中,37 ℃振荡摇菌60 min。将振荡后的Hp菌液用PBS稀释10倍,取0.10 mL涂于哥伦比亚固体培养板上培养72 h,观察Hp生长情况,统计菌落数。
1.3.3 RT-PCR检测Hp毒力基因表达的变化
用PBS作为溶剂溶解BAC、MTL、Ethanol及ALD-22至终浓度为0.064 mg·mL-1。将培养的Hp菌液用PBS重悬至1×107 CFU·mL-1,取0.1 mL Hp的PBS混悬液加入配制好的BAC、MTL、Ethanol及ALDs溶液中,37 ℃振荡微氧孵育24 h,离心弃上清,用PBS冲洗3次后,使用RNA prep pure Cell/Bacteria Kit (TianGen公司,中国)分离总RNA[9]。cDNA的合成按试剂盒(SYBR@PrimeScript TM RT-PCR Kit)操作说明进行。引物如表1所示。
1.3.4 Western blotting检测
用PBS作为溶剂溶解BAC、MTL、Ethanol及ALD-22至终浓度为0.064 mg·mL-1。将培养的Hp菌液用PBS重悬至1×107 CFU·mL-1,取0.1 mL Hp的PBS混悬液加入配制好的BAC、MTL、Ethanol及ALD-22溶液中,37 ℃振荡微氧孵育24 h,离心弃上清,用PBS冲洗3次后,按细菌蛋白提取试剂盒(Solarbio公司,中国)说明提取细菌总蛋白,Western blotting检测细胞毒素A(Cag A)和空泡毒素A(Vac A)的蛋白表达情况[10]。
1.3.5 细胞活性及凋亡的检测
PBS作为溶剂溶解BAC、MTL、Ethanol及ALD-22至终浓度为0.064 mg·mL-1。将培养的Hp菌液用PBS重悬至1×107 CFU·mL-1,取0.1 mL Hp的PBS混悬液加入配制好的BAC、MTL、Ethanol及ALD-22溶液中,37 ℃振荡摇菌60 min。收集细菌,PBS洗2次,调节细菌终浓度为1×108 CFU。1×105 cells/mL胃上皮GES-1细胞铺于6孔板中培养24 h。不做处理设为空白对照组(Control);加入Hp为Hp损伤组(Hp);加入BAC处理的Hp为BAC组(BAC);加入MTL处理的Hp为MTL组(MTL);加入Ethanol处理的Hp为Ethanol组(Ethanol);加入ALD-22处理的Hp为ALD-22组(ALD-22);使Hp与GES-1细胞比例为100-1,GSE-1细胞培养48 h后,收集细胞,PBS洗涤:①CCK8方法检测细胞活性。②收集包括上清液漂浮细胞在内的全部细胞,1 000 r·min-1离心5 min,用预冷的PBS洗2次,按Annexin V-FITC/PI试剂盒使用说明流式细胞术检测细胞凋亡情况。③ELISA试剂盒检测细胞中NO、ROS、IL-8、IL-1β、IL-6含量。
1.4 数据处理
所有数据采用GraphPad Prism 8软件进行统计。
p<0.05定为具有显著性差异,结果均以Mean±SEM表示;对样本先进行方差齐性检验,方差齐时,用One-Way ANOVA检验,并进行组间的多重比较;方差不齐时,用非参数秩和检验,先用Kruskal-WallisHtest比较总的差异,再用Mann-Whitney U进行两组之间比较。
2 结果与分析
2.1 BAC对GES-1细胞的毒性作用
为了避免BAC及ALDs等对细胞活性造成的影响。因此,通过CCK-8方法检测了不同浓度的BAC、MTL、Ethanol及ALDs对GES-1细胞活性的影响。实验结果显示,当BAC、MTL、Ethanol及ALDs浓度低于0.064 mg·mL-1时,与空白对照组相比,细胞活性均无显著性差异(24,48 h,p>0.05),说明GES-1细胞未受到显著的损伤。基于此,接下来的实验,BAC、MTL、Ethanol及ALDs的浓度设置为0.064 mg·mL-1。
2.2 BAC抑制Hp菌落形成
实验结果显示,空白组Hp菌落生长良好,而BAC、MTL、Ethanol及ALDs处理后的Hp菌液转移至哥伦比亚固体培养基继续培养后Hp菌落数目有不同程度的减少(表2)。
其中,BAC、MTL及Ethanol组Hp菌落数为21.2、26.3、28.4个,是空白对照组(35.8个)的59.2%(p<0.05),73.4%(p<0.05),79.3%(p<0.05)。说明BAC、MTL、Ethanol处理对Hp的生长具有一定的抑制作用。此外,ALD-22(2-噻吩甲醛)对Hp生长抑制作用最强烈,ALD-22组Hp菌落数为20.7个菌落,是空白对照组的57.8%,Hp生长受到ALD-22显著抑制。
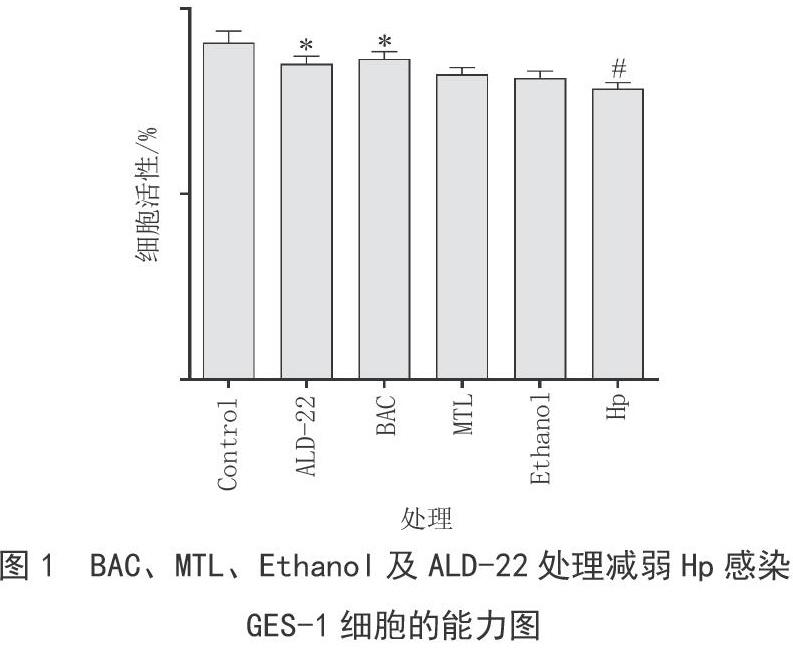
2.3 BAC抑制Hp对GES-1细胞的损伤
Hp感染损伤胃黏膜细胞会诱发胃黏膜炎症、胃癌等,因此,检测了BAC处理能否降低Hp对GES-1细胞的损伤能力。实验结果如图1所示,与Control组相比,Hp组中细胞活力下降13.7%(#p<0.05);而与Hp组相比,BAC、MTL、Ethanol及ALD-22实验组中细胞活力提高8.73%(p<0.05),4.22%,3.16%,7.34%(p<0.05)。推测Hp感染GES-1细胞会导致细胞损伤,细胞活力降低;而BAC、MTL、Ethanol及ALD-22预处理Hp会降低Hp感染GES-1细胞的能力。
细胞凋亡实验结果如图2所示,与空白对照组(7.21±0.54)%比较,Hp组GES-1细胞凋亡明显增加(16.9±1.31)%;而相比与Hp组,BAC、MTL、Ethanol及ALD-22组细胞凋亡率为[(9.96±0.99)%、(11.4±1.17)%、(13.6±1.32)%、(7.99±0.65)%],下降6.94%(p<0.05)、5.50%、3.30%及8.91%(p<0.05),其中BAC及ALD-22对Hp感染所致的GES-1细胞凋亡有明显抑制作用。
2.4 BAC抑制Hp感染诱发的GES-1细胞炎性细胞因子分泌
研究報道,Hp感染会损伤胃黏膜细胞,诱发炎性细胞因子分泌[11]。因此,检测了Hp感染对GES-1细胞中NO、ROS及IL-8、IL-1β、IL-6等炎性细胞因子分泌的影响。
实验结果如图3所示,为便于比较,将Control组中NO、ROS、IL-8、IL-1β、IL-6的含量设为1。与Control组比较,Hp感染使GES-1细胞中NO、ROS、IL-8、IL-1β、IL-6分泌增加338%(p<0.05)、511%(p<0.05)、202%(p<0.05)、351%(p<0.05)及288%(p<0.05),说明Hp感染诱发GES-1细胞炎性因子分泌、氧化应激,进而造成细胞损伤,使细胞活力降低、凋亡。而相比于Hp组,BAC组中NO、ROS、IL-8、IL-1β、IL-6分泌降低28.9%、40.1%、37.4%、18.8%及43.6%;ALD-22组中NO、ROS、IL-8、IL-1β、IL-6分泌降低23.3%、36.4%、41.6%、40.4%及41.5%;说明BAC、ALD-22预处理Hp降低了其损伤GES-1细胞的能力,使GES-1炎性因子分泌减少、氧化应激减弱。而MTL及Ethanol中NO、ROS、IL-8、IL-1β、IL-6含量变化不明显,推测MTL及Ethanol处理未能显著抑制Hp感染GES-1细胞的能力。
2.5 BAC抑制Hp毒力基因及蛋白的表达
BabA是Hp外膜蛋白基因,可特异性结合宿主细胞受体,赋予Hp持久定植能力;高毒力的Hp菌株具有细胞毒素相关基因(Cag A),参与Cag A转运和宿主的炎症反应[12];空泡细胞毒素A(Vac A)能够破坏细胞内吞作用、抑制免疫细胞导致免疫耐受和慢性感染等[13]。
通过RT-PCR检测BAC、MTL、Ethanol及ALD-22对Hp Bab A、Cag A及Vac A基因表达影响,结果如图4所示。BAC、MTL、Ethanol及ALD-22能够抑制Hp中外膜蛋白基因Bab A、细胞毒素基因A(Cag A)和空泡毒素基因A(Vac A)的转录。其中,ALD-22及BAC对Bab A、Cag A及Vac A基因表达抑制能力高于MTL及Ethanol组。相比于Hp空白对照组,ALD-22作用后,Bab A、Cag A及Vac A基因表达下降44.1%(p<0.05),68.7%(p<0.05),70.6%(p<0.05);而BAC作用后,Bab A、Cag A及Vac A基因表达下降31%(p<0.05),71%(p<0.05),73%(p<0.05)。Bab A、Cag A及Vac A编码的蛋白能够诱发炎症导致细胞损伤等,因此推测,BAC、ALD-22可通过抑制Hp相关基因的表达,减少Hp对GSE-1的定植及损伤。
Western Blotting进一步分析Hp中细胞毒素A(Cag A)和空泡毒素A(Vac A)的表达,结果如图5所示,BAC、ALD-22能够显著降低Hp中Cag A和Vac A的表达,与RT-PCR结果(图4)类似。据推测,BAC、ALD-22可能是通过抑制Hp中相关毒力基因的转录及毒力蛋白的表达,从而抑制Hp对胃上皮细胞的损伤。
3 讨论与结论
胃上皮细胞是胃肠道黏膜机械屏障的重要组成部分,而Hp的迁移与胃肠道黏膜通透性有着密切的关系。Hp感染人体首先是通过表达Bab A等外膜蛋白黏附在胃肠道黏膜细胞上,再通过表达Vac A和Cag A等蛋白诱发炎症和细胞损伤,进而增加胃肠道黏膜通透性,利于其迁移。本研究表明,酱香型白酒中的生物活性物质可抑制Hp对GSE-1细胞的黏附及因Hp感染造成的细胞活力降低及凋亡。进一步研究表明酱香型白酒中的生物活性物质(如醛类化合物)可能是通过抑制Hp相关毒力基因Bab A、Vac A和Cag A的转录,及Vac A、Cag A蛋白的表达发挥作用的。此外,大量研究显示酗酒会损伤胃肠道黏膜,酱香型白酒中的生物活性物质虽具有抑制Hp对胃粘膜细胞损伤的活性,但仍不建议酗酒。
参考文献:
[1]Zhu S K,Lu X,Ji K L,et al.Characterization of flavor compounds in Chinese liquor Moutai by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Analytica Chimica Acta,2007,597(2):340-348.
[2]王川南,吴天祥,雷露.不同年份酱香型白酒对小鼠抗疲劳及肝损伤试验的研究[J].酿酒科技,2019(10):36-40.
[3]隋昕珂.332例老年人幽门螺杆菌感染根除治疗的随访研究[D].北京:中国人民解放军医学院,2012.
[4]杜文礼,张亚历,赖卓胜.胃息肉与HP感染、粘膜炎症及粘膜萎缩相关性的研究[J].现代消化及介入诊疗杂志,2000(2):8-11.
[5]朱俊谕,向一郎,李琳,等.与幽门螺杆菌HpaA定植相關的功能性亲和肽的筛选[J].中国病原生物学杂志,2013,8(7):581-585.
[6]张万岱,徐智民.Hp耐药的现状[J].中华消化杂志,2003,23(9):556-557.
[7]罗强,刘杰,刘志刚.酱香型白酒中吡嗪类物质体外抗炎作用研究[J].中国酿造,2019,38(7):156-160.
[8]聂佳莹,唐磊,杨致邦,等.中药体外抗幽门螺杆菌试验方法研究[J].中国病原生物学杂志,2013,8(3):255-257.
[9]佘菲菲,丁惠,林建银,等.球形与螺旋形幽门螺杆菌基因表达差异的研究[J].中国微生态学杂志,2003(3):7-9,12.
[10]王晓刚,孟翔凌,徐阿曼,等.胆色素结石患者胆道系统幽门螺杆菌研究[J].中华消化杂志,2007,27(6):397-399.
[11]孙燕,刘南植,赖远全,等.幽门螺杆菌相关胃炎中细胞因子分泌与Fas抗原的原位关系研究[J].临床内科杂志,2004(3):177-179.
[12]Cendron L,Couturier M,Angelini A,et al.The Helicobacter pylori CagD (HP0545, Cag24) Protein Is Essential for CagA Translocation and Maximal Induction of Interleukin-8 Secretion[J].Journal of Molecular Biology,2009,386(1):204-217.
[13]Tabel G,Hoa N T,Tarnawski A,et al.Helicobacter pylori infection inhibits healing of the wounded duodenal epithelium in vitro[J].Journal of Laboratory and Clinical Medicine,2003,142(6):421-430.
