肾脏过表达GJB1基因动物模型的构建
2020-11-23陈柳冰陈潮金黑子清罗晨芳
陈柳冰?陈潮金?黑子清?罗晨芳

【摘要】目的 構建小鼠过表达GJB1基因的重组腺相关病毒(rAAV)载体,建立一种小鼠肾脏过表达GJB1基因的动物模型。方法 采用PCR扩增制备小鼠GJB1基因片段,利用基因重组技术构建含GJB1基因的重组质粒,将携带小鼠GJB1基因的腺相关病毒(AAV)穿梭质粒与pAAV-RC、pHelper共转染AAV-293 细胞,通过选择培养基筛选出同源重组的阳性克隆获得rAAV。将30只成年C57BL/6J雄性小鼠随机分为5组各6只(W1组、W2组、W3组、W4组及空白对照组),经尾静脉将rAAV注射到W1 ~ W4组小鼠体内,分别于注射后1周、2周、3周、4周取其心脏、肝脏、肾脏组织行PCR检测GJB1 mRNA的表达情况,并经石蜡包埋切片后采用免疫组织化学法检测Cx32的表达。结果 含GJB1基因的rAAV被成功构建。随着注射后时间的延长,小鼠肾脏组织GJB1基因转录及Cx32蛋白表达强度均逐渐增强,与空白对照组比较差异有统计学意义(P均 < 0.05),而其他器官(肝脏、心脏)GJB1基因表达未见明显增强(P均 > 0.05)。
结论 采用rAAV技术可成功构建肾脏过表达GJB1基因的小鼠模型,这对深入研究GJB1基因在肾损伤中的作用机制、评估以GJB1为治疗靶点的药物疗效等具有重要的科学价值和临床意义。
【关键词】GJB1基因;重组腺相关病毒;急性肾损伤;小鼠模型
Establishment of mouse models of renal overexpression of GJB1 gene Chen Liubing, Chen Chaojin, Hei
Ziqing, Luo Chenfang. Department of Anesthesiology, the Third Affiliated Hospital of Sun Yat-sen University, Guang-zhou 510630, China
Corresponding author, Luo Chenfang, E-mail: 15975604518@ 139. com
【Abstract】Objective To construct a recombinant adeno-associated virus vector (rAAV) overexpressing GJB1 gene, and to establish a mouse model overexpressing GJB1 gene in the kidney. Methods GJB1 gene fragment was amplified by PCR. Recombinant plasmids containing GJB1 gene were constructed by gene recombination technology. AAV carrying GJB1 gene was co-transfected with pAAv-RC and pHelper into AAV-293 cells. Homologous recombinant postive clones were screened to obtain rAAV. Thirty adult male C57BL/6J mice were randomly divided into five groups (W1, W2, W3, W4 and blank control groups), six in each group. rAAV was injected into the mice in the W1-W4 groups through the tail vein. The heart, liver and kidney tissues were taken at 1-, 2-, 3- and 4-week after injection, respectively. The expression level of GJB1 mRNA ws quantitatively measured by PCR. The expression level of Cx32 mRNA was detected by immunohistochemistry after paraffin embedded sections. Results The rAAV containing GJB1 gene was successfully constructed. With the prolonged time after injection, the GJB1 gene transcription and expression intensity of GJB1 protein in renal tissues were gradually increased, which significantly differred from those in the blank control group (both P < 0.05). However, the expression intensity of GJB1 gene in other organs, such as liver and heart, did not increase significantly (all P > 0.05). Conclusions The mouse model with kidney-specific over-expression of GJB1 gene can be successfully constructed by the rAAV technology, which has important scientific value and clinical significance for in-depth study of the mechanism of GJB1 gene in renal injury and for the evaluation of drug efficacy with GJB1 as the therapeutic target.
【Key words】GJB1 gene;Recombinant adeno-associated virus;Acute kidney injury;Mouse model
目前,肾脏疾病已成为危害民众健康、耗费巨大卫生资源的全球性的公共健康问题之一,其治疗也成为了目前世界卫生领域迫切需要解决的一个难题。急性肾损伤(AKI)的发病率和病死率近几十年仍居高不下,可增加慢性肾脏病(CKD)的发病风险,具有潜在恶化性,甚至会进展为终末期肾病(ESRD)[1-2]。較多原因可引发AKI,以缺血再灌注损伤最为常见,但目前AKI的具体发病机制尚未完全阐明,而且缺乏有效的防治手段[3]。因此,深入探讨AKI的机制,寻找减轻肾损伤的方法,是目前围术期器官功能保护领域亟待解决的重要问题。
Connexin (Cx)蛋白是一种特殊的通道蛋白,由其组成的缝隙连接(GJ)是细胞间直接通讯的重要方式,其传递的信号参与和介导了细胞的增殖、分化、迁移、凋亡等一系列过程,对于各种生命活动具有重要意义[4-5]。由Cx32蛋白组成的GJ不仅参与了肾素的分泌、肾血流量的控制以及肾小球滤过率等多种生理功能的调节,而且与肾脏缺血再灌注损伤后的肾脏病理性重构密切相关[6]。我们在前期研究中已通过多个AKI的动物模型发现,围术期AKI严重程度与Cx32蛋白的表达变化高度一致,抑制Cx32蛋白的功能后,肾损伤的程度明显减轻[7-9]。这一结果提示我们,由Cx32所介导的“旁细胞效应”在围术期AKI的过程中可能起至关重要的作用。为了更好地探究GJB1/Cx32在肾脏疾病中的作用,我们团队已经构建了GJB1全基因敲除小鼠模型,为深入研究肾损伤的发病机制、临床治疗提供了重要的试验动物模型。但是,全身性的基因敲除可能引起全身性GJ功能失调、潜在的MODS,难以特异性再现肾脏GJB1基因参与AKI的过程和相应细胞病理变化等缺陷。
腺相关病毒(AAV)是一种安全、持久、高效、高特异性的基因操作工具,重组腺相关病毒(rAAV)技术已被广泛应用于多种基因转导和基因治疗中[10]。为了更好地阐明GJB1基因在AKI及CKD中的作用,我们团队初次构建了肾脏高表达GJB1基因的小鼠模型, 并在此基础上通过一系列改进,摸索出了更好的给药剂量以及注射方法,对深入研究GJB1基因在肾损伤中的作用及机制、评估以GJB1/Cx32为靶点的治疗药物等的疗效具有重要的科学价值和临床意义。
材料与方法
一、材 料
1. 实验动物
30只SPF级8 ~ 10周龄的雄性 C57BL/6小鼠(合格证编号44007200051845)由广东省医学实验动物中心提供[SCXK(粤)2013-0002],体质量为20 ~ 25 g。动物模型的构建及标本的采集均在中山大学附属第三医院内完成[SYXK (粤) 2017-0083]。动物按照每笼6只群养,饲养环境温度为24 ~ 26℃,相对湿度为60%,光暗间隔为12 h,允许动物自由摄食饮水。本研究方案经中山大学实验动物伦理委员会审查批准。
2. 试剂及仪器
主要试剂包括:磷酸盐缓冲液(PBS)及DMEM不完全高糖培养液(江苏凯基公司),胎牛血清(Gibco公司),质粒pAAV-GV388、pAAV-RC、pHelper、细胞系AVV-293(上海吉凯基因科技有限公司),1 kp DNA ladder Marker(Fermentas公司),250 bp DNA ladder Marker(捷瑞公司),琼脂糖(赛百盛公司),In-Fusion? PCR 克隆试剂盒(Clontech公司),Taq聚合酶(SinoBio公司),dNTP(Takara公司),限制性内切酶(NEB公司),质粒抽提试剂盒(Promega公司),DNA凝胶回收试剂盒(天根生化公司),RNA提取试剂盒(赛默飞世尔科技有限公司),PCR引物(捷瑞公司),其中GJB1基因引物1序列为5-GGAGGTAGTGGAATGGATCCCGCCACCATGAACTGGACAGGTCTATACAC-3,引物2序列为5-TCACCATGGTGGCGGGATCGCAGGCTGAGCATCGGTCGCTC-3。主要仪器包括:PCR仪(Applied Biosystems公司),稳压DNA电泳仪(BioRad公司),高速离心机(日立公司),凝胶成像仪(天能公司),Gilson移液器(吉尔森公司),细菌摇床(华利达实验设备公司),细菌培养箱(上海一恒科学仪器有限公司)。
二、方 法
1. rAAV的构建与筛选
根据小鼠GJB1 (NM_001302496) 基因cDNA的序列,设计合成含有同源重组序列及酶切位点的扩增引物序列:GJB1(41304-1)-P1,5-GGA GGTAGTGGAATGGATCCCGCCACCATGAACTGGACAGGTCTATACAC-3;GJB1(41304-1)-P2,5-TCACCATGGTGGCGGGATCGCAGGCTGAGCATCGGTCGCTC-3。利用PCR仪进行PCR反应扩增GJB1 DNA片段。PCR产物大小为895 bp。利用Northern blot检测PCR扩增得到的产物。利用 BamHⅠ消化AAV载体GV388获得线性化载体,利用Northern blot检测酶切结果。参照GV388载体说明书构建反应体系,完成GV388线性载体与GJB1基因片段的环化,构建GJB1基因过表达AAV载体,并利用Northern blot检测构建后的线性化表达载体,引物序列分别为:Globin-F,5-ATTCTGAGTCCAAGCTAGGC-3;pEG FP-N-3,5-CGTCGCCGTCCAGCTCGACCAG-3。
2. GJB1基因过表达AAV载体转染与筛选
将3×106 个AAV-293 细胞接种到培养皿中,并加入10 ml含10% 胎牛血清的DMEM培养基,置于37℃含5% 二氧化碳的培养箱中培养。当细胞融合达到70% ~ 80% 时,用提取的含GJB1基因的AAV质粒载体同 pHelper、pAAV-RC共转染进 AAV-293细胞,培养72 h后收集带有GJB1基因的AAV。
3. AAV 病毒的浓缩及纯化
收集成功转染的细胞与其培养基一同高速离心,去除上清液后用 1 ml PBS重悬细胞。重悬后的细胞在干冰乙醇浴和37℃水浴中反复冻融4次。凍融结束后以9708转/分离心,并将上清液转移至新离心管中。加入40% 的聚乙二醇8000后于冰上放置 2 h,以4854转/分离心 30 min并去除上清液。用PBS重悬沉淀物。以5317转/分离心 30 min后将上清液移至新的EP管中。加入Benzonase 核酸酶37℃ 孵育 30 min。过滤后往滤液中添加氯化铯(CsCl)直到密度为1.41 g/ml(折射率为1.372)并振荡使之充分溶解。将样品置于超速离心管中以41 200转/分离心24 h,形成密度梯度。收集不同密度的样品并进行滴度测定。
4. 超滤脱盐及保存
于Amicon-15 超滤装置中加入4 ml去离子水,将病毒液加入超滤装置中,并加入PBS使其总体积达到4 ml。以3760转/分离心10 min,直到最终体积为250 μl,加入PBS 稀释浓缩后的病毒使其体积为4 ml。重复上述过程3次,使最终体积约为 0.5 ml。往病毒浓缩液中加入甘油使其浓度为5%,分装保存于-80℃冰箱中。
5. 动物实验分组及处理
将30只小鼠随机分为5组,每组6只,分别为空白对照组、W1组、W2组、W3组、W4组。取 1×1012 v.g的rAAV 2/9-CMV-eGFP稀释到200 μl
生理盐水中,经尾静脉将rAAV注射到小鼠体内,分别于注射后1周(W1组)、2周(W2组)、3周(W3组)、4周(W4组)后用1%戊巴比妥钠70 mg/kg腹腔注射进行麻醉,然后处死小鼠,取其心脏、肝脏、肾脏组织,采用PCR检测GJB1的mRNA表达情况,并经石蜡包埋切片后行免疫组织化学检查(免疫组化)检测Cx32的表达。通过免疫组化和PCR从转录和翻译水平来评价造模是否成功。
三、统计学处理
采用SPSS 20.0处理数据。计量资料用表示,多组间的比较采用单因素方差分析,各组与对照组的多重比较采用 Dunnett-t检验,P < 0.05为差异有统计学意义。
结果
一、GJB1基因rAAV的构建
1. GJB1基因的克隆合成
成功克隆合成小鼠GJB1基因片段,该DNA片段长度为895 bp。PCR产物经1%琼脂糖电泳可清晰显示,见图1A。
2. GJB1基因rAAV载体构建及测定结果
GV388载体在多克隆位点经过酶切后得到线性结构,构建重组载体。经1%琼脂糖电泳可清晰显示,见图1B。在正确酶切的线性载体中加入GJB1基因片段及引物进行PCR,其后得到的产物经1%琼脂糖电泳可清晰显示阳性克隆测序结果,其中阳性转化子PCR产物大小为1120 bp,阴性转化子PCR产物大小为259 bp,见图1C。
3. GJB1基因rAAV包装及浓度测定
GJB1基因rAAV载体转染AAV-293 细胞48 h后可观察到细胞形态学发生变化:细胞逐渐变圆并从培养盘上脱落。与阴性对照组相比,培养基的颜色由红色变为橙色或黄色。浓缩收集病毒质粒,检测其浓度为1.26×1013 v.g/ml。
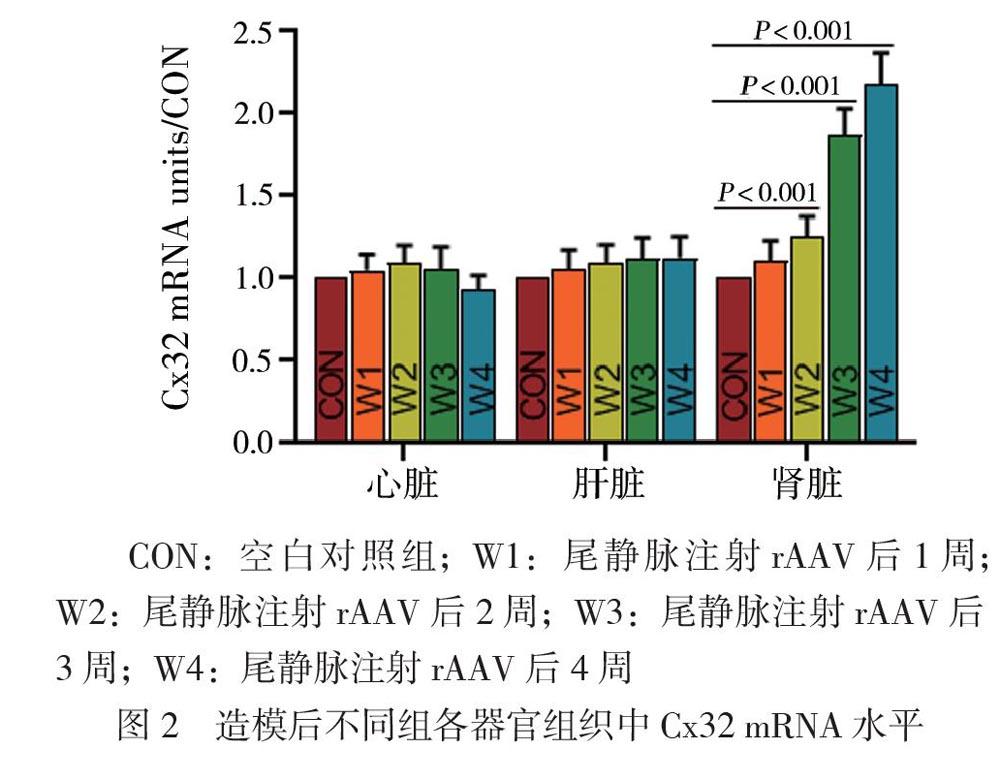
二、GJB1基因在小鼠肾脏表达明显升高
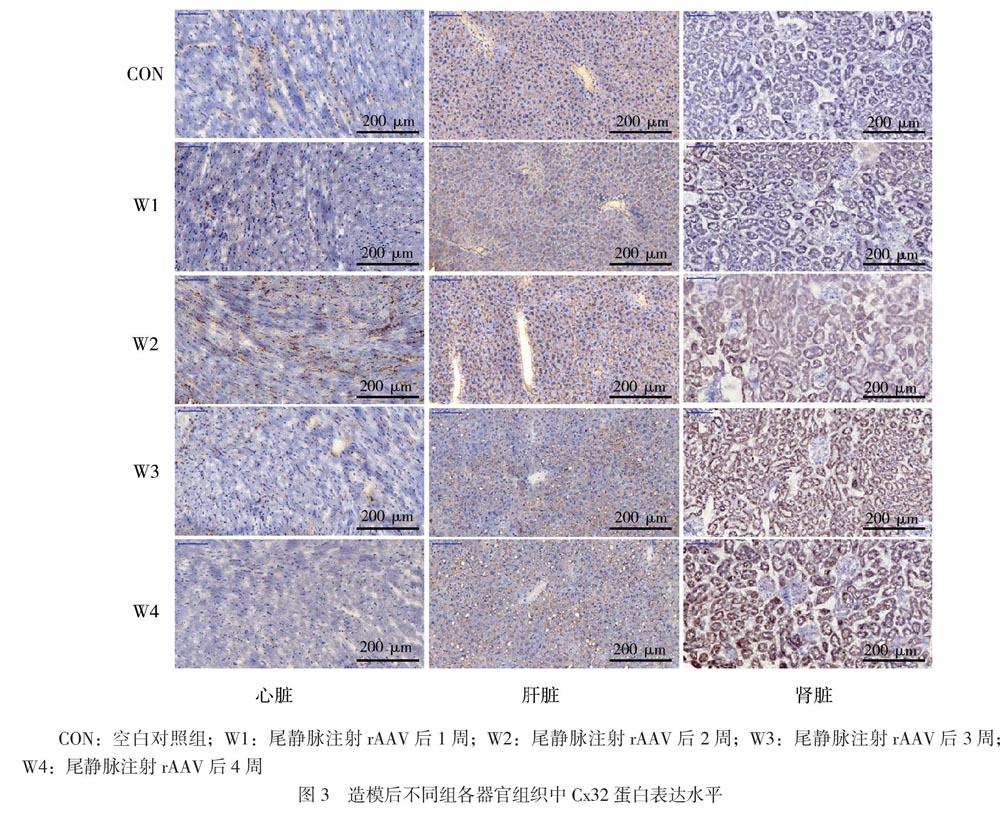
经鼠尾静脉注射后,随着时间延长,小鼠肾脏组织Cx32 mRNA表达逐渐增强,在肾脏中不同组相互比较的F = 86.570、P < 0.001。而其他器官(肝脏、心脏)GJB1基因表达未见明显增强,在肝脏中不同组相互比较的F = 1.250、P = 0.316;在心脏中不同组相互比较的F = 2.609、P = 0.060,见图2。W1组与W2、W3、W4组肾脏Cx32 mRNA表达比较的P值分别为0.603、0.047、0.001、0.001。免疫组化结果与qPCR结果一致,提示Cx32主要在近端肾小管中过表达,在肝脏及心脏中未见明显过表达,见图3。
讨论
目前,对肾脏中Cx蛋白的研究正逐步渗透到各种肾脏疾病中。以细胞间GJ通讯和Cx作为靶点治疗在AKI、肾细胞癌等肾脏疾病的研究还有较大的空间[11]。我们团队在前期研究中主要针对肾脏中的GJ通道进行探讨,已经构建的GJB1基因全身性敲除小鼠和体外细胞实验进一步验证了GJB1基因是有治疗价值的潜在靶点[8]。然而,考虑到同一基因在不同组织中的表达与功能不同,为避免全身各脏器高表达Cx32蛋白带来的不良反应,构建一种肾脏高表达GJB1基因的模型显得极有意义。
AAV是一种属于微小病毒科的无包膜单链线状DNA 病毒,作为质粒穿梭载体具有安全性能高、免疫原性低、物理性质稳定和宿主范围广泛等优点,目前已被广泛应用于基因转导和基因治疗[10]。至今,已发现包括AAV1-9、DJ、DJ/8、Rh10等在内的12种不同血清型的AAV,而且不同的血清型对不同的脏器有不同程度的识别及感染能力[12-17]。
多项研究表明,运用rAAV9作为载体,能够实现在肾脏的基因编辑[14, 18-19]。同时,rAAV9已被证实对小鼠肾脏具有较高的特异性识别能力和转染效率[20-21]。与上述研究结果一致的是,我们选择rAAV9作为载体,AAV-293 细胞用于rAAV9的包装与扩增,获得了相当高的AAV滴度,并最终在肾脏中获得了GJB1基因的高表达。然而,Ikeda等[22]报道利用AAV8载体能将基因高效转染到肾间充质细胞内,但AAV9对肾小管细胞的转染效率较低。通过分析我们发现,这可能与2个实验在AAV9的剂量选择、动物模型、观察时间等方面明显不同有关,Ikeda等采用的是1×1011 GCs的AAV2/9,用于单侧输尿管梗阻的模型小鼠,并在转染3周后观察转染效率;而我们采用的是1×1012 v.g的AAV9载体,用于双侧肾脏缺血再灌注模型小鼠,并在转染4周后观察转染效率。另外,我们选择的目的基因GJB1仅在近端肾小管上皮细胞中广泛表达,在肾小球及肾脏髓质中无明显表达。以上这些不同因素均可能是我们利用rAAV9载体能够实现稳定转染GJB1基因的原因。
至今研究者們已在哺乳动物中发现21种Cx蛋白,其中Cx26、Cx30.3、Cx31、Cx32、Cx37、Cx40、Cx43、Cx45、Cx46等已被证实在肾脏组织中表达。其中,GJB1/Cx32在肾脏组织中的表达高达90%[23]。GJB1已被报道在肝脏、心脏中广泛表达[24-26]。为了验证rAAV9对肾脏的特异性,我们收集了肝脏、心脏组织,并通过qPCR和免疫组化检测了GJB1/Cx32基因和蛋白水平的变化,结果显示肝脏、心脏组织中的Cx32基因和蛋白水平无明显变化。此外,随着给药时间的延长,rAAV9在肾脏中的作用越来越明显,提示rAAV9对肾脏具有较好的特异性,这与Schievenbusch等[20]和Picconi等[21]的研究结论类似。
目前,提高靶向肾小球给药治疗效率仍存在很大困难[27]。寻找一种安全高效的载体直接靶向肾小管是治疗肾脏疾病新的方向。Atherton等(2009年)的研究表明以近端肾小管细胞为靶点的药物可显著提高治疗肾小管纤维化药物的浓度和疗效,这提示了直接靶向肾小管进行肾脏疾病的治疗是一种可行的且具有巨大前景的方法[28]。综上所述,重组GJB1基因载体在与Cx32介导的AKI相关研究中具有一定的应用前景,该方法可供肾脏研究者借鉴与参考,这对深入研究GJB1基因在肾损伤中的作用机制、评估以GJB1为治疗靶点的药物疗效等具有重要的科学价值和临床意义。
参 考 文 献
[1] Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R, Ahn SY, Alvarado M, Anderson HR, Anderson LM, Andrews KG, Atkinson C, Baddour LM, Barker-Collo S, Bartels DH, Bell ML, Benjamin EJ, Bennett D, Bhalla K, Bikbov B, Bin Abdulhak A, Birbeck G, Blyth F, Bolliger I, Boufous S, Bucello C, Burch M, Burney P, Carapetis J, Chen H, Chou D, Chugh SS, Coffeng LE, Colan SD, Colquhoun S, Colson KE, Condon J, Connor MD, Cooper LT, Corriere M, Cortinovis M, de Vaccaro KC, Couser W, Cowie BC, Criqui MH, Cross M, Dabhadkar KC, Dahodwala N, De Leo D, Degenhardt L, Delossantos A, Denenberg J, Des Jarlais DC, Dharmaratne SD, Dorsey ER, Driscoll T, Duber H, Ebel B, Erwin PJ, Espindola P, Ezzati M, Feigin V, Flaxman AD, Forouzanfar MH, Fowkes FG, Franklin R, Fransen M, Freeman MK, Gabriel SE, Gakidou E, Gaspari F, Gillum RF, Gonzalez-Medina D, Halasa YA, Haring D, Harrison JE, Havmoeller R, Hay RJ, Hoen B, Hotez PJ, Hoy D, Jacobsen KH, James SL, Jasrasaria R, Jayaraman S, Johns N, Karthikeyan G, Kassebaum N, Keren A, Khoo JP, Knowlton LM, Kobusingye O, Koranteng A, Krishnamurthi R, Lipnick M, Lipshultz SE, Ohno SL, Mabweijano J, MacIntyre MF, Mallinger L, March L, Marks GB, Marks R, Matsumori A, Matzopoulos R, Mayosi BM, McAnulty JH, McDermott MM, McGrath J, Mensah GA, Merriman TR, Michaud C, Miller M, Miller TR, Mock C, Mocumbi AO, Mokdad AA, Moran A, Mulholland K, Nair MN, Naldi L, Narayan KM, Nasseri K, Norman P, ODonnell M, Omer SB, Ortblad K, Osborne R, Ozgediz D, Pahari B, Pandian JD, Rivero AP, Padilla RP, Perez-Ruiz F, Perico N, Phillips D, Pierce K, Pope CA, 3rd, Porrini E, Pourmalek F, Raju M, Ranganathan D, Rehm JT, Rein DB, Remuzzi G, Rivara FP, Roberts T, De Leon FR, Rosenfeld LC, Rushton L, Sacco RL, Salomon JA, Sampson U, Sanman E, Schwebel DC, Segui-Gomez M, Shepard DS, Singh D, Singleton J, Sliwa K, Smith E, Steer A, Taylor JA, Thomas B, Tleyjeh IM, Towbin JA, Truelsen T, Undurraga EA, Venketasubramanian N, Vijayakumar L, Vos T, Wagner GR, Wang M, Wang W, Watt K, Weinstock MA, Weintraub R, Wilkinson JD, Woolf AD, Wulf S, Yeh PH, Yip P, Zabetian A, Zheng ZJ, Lopez AD, Murray CJ, AlMazroa MA and Memish ZA. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet,2012,380(9859):2095-2128.
[2] Chawla LS and Kimmel PL. Acute kidney injury and chronic kidney disease: an integrated clinical syndrome. Kidney Int,2012,82(5):516-524.
[3] 吳永东, 汪华林, 林蓉宇, 蒋强,袁春玲. 肾胺酶预防大鼠缺血再灌注致急性肾损伤的机制研究. 新医学, 2016, 47(1):17-21.
[4] Maeda S, Nakagawa S, Suga M, Yamashita E, Oshima A, Fujiyoshi Y and Tsukihara T. Structure of the connexin 26 gap junction channel at 3.5 A resolution. Nature,2009,458(7238):597-602.
[5] Roell W, Lewalter T, Sasse P, Tallini YN, Choi BR, Breitbach M, Doran R, Becher UM, Hwang SM, Bostani T, von Maltzahn J, Hofmann A, Reining S, Eiberger B, Gabris B, Pfeifer A, Welz A, Willecke K, Salama G, Schrickel JW, Kotlikoff MI and Fleischmann BK. Engraftment of connexin 43-expressing cells prevents post-infarct arrhythmia. Nature,2007,450(7171):819-824.
[6] Saunders MM, You J, Zhou Z, Li Z, Yellowley CE, Kunze EL, Jacobs CR and Donahue HJ. Fluid flow-induced prostaglandin E2 response of osteoblastic ROS 17/2.8 cells is gap junction-mediated and independent of cytosolic calcium. Bone, 2003,32(4):350-356.
[7] Hei Z, Zhang A, Wei J, Gan X, Wang Y, Luo G and Li X. Lipopolysaccharide effects on the proliferation of NRK52E cells via alternations in gap-junction function. J Trauma Acute Care Surg,2012,73(1):67-72.
[8] Chen C, Yao W, Wu S, Zhou S, Ge M, Gu Y, Li X, Chen G, Bellanti JA, Zheng SG, Yuan D and Hei Z. Crosstalk between connexin32 and mitochondrial apoptotic signaling pathway plays a pivotal role in renal ischemia reperfusion-induced acute kidney injury. Antioxid Redox Signal,2019,30(12):1521-1538.
[9] Luo C, Yuan D, Li X, Yao W, Luo G, Chi X, Li H, Irwin MG, Xia Z and Hei Z. Propofol attenuated acute kidney injury after orthotopic liver transplantation via inhibiting gap junction composed of connexin 32. Anesthesiology,2015,122(1):72-86.
[10] Drouin LM, Agbandje-McKenna M. Adeno-associated virus structural biology as a tool in vector development. Future Virol,2013,8(12):1183-1199.
[11] Hills CE, Siamantouras E, Smith SW, Cockwell P, Liu KK and Squires PE. TGFβ modulates cell-to-cell communication in early epithelial-to-mesenchymal transition. Diabetologia,2012,55(3):812-824.
[12] Gao D, Wang S, Lin Y and Sun Z. In vivo AAV delivery of glutathione reductase gene attenuates anti-aging gene klotho deficiency-induced kidney damage. Redox Biol,2020,37:101692.
[13] Ye GJ, Scotti MM, Thomas DL, Wang L, Knop DR and Chulay JD. Herpes simplex virus clearance during purification of a recombinant adeno-associated virus serotype 1 vector. Hum Gene Ther Clin Dev, 2014,25(4):212-217.
[14] Rocca CJ, Ur SN, Harrison F and Cherqui S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Ther,2014,21(6):618-628.
[15] Tian F, Wang L, Arias A, Yang M, Sharifi BG and Shah PK. Comparative antiatherogenic effects of intravenous AAV8- and AAV2-mediated ApoA-IMilano gene transfer in hypercholesterolemic mice. J Cardiovasc Pharmacol Ther,2015,20(1):66-75.
[16] Saito S, Ohno SI, Harada Y, Oikawa K, Fujita K, Mineo S, Gondo A, Kanno Y, Kuroda M. rAAV6-mediated miR-29b delivery suppresses renal fibrosis. Clin Exp Nephrol,2019,23(12):1345-1356.
[17] Srivastava A. Adeno-associated virus-mediated gene transfer. J Cell Biochem,2008,105(1):17-24.
[18] Wu Z, Asokan A, Samulski RJ. Adeno-associated virus serotypes: vector toolkit for human gene therapy. Mol Ther,2006,14(3):316-327.
[19] Luo X, Hall G, Li S, Bird A, Lavin PJ, Winn MP, Kemper AR, Brown TT and Koeberl DD. Hepatorenal correction in murine glycogen storage disease type I with a double-stranded adeno-associated virus vector. Mol Ther,2011,19(11):1961-1970.
[20] Schievenbusch S, Strack I, Scheffler M, Nischt R, Coutelle O, H?sel M, Hallek M, Fries JW, Dienes HP, Odenthal M and Büning H. Combined paracrine and endocrine AAV9 mediated expression of hepatocyte growth factor for the treatment of renal fibrosis. Mol Ther,2010,18(7):1302-1309.
[21] Picconi JL, Muff-Luett MA, Wu D, Bunchman E, Schaefer F and Brophy PD. Kidney-specific expression of GFP by in-utero delivery of pseudotyped adeno-associated virus 9. Mol Ther Methods Clin Dev,2014,1:14014.
[22] Ikeda Y, Sun Z, Ru X, Vandenberghe LH and Humphreys BD. Efficient gene transfer to kidney mesenchymal cells using a synthetic adeno-associated viral vector. J Am Soc Nephrol, 2018,29(9):2287-2297.
[23] 陈潮金, 姚伟锋, 黑子清. 缝隙连接在肾脏疾病中的作用研究进展. 实用医学杂志,2017,33(13):2239-2242.
[24] Anyukhovsky EP, Sosunov EA, Kryukova YN, Prestia K, Ozgen N, Rivaud M, Cohen IS, Robinson RB and Rosen MR. Expression of skeletal muscle sodium channel (Nav1.4) or connexin32 prevents reperfusion arrhythmias in murine heart. Cardiovasc Res,2011,89(1):41-50.
[25] Wang R, Huang F, Chen Z,Li S. Downregulation of connexin 32 attenuates hypoxia/reoxygenation injury in liver cells. J Biochem Mol Toxicol,2015,29(4):189-197.
[26] Asamoto M, Hokaiwado N, Murasaki T and Shirai T. Connexin 32 dominant-negative mutant transgenic rats are resistant to hepatic damage by chemicals. Hepatology,2004,40(1):205-210.
[27] Liu CP, Hu Y, Lin JC, Fu HL, Lim LY and Yuan ZX. Targeting strategies for drug delivery to the kidney: From renal glomeruli to tubules. Med Res Rev, 2019, 39(2):561-578.
(收稿日期:2020-05-28)
(本文編辑:洪悦民)
