水稻抗性蛋白OsRRK1 抗褐飞虱机理分析
2020-11-23马银花李萍芳董文静易松望杨芳杜波金晨钟
马银花 李萍芳 董文静 易松望 杨芳 杜波 金晨钟,*
(1 湖南人文科技学院 湖南省农田杂草防控技术与应用协同创新中心/农药无害化应用省高校重点实验室, 湖南 娄底 417000;2 武汉大学 生命科学学院 杂交水稻国家重点实验室, 武汉 430072; *通信联系人, E-mail: hnldjcz@sina.com)
水稻(Oryza sativaL.)是世界三大粮食作物之一,世界上超过50%的人口以水稻为主食[1]。水稻约占我国粮食总产量的40%,它的高产、稳产是我国粮食安全的重要保证。然而,水稻在生长发育的各个阶段,都会受到各种外界环境因素的胁迫,其中病原菌和昆虫就是主要的生物类环境因素。据报道,已发现几百种昆虫可以取食水稻。褐飞虱(Nilaparvata lugens)就是其中危害最严重的一类害虫,从 19 世纪开始,在我国频繁暴发,严重危害水稻生产,可以造成水稻产量的大幅下降[2],尤其是进入 21 世纪,整个亚洲水稻产区飞虱暴发的频率和规模有逐渐加大的趋势[3],褐飞虱被认为是影响水稻生产的最严重的害虫。据统计,2008 年我国褐飞虱发生面积在2500 万hm2以上[4],褐飞虱暴发对水稻生产安全造成巨大威胁[5]。大量使用化学农药会导致农药残留、环境污染、生产成本增加,甚至导致褐飞虱的“再猖獗”,而培育和种植抗虫品种才是世界上公认的防治病虫害最经济、最安全和最有效的手段。
水稻在与昆虫长期共存的过程中进化出了不受昆虫危害的抗性保护机制,而“水稻—褐飞虱”模型被认为是一种很好的研究“植物—昆虫”相互作用和协同进化的模型[6-7]。因此,研究水稻中具有对褐飞虱广谱抗性基因的抗性机理及分子防御机制将促进我们对“植物—昆虫”相互作用的分子机制的理解,对其基因功能、抗性作用以及防御调控系统的研究,为抗虫水稻种质创新和新品种选育提供重要理论指导。
目前,已有30 多个水稻抗褐飞虱基因被鉴定,其中8 个抗褐飞虱基因被克隆,分别是Bph14[8]、Bph9[9]、Bph610]、Bph26[11]、Bph29[12]、Bph18[13]、Bph32[14]和Bph3[15](Bph15[16])。随着多个水稻抗褐飞虱基因的克隆和对其功能的研究,发现水稻抗褐飞虱基因的组成与植物抗病系统类似[17],从分子层面来看,同样是双层防御机制:一类是编码定位于细胞膜上的受体类激酶,如Bph3和Bph15基因编码凝集素类受体激酶[15-16],作为受体识别位于水稻细胞外的褐飞虱相关分子,感受褐飞虱取食并启动抗性反应,从而构成了水稻防御褐飞虱的第一道屏障(即PTI:PAMPs-triggered immunity),产生包括胼胝质沉积,挥发物的释放,蛋白酶抑制剂的积累等效应。第二类是Bph14、Bph6和Bph9及其等位基因编码定位于细胞内的NB-LRR 蛋白[8-10],可能识别褐飞虱分泌进入水稻细胞内的效应子,产生更强的抗性反应,作为水稻抗褐飞虱的第二道屏障(即ETI:Effector-triggered immunity),可以发生识别特定效应子产生的超敏反应以及激素相关信号的激活等效应[6]。Liu 等[15]克隆了Bph3基因,它由 3 个凝集素受体激酶基因(OsLecRK1、OsLecRK2和OsLecRK3)成簇排列构成,该基因簇的成员共同作用,调控水稻对褐飞虱的抗性反应,使水稻具有广谱、持久的抗虫性[18]。Bph15也是一个对褐飞虱具有高抗性的基因,被定位到标记RG1与RG2 之间的47 kb 区域,从该区段克隆了编码一种新型的凝集素受体激酶基因OsLecRK,在水稻抗褐飞虱反应中起重要作用;研究表明OsLecRK是个多效性基因,既参与水稻先天免疫反应,还在种子萌发过程中起作用,也参与水稻的发育过程[19-20]。目前抗褐飞虱基因对应识别的效应子还没有被找到,而OsLecRK1、OsLecRK2、OsLecRK3和OsLecRK是如何将褐飞虱的 PAMPs 分子传递给下游的机制也不清楚。作为跨膜的受体胞质激酶,它们有可能通过激酶的磷酸化途径将信号转递给下游参与免疫反应。这些在水稻和褐飞虱的互作过程中都有待进一步探索。
OsRRK1(Rop-interacting receptor-like kinase 1)是 Ma 等[21]运用酵母双杂交技术筛选获得的OsLecRK 的互作蛋白,属于类胞质受体激酶RLCKⅥ家族,该基因过量表达后对褐飞虱的抗性增强,在水稻的发育和防御中具有多重作用,可用于抗褐飞虱水稻的分子标记辅助选择育种。OsRRK1编码一个含有392 个氨基酸的蛋白,具有保守的STYKc(serine-threonine/tyrosine-protein kinase catalytic)结构域,属于RLCK 家族成员,而在水稻中RLCK 可以分为 17 个亚家族[22]。近年来,对 RLCKⅦ家族成员研究的相对比较多,对其他亚家族研究较少,例如 OsRLCK55、OsRLCK185、OsRLCK102、OsRLCK57 、 OsRLCK107 、 OsRLCK118 和OsRLCK176 都是 RLCKⅦ家族成员[23-25]。而进化分析结果表明OsRRK1 属于RLCKⅥ家族成员,是第一个被进行功能分析的RLCKⅥ亚家族基因。对OsRRK1基因功能进行深入研究,不仅能深化对RLCKⅥ亚家族的认识,对于挖掘新的家族基因并进行新基因功能分析具有重要意义。
OsLecRK、OsLecRK1、OsLecRK2、OsLecRK3作为受体细胞激酶,在抗褐飞虱的PTI 阶段起重要作用,而作为胞质受体细胞激酶的OsRRK1 也在抗褐飞虱中起重要作用。为了探究OsRRK1 在水稻抗褐飞虱机理,本研究通过酵母双杂交方法探究OsRRK1 与 OsLecRK(Bph15)、OsLecRK1-3(Bph3)蛋白的关系,同时利用序列比对和进化分析OsLecRK(Bph15)与 OsLecRK1-3(Bph3)几个蛋白之间的关系。本研究对研究OsRRK1 在水稻抗褐飞虱的PIT 阶段的作用具有重要意义。
1 材料与方法
1.1 水稻材料和菌株
本研究所用的水稻材料为籼稻B5(含有抗虫基因Bph14和Bph15)和籼稻Kasalath。B5 是药用野生稻与栽培稻杂交后代中选育得到的水稻品系;Kasalath 用于扩增OsRRK1的开放阅读框序列。
所使用的菌株包括E. coli菌株TOP10 和酵母菌株AH109,分别由武汉大学何光存教授实验室和武汉大学孙蒙祥教授实验室提供。
1.2 酵母双杂交载体构建
以B5 的cDNA 为模板进行扩增得到OsLecRK的全长,以Kasalath 的cDNA 为模板进行扩增得到OsRRK1 的全长。以基因ORF 两端的18~30 bp 序列,加上相应的酶切位点和保护碱基设计扩增引物(表1)。OsLecRK1-OsLecRK3 的参考序列来源于数据库,以B5 的cDNA 为模板扩增,扩增所得的序列与数据库一致。PCR 扩增的产物与 pGADT7 和pGBKT7 载体分别进行相应的酶切反应后进行连接,连接产物通过热击转化法转化到大肠杆菌Top10 感受态细胞中,将PCR 鉴定和酶切鉴定为阳性的克隆进行测序,提取质粒后保存于−20℃备用。
1.3 酵母感受态细胞的制备
将 AH109 酵母菌株划线接种到无抗的 YPDA固体培养基中,30℃培养2~3 d;挑取2~3 mm 大小的单菌落接种于5 mL无抗的YPDA液体培养基中,在30℃摇床中,250 r/min 培养过夜。取适量活化的酵母菌转到 100 mL YPDA 中,使 OD 值达到0.2~0.3,在30℃摇床中,250 r/min 培养3 h,使OD值达到0.4~0.6。以700g,离心5 min,弃上清。加入30 mL 的无菌水重悬,700g,离心5 min,弃上清。加入 1.5 mL 的 1.1×TE-LiAc(10 mL TE-LiAc含 10×TE 1.1 mL、1 mol/L LiAc 1.1 mL 和无菌水 7.8 mL),转入1.5 mL 离心管中,13 500 r/min,离心15 s,弃上清,重悬于 400~600 μL 1.1×TE-LiAc 溶液中,至此,感受态细胞即制备完成。

表1 用于构建载体的引物Table 1. Primers used in vectors constructed.
1.4 酵母与共转化互作验证
为研究OsRRK1 与OsLecRK 的互作关系,将OsLecRK 连入 pGADT7 载体,将 OsRRK1 连入pGBKT7 载体,通过共转的方法将它们共转入酵母菌株AH109,待双缺上的酵母菌长出后(大约3~5 d),随机挑选几组,然后将OD 值调成10、5、1这三个不同的浓度,点 5 μL 在 SD/-Leu/-Trp/-His三缺(缺乏亮氨酸、色氨酸和组氨酸)平板上,3~7 d 观察菌斑的生长状况。
为研究OsRRK1 与OsLecRK1-OsLecRK3 互作关系,将 OsLecRK1-OsLecRK3 连入 pGADT7,OsRRK1 连入pGBKT7,共转化酵母。
Yeastmaker carrier DNA 变性:用1 mL 的移液枪将 Yeastmaker carrier DNA 吸到 200 μL 的小管中。在PCR 仪中95℃~100℃下变性5 min,冰上放置2 min,重复此过程一次。
反应体系构建:将Yeastmaker carrier DNA 5 μL、质粒DNA 各1 μL(约100 ng)、感受态细胞50 μL、PEG-LiAc 溶液 500 μL 依次加入到 1.5 mL离心管中。
将 PEG-LiAc 溶液(10 mL PEG-LiAc 溶液含PEG3350 8 mL, 10×TE 1 mL, 1 mol/L LiAc 溶液 1 mL)30℃下水浴 30 min,再加入 20 μL 二甲基亚砜(DMSO)。42℃下水浴15 min,高速离心15 s,弃上清,重悬于1 mL 2×YPDA液体培养基中。30℃,250 r/min 下摇1 h,高速离心15 s,弃上清,重悬于 1 mL 0.9% NaCl 溶液中,混匀后涂于SD/-Leu/-Trp(缺乏亮氨酸和色氨酸)双缺平板上。
待双缺平板上的酵母菌长出后(大约3~5 d),随机挑选几个斑到300 mL 0.9% NaCl 溶液中混匀。将菌液稀释100 倍测其OD 值。然后根据OD 值调成 10、5、1 三个不同的浓度,点 5 μL 在SD/-Leu/-Trp/-His 三缺平板上,3~7 d 内观察菌斑的生长状况。
1.5 OsLecRK 与 OsLecRK1-OsLecRK3 蛋白结构域预测、序列对比与进化分析
结构域预测:利用 SMART 在线分析工具(http://smart.embl.de/)对 OsLecRK、OsLecRK1、OsLecRK2、OsLecRK3 蛋白进行结构域预测。
利用 DNAMAN 分析 OsLecRK、OsLecRK1、OsLecRK2、OsLecRK3 蛋白的序列。采用邻位相连法(Neighbor-joining)进行进化树分析。
2 结果与分析
2.1 OsLecRK 与 OsLecRK1-OsLecRK3 蛋白结构域预测、序列比对与进化分析
用 SMART 分析 OsLecRK 与 OsLecRK1-OsLecRK3 几个蛋白的结构域,发现都属于B-lectin类受体激酶,都具有 S_TKc(Serine/Threonine protein kinases, catalytic domain)结构域,结构上极其相似(图1)。
用 DNAMAN 软件将 OsLecRK 与 OsLecRK1-OsLecRK3 蛋白序列对比分析,结果表明OsLecRK与OsLecRK1-OsLecRK3 同源性非常高。序列比对结果如图2 所示,OsLecRK 与OsLecRK1 的同源性为80.18%,与OsLecRK2 的同源性为53.52%,与OsLecRK3 的同源性为 53.83%,说明BPH15区间里的OsLecRK与BPH3区间里的OsLecRK1、OsLecRK2、OsLecRK3是同源基因或者家族基因。OsLecRK1 与OsLecRK2 的序列比对分析一致性为66.75%,OsLecRK1 与OsLecRK3 的序列比对分析一致性为67.11%,而OsLecRK2 与OsLecRK3 的序列比对分析一致性为 88.78%。进化树分析结果表明,OsLecRK2 与OsLecRK3 的进化关系更近,因而聚类到一起;OsLecRK 与OsLecRK1 进化分析关系近(图3)。
2.2 OsRRK1 与OsLecRK 蛋白互作验证
OsRRK1 与 OsLecRK 连入载体后进行共转化酵母实验结果表明,pGBKT7-OsRRK1/pGADT7 和pGBKT7/ pGADT7-OsLecRK 在二缺平板上可以正常生长,在三缺平板上不能生长;pGBKT7-Lam/pGADT7-T 阴性对照组在二缺平板上可以正常生长,但是在三缺平板不能生长;pGBKT7-53/pGADT7-T 阳性对照组在二缺平板和三缺平板上均可正常生长,并且在加有X-α-Gal 的三缺平板上可以变蓝;pGBKT7-OsRRK1/pGADT7 -OsLecRK 共转的酵母在二缺平板上正常生长,在三缺平板上可以生长,并且在加有X-α-Gal 的三缺平板上可以变蓝(图4)。
2.3 OsRRK1 与 OsLecRK1-OsLecRK3 蛋白互作验证
既然OsRRK1 与OsLecRK 在酵母中存在互作,而OsLecRK 与OsLecRK1-OsLecRK3 具有很高的相似性,那么OsRRK1 与OsLecRK1-OsLecRK3 在酵母中是否存在互作,有待进一步验证。我们将OsRRK1 和OsLecRK1- OsLecRK3 连入载体后进行共转化酵母实验后发现 pGBKT7-OsRRK1/pGADT7-OsLecRK1 共转的酵母在三缺平板上不生长,而pGBKT7-OsRRK1/pGADT7-OsLecRK2 共转的酵母在三缺平板上形成蓝斑,pGBKT7-OsRRK1/pGADT7-OsLecRK3 共转的酵母在三缺平板上形成蓝斑(图5)。这些结果表明OsRRK1 与OsLecRK2 和 OsLecRK3 互作,与 OsLecRK2 互作的强度最大,其次是OsLecRK3,与OsLecRK1 不存在互作关系,推测 OsRRK1 可能参与了OsLecRK2、OsLecRK3 下游的抗性通路。
3 讨论
蛋白质与蛋白质之间相互作用是细胞生化反应网络构成的主要组成部分之一,研究其互作网络与转录调控网络对调控细胞及其信号有着重要意义。自Fields 等[26]根据真核转录调控的特点创建酵母双杂交技术以来,该技术以其简便、灵敏、高效以及能反映不同蛋白质之间在活细胞内的相互作用等特点,在蛋白互作的研究中得到广泛应用。
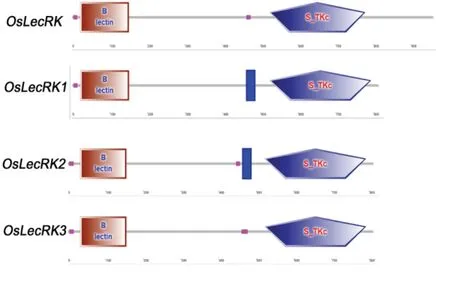
图1 OsLecRK与OsLecRK1-OsLecRK3蛋白结构域预测Fig. 1. Prediction of OsLecRK and OsLecRK1-OsLecRK3 protein domains.

图2 OsLecRK 与OsLecRK1-OsLecRK3 蛋白序列比对Fig. 2. Alignment of OsLecRK and OsLecRK1-OsLecRK3.

图3 OsLecRK 与OsLecRK1-OsLecRK3 进化分析Fig. 3. Phylogenetic tree analysis of OsLecRK and OsLecRK1-OsLecRK3.

图4 利用酵母双杂交对OsRRK1 与OsLecRK 蛋白互作的验证Fig. 4. The interaction between OsRRK1 and OsLecRK protein was verified by yeast two-hybridization.
植物抗病先天免疫系统是由不同类型的病原分子触发的双分支先天系统[27-29]。水稻抗褐飞虱双层防御系统第一层是类似于模式识别受体(PRRs)的 LecRKs,该受体通过识别病原体相关分子模式(PAMPs)激活并触发 PAMP 触发免疫(PTI)[28]。而在水稻对昆虫免疫系统的第一层起作用的受体类细胞质激酶基因OsLecRK、OsLecRK1、OsLecRK2和OsLecRK3可能通过感知食草动物(褐飞虱)相关分子模式(HAMPs)或损伤相关分子模式(DAMP),或介导下游抗性信号事件,从而对BPH侵染的模式触发的免疫反应起关键作用,从而使水稻获得广谱抗性。
OsRRK1基因表达量越高对褐飞虱的趋避性越强,而 OsRRK1 与 OsLecRK 互作,OsRRK1很可能是OsLecRK下游抗性通路成员[20]。OsRRK1 与由三种凝集素受体激酶(OsLecRK1-3)组成的抗褐飞虱蛋白 Bph3 中的 OsLecRK2 与 OsLecRK3 互作。在序列比对时发现,OsLecRK2 与OsLecRK3 的多序列比对一致性最高,达到了88.78%,说明在抗褐飞虱的PTI 阶段,OsRRK1 有可能是通过OsLecRK2与 OsLecRK3 结构域中特殊的氨基酸残基相互作用,将抗褐飞虱信号传递到下游;而OsLecRK1 结构域中可能不存在与OsRRK1相互作用或者存在相互作用效果非常弱的氨基酸残基。
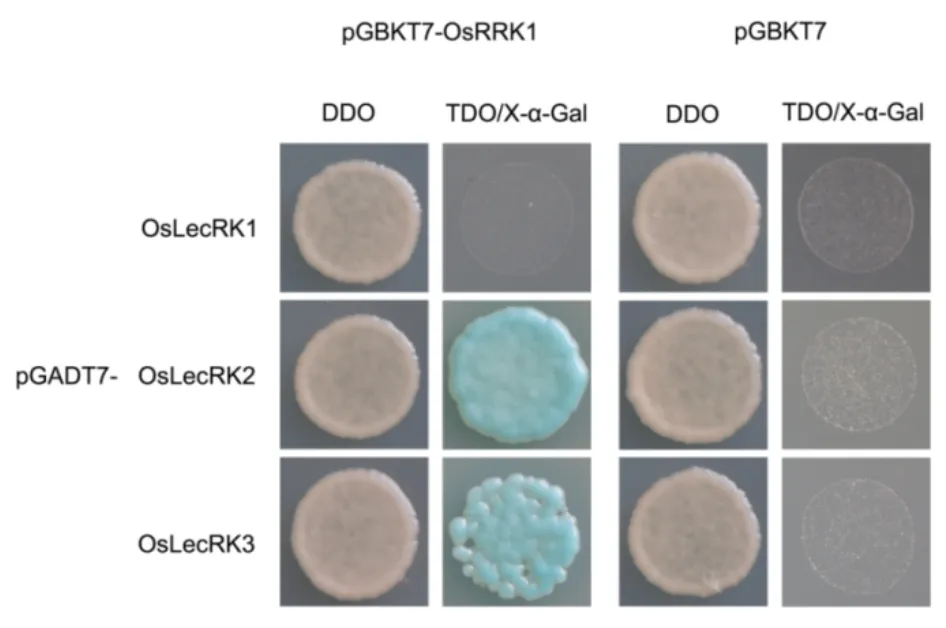
图5 OsRRK1 与OsLecRK1-OsLecRK3 蛋白互作的验证Fig. 5. Confirmation of positive interactions between OsRRK1 and OsLecRK1-OsLecRK3.
亚细胞定位发现 OsLecRK、OsLecRK1、OsLecRK2、OsLecRK3 定位在质膜上,OsRRK1 定位在细胞质中,OsRRK1 有可能被 OsLecRK、OsLecRK2 和 OsLecRK3 磷酸化,而它们可识别HAMP(食草动物相关分子模式), 并随后引发对褐飞虱的免疫反应。OsRRK1 有可能在过量表达的情况下,通过与OsLecRK2 和OsLecRK3 互作,增强Bph3 的抗性作用,参与抗性表达。但OsRRK1接受来自细胞表面的受体激酶的信号并与这些互作蛋白协同发挥抗褐飞虱作用的具体分子和细胞过程有待阐明。
4 结论
酵母双杂交结果显示 OsRRK1 与 OsLecRK、OsLecRK2 和 OsLecRK3 互作,与 OsLecRK2 互作的强度最大,其次是OsLecRK3,最后是OsLecRK,与OsLecRK1 不存在互作关系。OsRRK1 能够通过传递受体激酶激活的信号在水稻与褐飞虱互作中发挥作用,且 OsLecRK 与 OsLecRK1-OsLecRK3同源性非常高。
本研究对于 OsLecRK 介导的对抗褐飞虱的防御机理和OsLecRK(BPH3 和BPH15)作为模式识别受体被病原菌相关分子模式激活从而诱发PTI 机理提供了一定理论依据,为后期深入研究OsRRK1与OsLecRK、OsLecRK2 和OsLecRK3 互相作用的位点的结合位点,说明褐飞虱与水稻之间的分子相互作用,找到影响或抑制蛋白间相互作用的因素,揭示OsRRK1 与水稻间的分子相互作用奠定基础。
