Bph36介导的抗性机制及相关信号通路的研究
2022-06-06薛艳霞李容柏
薛艳霞 李容柏




摘 要:褐飛虱(Stål., BPH)是水稻最主要的害虫之一,给水稻生产造成严重的危害。携带不同抗性基因的抗褐飞虱水稻材料抗性机制不同,挖掘普通野生稻抗褐飞虱基因并研究其介导的抗性机制及相关信号通路对水稻育种具有重要的意义。本研究基于课题组前期从广西普通野生稻‘W2183’挖掘出的位于4号染色体InDel标记S13和X48之间38 kb处新基因,以‘9311’和‘抗蚊青占’为感性对照,05RBPH16和NIL为抗性对照,通过褐飞虱宿主选择性、蜜露量测定、褐飞虱存活率及褐飞虱生长速率等方法分析介导的抗褐飞虱机制;同时,以‘抗蚊青占’为感性对照,NIL为抗性对照,通过qRT-PCR分析植物防御昆虫侵害的三大信号途径:水杨酸、茉莉酸和乙烯相关基因表达量的差异。抗性机制研究结果表明:褐飞虱在抗性材料植株上的虫口密度显著低于感性材料植株,抗性材料上的褐飞虱存活率、群体生长率及取食后排泄的蜜露量均比感性对照显著降低。介导的抗性机制是寄主抗生性和害虫趋避性相互作用的结果。qRT-PCR结果表明:褐飞虱取食后,各个时间段抗性材料NIL植株中水杨酸合成相关基因、、和水杨酸途径病程相关蛋白基因的表达量显著高于感性材料‘抗蚊青占’植株中的表达量;抗性材料NIL植株中,茉莉酸合成基因和茉莉酸积累基因的表达量比褐飞虱取食前显著提升,但是比同时段感性材料植株中表达量显著降低;褐飞虱取食后,抗、感性材料植株中乙烯信号途径基因的表达量都受到抑制,基因表达量都提高,但2种材料间的差异不显著。茉莉酸途径和乙烯途径参与了NIL植株抗褐飞虱的基础防御反应,但激活的抗性不是茉莉酸和乙烯依赖的信号防御途径而是激活水杨酸依赖的系统获得性抗性。研究结果为进一步研究与其他抗性基因聚合,培育兼有多种抗性机制和防御信号途径的优良品种奠定基础。
关键词:;抗性机理;信号通络中图分类号:S511.9 文献标识码:A
Brown planthopper ( Stål., BPH) is one of the most important pests of rice, which causes serious harm to rice production. The mechanisms of brown planthopper resistant genes in rice materials are different. It is of great significance for rice breeding to explore the resistance mechanism and related signal pathway of brown planthopper resistant genes in common wild rice. This work investigated the new BPH resistance gene flanked by InDel markers S13 and X48 on the short arm of rice chromosome 4 derived from Guangxi common wild rice ‘W2183’. The mechanism of -mediated resistance to brown planthopper was analyzed by host selection, honeydew quantity measurement, survival rate and growth rate of brown planthopper based on the susceptible control, 9311 and ‘Kangwenqingzhan’, and resistant control, 05RBPH16 and NIL. qRT-PCR was used to analyze the expression level of defence-related genes of salicylic acid (SA), jasmonic acid (JA) and ethylene (ET) pathways of plant defense against insect invasion based on susceptible control ‘Kangwenqingzhan’, and resistant control NIL. The results showed that the population density of the brown planthopper on the resistant material was significantly lower than that on the sensitive material, and the survival rate, population growth rate, and honeydew excreted by the brown planthopper on the resistant material were significantly lower than that on the susceptible control. mediated resistance was the result of the interaction between host resistance and pest avoidance. qRT-PCR revealed in response to brown planthopper feeding, the expression level of SA synthesis-related genes, , and SA defense-related gene in NILwas significantly higher than that in ‘Kangwenqingzhan’, and the expression level of JA synthesis-related gene and JA accumulation-related genein was significantly increased in comparison to that before feeding, but significantly decreased in comparison to that in susceptible plants. The expression of ET signaling pathway gene and was inhibited and increased, respectively, in both resistant and susceptible materials in response to brown planthopper feeding, but there was no significant difference between the two materials. JA/ET pathways were involved in the basic defense response of NIL against brown planthopper, but the BPH resistance gene acquired resistance via SA-dependent activation pathway and JA/ET- -independent activation pathway. The results would lay a foundation in a breeding program for rice quality with multiple resistance mechanisms and defense signaling pathways from the aggregation of the BPH resistance gene with other resistance genes.
; resistance mechanism; signal pathways
: 10.3969/j.issn.1000-2561.2022.05.005
植物受到昆虫侵染危害后,通常会在抗生性(antibiosis)、拒虫性(nonpreference)和耐虫性(tolerance)3种抗性机制方面表现出抗性。水杨酸、茉莉酸和乙烯三大信号途径是植物防御昆虫侵害的主要途径。携带不同抗褐飞虱基因的水稻品种对褐飞虱抗性机制和介导的相关信号通路不同。2019年,作者与课题组成员从广西普通野生稻‘W2183’挖掘出新基因,位于4号染色体InDel标记S13和X48之间38 kb处。本研究以感性材料‘9311’‘抗蚊青占’为对照,通过宿主选择、蜜露测定法、褐飞虱存活率和褐飞虱生长速率等方法研究了介导的抗性机制;采用实时荧光定量PCR技术(quantitative real-time PCR)分析比较了3种信号途径相关基因在‘抗蚊青占’和NIL中表达量的差异,研究了介导的相关信号通路。
材料与方法
材料
抗性机理研究材料:‘9311’、‘抗蚊青占’(KWQZ)、05RBPH16、NIL-(抗褐飞虱基因的近等位基因系)。
抗性相关通路研究材料:‘抗蚊青占’(KWQZ)、NIL-(抗褐飞虱基因的近等位基因系)。
虫源:实验褐飞虱虫源采集自广西大学实验基地水稻田间自然群体。采集后选择生物型Ⅱ隔离饲养于广西大学温室内,温度为(28±2)℃,湿度为(75±5)%,保持在TN1上饲养繁殖。在播种时,收集雌性成虫在成株期的TN1上产卵,获得大量的2~3龄若虫以供使用。
方法
1.2.1 褐飞虱的宿主选择性 褐飞虱的宿主选择性参照陈曙等的方法。将‘9311’、‘抗蚊青占’、05RBPH16和NIL各取20粒播种到盛有稻田表土的育秧盘中,三叶期剔除弱苗,每个材料剩留15苗。按照平均每株约8~10头的量接入2~3龄褐飞虱若虫。接虫后每隔24 h观察各材料上附着的褐飞虱的数目,每次观察后轻轻拍打水稻基部让褐飞虱均匀分布于塘瓷育秧盘水中,重复3次。根据不同水稻材料上附着褐飞虱的数目评价其对褐飞虱的抗性。
1.2.2 褐飞虱蜜露排泄量测定 褐飞虱蜜露排泄量测定采用蜡膜小袋法。采用播种后苗龄40 d左右的健康植株,去掉分蘖留下主茎,移栽到直径为9 cm的盛有大田表层土的塑料杯中。3 d后,将剪好的5 cm×5 cm的蜡膜小袋附着在材料上,每株2个,其中一个为对照。将提前准备好的饥饿3 h的褐飞虱雌成虫用吸管接入蜡膜小袋内,每只蜡膜小袋内接入1头,每个处理3个重复。接虫48 h后,取下小袋,放出蜡膜小袋内的褐飞虱,用万分之一电子天平称重,附着有蜜露的小袋总重W,对照小袋重M。然后,用脱脂棉擦掉蜜露称蜡膜小袋总量W,对照小袋M,根据公式计算,蜜露量(mg)=(W–W)–(M–M),根据蜜露量的重量评价水稻材料对褐飞虱的抗性。
1.2.3 褐飞虱存活率 褐飞虱存活率参照QIU等的方法,采用播种后苗龄40 d左右的健康植株,去掉分蘖留下主茎,移栽到直径为9 cm的盛有大田表层土的塑料杯中。每杯1株,每种材料重复5次。3 d后,每株接10头3~4龄的褐飞風若虫,每杯幼苗使用自制的纱网袋套住。接虫后第24、48、72、96、120小时观察各处理褐飞虱存活数目,以接虫数为基数统计褐飞虱的存活率。
1.2.4 褐飞虱群体生长率 褐飞虱群体生长率(PGR)采用播种后苗龄40 d左右的健康植株,去掉分蘖留下主茎,移栽到直径为9 cm的盛有大田表层土的塑料杯中。放虫前使用直径7 cm的塑料杯(底部有孔)罩住植株。将20头褐飞虱3龄若虫称重后,从7 cm的塑料杯底部孔处接入,并使用脱脂棉将孔口处密封。接虫4 d后,再次称褐飞虱若虫的重量,每种材料3次重复。褐飞虱群体生长率计算如下:感染后褐飞虱总重量(W)的对数减去感染前初始褐飞虱总重量(W)的对数,再除以感染天数,所得数值为褐飞虱的群体生长率(PGR)。
PGR=(logW-logW)/天数
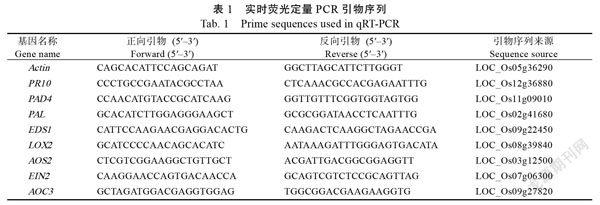
1.2.5 防御信号途径相关基因的表达分析 抗性材料NIL和感性材料‘抗蚊青占’每种材料取10粒种子播种于直径为9 cm的盛有大田表层土的塑料杯中。按照平均每株约8~10头的量接入3龄褐飞虱若虫。接虫后,分别在第24、48、72小时取水稻茎基部用于提取RNA,3次重复。RNA提取及反转录cDNA根据田根试剂盒步骤提取。使用Roche LC480荧光定量扩增仪及SYBR Supermix(SYBR Green)进行实时荧光定量PCR检测。PCR扩增引物来源于NCBI GenBank網站,引物序列信息见表1。
20 μL PCR扩增体系:SYBR Green Supermix(2×)10 μL、10 μmol上游、下游引物各0.3 μL,cDNA模板1 μL、RNase-Free ddHO调至总体积20 μL。PCR扩增反应程序:预变性(94℃)3 min,变性(94℃)15 s,退火(55~60℃)60 s,40个重复,每个样品重复3次。以Actin作为内参基因,按照相对定量2方法分析目标基因相对表达量的差异。
结果与分析
介导的抗性機制
2.1.1 褐飞虱的宿主选择性 褐飞虱宿主选择性揭示了褐飞虱对水稻材料的趋避性,每隔24 h观察各材料上着落褐飞虱的数目,取平均数进行统计,统计结果见表2。从表2可以看出,褐飞虱对感性材料和抗性材料的宿主选择性存在显著差异。褐飞虱在感性材料‘9311’和‘抗蚊青占’上的着落数分别是51头和29头,抗性材料05RBPH16和NIL上的着落数分别是13头和12头。褐飞虱在感性材料之间着落数存在显著差异,‘抗蚊青占’上的着落数仅有‘9311’上的57%,但在抗性材料之间着落数无显著差异。
2.1.2 褐飞虱在不同水稻材料上的蜜露排泄量 褐飞虱取食水稻韧皮部汁液后分泌蜜露的量与取食量成正比,本研究统计分析了褐飞虱在‘9311’、‘抗蚊青占’、05RBPH16和NIL上褐飞虱排泄的蜜露量,统计结果见表3。从表3可以看出,接虫24 h后,褐飞虱在抗、感性材料间分泌的蜜露量存在显著差异。褐飞虱在‘9311’和‘抗蚊青占’上分泌的蜜露量分别为38.30 mg和13.37 mg,而在05RBPH16和Bp上褐飞虱分泌的蜜露量仅为4.73 mg和4.87 mg。感性材料‘9311’和‘抗蚊青占’上的褐飞虱分泌的蜜露量存在显著差异,而抗性材料05RBPH16和NIL-上褐飞虱分泌的蜜露量无显著差异,感性材料和抗性材料的蜜露量存在显著差异。
2.1.3 褐飞虱在不同水稻材料上的存活率 为观察褐飞虱不同水稻材料上的存活率,观察了第24、48、72、96、120小时各处理褐飞虱存活数目,统计结果见图1。从图1中可以看出,随着接虫时间的递增,褐飞虱在不同材料上存活率呈递减趋势。褐飞虱在抗、感性材料间存活率存在显著差异,抗性材料上的褐飞虱的存活率的递减速度快,而感性材料上褐飞虱的存活率的递减较平缓。接虫48 h后,抗性材料上褐飞虱的存活率低于60%,而感性材料上褐飞虱的存活率保持在80%以上。接虫120 h后,抗性材料上褐飞虱的存活率接近于0,感性材料上褐飞虱的存活率仍有50%。
2.1.4 褐飞虱在不同水稻材料上的群体生长率 褐飞虱2~3龄若虫的重量约1~2 mg/头,褐飞虱群体生长率可以通过在宿主材料上取食前后的体重变化来统计。接虫4 d后,我们对褐飞虱感性材料和抗性材料上的群体生长率分别做了统计。从表4可以看出,褐飞虱在感性材料‘9311’和‘抗蚊青占’上的群体生长率分别为0.0563 mg/d和0.0623 mg/d,在抗性材料05RBPH16和NIL植株上的群体生长率分别为0.0184 mg/d和0.0196 mg/d。褐飞虱在抗、感2种材料上的群体生长率差异性显著,抗性材料上的群体生长率仅为感性材料上的1/3。
抗性相关通路的研究
昆虫所诱导的植物防御信号途径主要是茉莉酸、水杨酸和乙烯信号途径。为了研究介导的抗性参与了哪种防御信号途径,我们研究了3个防御信号途径相关基因的表达情况。
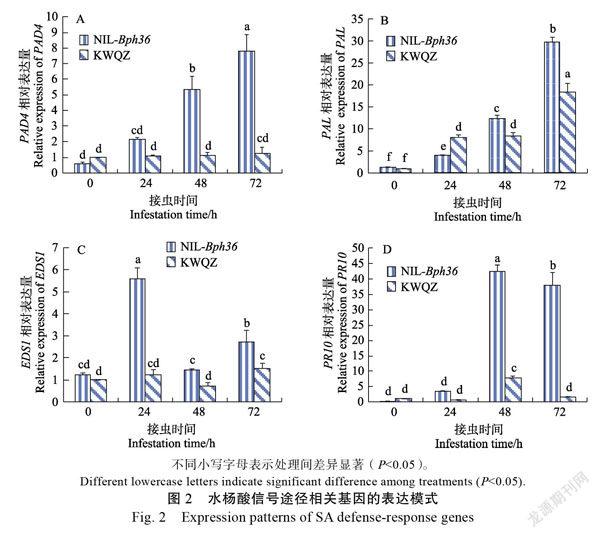
2.2.1 水杨酸(SA)信号途径 (enhanced disease susceptibility 1),(phytoalexin deficient 4),(phenylalanine ammonia-lyase,苯丙酰胺裂解酶)是水杨酸合成相关基因。是水杨酸途径病程相关蛋白基因(PR基因)之一,植物在受到害虫侵染后其表达量显著变化,、和的表达模式见图2。
从图2A可以看出:接虫后,各个时间段NIL-植株中相对表达水平显著高于‘抗蚊青占’植株中的相对表达量。在‘抗蚊青占’植株中,相对表达量无显著变化,而在NIL 植株中,接虫24 h后基因相对表达量开始提高,接虫72 h后相对表达量比0 h提高了7.82倍。
从图2B可以看出:褐飞虱侵染后,基因的相对表达量随着褐飞虱侵染的时间的延长而逐渐提高,接虫72 h后,在NIL植株中基因相对表达量显著高于‘抗蚊青占’植株中的相对表达量。植株中基因相对表达量比0 h提高了29.74倍,是同一时间段内‘抗蚊青占’植株中相对表达量的1.63倍。
从图2C可以看出:褐飞虱侵染后,在NIL植株中基因相对表达量显著高于‘抗蚊青占’植株中的相对表达量,接虫24 h后,NIL植株中基因相对表达量是‘抗蚊青占’植株中的相对表达量的4.52倍。接虫48 h后,基因相对表达量比24 h下降,但同一时间段内,NIL植株中基因相对表达量是‘抗蚊青占’中的相对表达量高1.98倍,72 h时基因相对表达量再次上升。
从图2D可以看出:褐飞虱取食后,抗性材料NIL植株中基因的相对表达量随褐飞虱取食时间而持续升高,在褐飞虱取食48 h后其相对表达量是0 h的185.23倍,是同一时间段‘抗蚊青占’植株中相对表达量的5.42倍。‘抗蚊青占’植株中的相对表达量在24 h时受到抑制,在48 h后其相对表达量提高但72 h又下降。
综合上述结果表明,激活了水杨酸依赖的系统获得性抗性,从而防御褐飞虱取食。
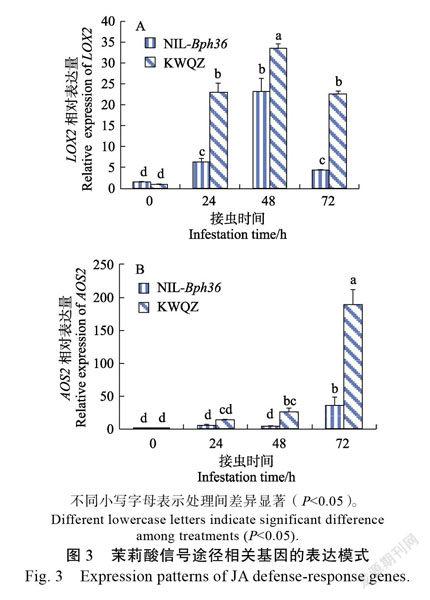
2.2.2 茉莉酸(JA)信号途径 基因(lipox ygenase,磷脂酶基因脂氧合酶)和(allene oxide synthase 2,丙二烯氧合酶2)是诱导合成和积累茉莉酸的主要基因。和的表达模式见图3。
从图3A可以看出:在褐飞虱取食后,基因每个时间段在‘抗蚊青占’植株中的相对表达量显著高于NIL-植株中的相对表达量。接虫24 h后,‘抗蚊青占’植株中的相对表达量是NIL-Bph36植株中的3.63倍。接虫48 h后,‘抗蚊青占’植株中基因的相对表达量是抗性材料NIL-中的1.44倍。
从图3B可以看出:在褐飞虱取食后,基因的相对表达量随褐飞虱取食时间而持续升高。接虫24 h后,‘抗蚊青占’植株中的相对表达量显著提高,72 h后其相对表达量是0 h的189.58倍。褐飞虱侵染72 h后,NIL-植株中基因的相对表达量虽然比0 h对照中提高了36.06倍,但仅是同一时间段‘抗蚊青占’中的相对表达量的1/5。
综合上述结果表明,茉莉酸参与了水稻对褐飞虱的基础性防御,但激活的是不依赖于茉莉酸的信号防御途径。
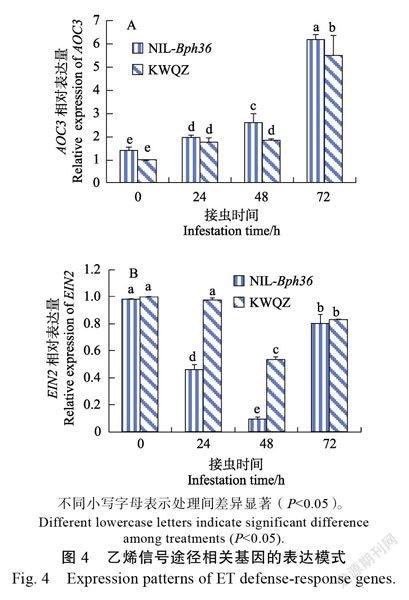
2.2.3 乙烯(ET)信号途径 基因(ethylene insensitive 2)和基因(ACC氧化酶家族基因)是乙烯信号途径的主要基因。基因2和基因的表达模式见图4。
从图4A、图4B可以看出:在褐飞虱取食后,基因在抗、感植株中的相对表达量都提高,但在0 h和24 h 2种材料间的差异不显著。褐飞虱取食后,基因在NIL-植株和‘抗蚊青占’植株中的相对表达量都受到抑制。褐飞虱取食24 h和48 h后,NIL-植株中基因相对表达量显著低于同一时间段内‘抗蚊青占’植株中的相对表达量。而72 h后,基因在2种材料中的相对表达量接近相同。以上分析结果表明,激活的是不依赖于乙烯的信号防御途径。
讨论
介导的抗性机制
关于植物对昆虫抗性机制,不同的学者持不同的观点。目前主要有2种观点,一种是认为植物的抗生性给予昆虫很大的选择压力,使昆虫更容易产生新的生物型。趋避性虽然给予昆虫的选择压力小,但容易造成单食性昆虫的灭绝,打破生态链的平衡。耐受性是植物与昆虫协同进化中一种比较稳定的抗性机制。另外一種观点认为耐受性虽然在虫害后产量和品质都不受影响,但导致昆虫在其上能生活更多世代,造成大规模的爆发,导致作物产量大面积绝收。因此,兼有多种抗性机制的品种能通过机制间的相互作用起到更好的防御功能 。
COHEN等研究了抗性品种IR64的抗性机制是抗生性、抗趋性和耐受性共同作用的结果。DU等研究结果表明介导的抗生性降低了褐飞虱在转基因植株上的存活率,群体生长率等抗生性指标,但不具有趋避性。QUILICHINI等研究提出携带有的植株对褐飞虱同时表现出抗趋性和抗生性。徐雪亮等研究了抗虫材料1105113和1105096的抗褐飞虱机是抗生性作用较强,耐害性作用较弱。LIU等研究了抗性材料RH携带的抗性基因表现出强的抗生性。TAMURA等提出基因介导的抗性抑制了褐飞虱在水稻上的着落数和取食量,兼具有趋避性和抗生性。何俊等研究出抗性品种Balamawee与RH具有较强的抗生性,Pokkali和Kaharamana属于耐虫品种。
本研究结果表明,褐飞虱对抗性材料05RBPH16和NIL-表现出明显的趋避性,褐飞虱在其的虫口密度显著低于感性材料;褐飞虱在抗性材料上的存活率、群体生长率及取食后排泄的蜜露量均比感性对照显著降低。由此推测,介导的抗性机制是寄主抗生性和害虫趋避性相互作用的结果。
介导的相关通络
大量研究结果表明水杨酸(SA)、茉莉酸(JA)和乙烯(ET)3种信号途径是植物防御害虫时激活的主要信号途径。目前,关于水稻抗褐飞虱激活的相关通路研究的报道相对较少。DU等认为激活了水杨酸依赖的系统性获得抗性,从而防御褐飞虱的取食。QIU等认为激活了水稻中的JA信号途径,但又不依赖于JA信号途径。WANG等提出介导的抗性激活了水杨酸途径,抑制了茉莉酸和乙烯途径。本研究结果说明:褐飞虱取食后,茉莉酸途径和乙烯途径参与了NIL植株抗褐飞虱的基础防御反应,但激活的抗性不是茉莉酸和乙烯依赖的信号防御途径,而是激活了水杨酸依赖的系统获得性抗性。
参考文献
[1] KALOSHIAN I. Gene-for-gene disease resistance: bridging insect pest and pathogen defense[J]. Journal of Chemical Ecology, 2004, 30: 2419-2438.
[2] 李容柏, 李丽淑, 韦素美, 韦燕萍, 陈英之, 白德朗, 杨 朗, 黄凤宽, 吕维莉, 张向军, 李小勇, 杨新庆, 魏源文. 普通野生稻(Oryza rufipogon Griff.)抗稻褐飞虱新基因的鉴定与利用[J]. 分子植物育种, 2006, 4(3): 365-371.LI R B, LI L S, WEI S M, WEI Y P, CHEN Y Z, BAI D L, YANG L, HUANG F K, LYU W L, ZHANG X J, LI X Y, YANG X Q, WEI Y W. The evaluation and utilization of new genes for brown planthopper resistance in common wild rice ( Griff)[J]. Molecular Plant Breeding, 2006, 4(3): 365-371. (in Chinese)
[3] LI Z H, XUE Y X, ZHOU H L, LI Y, USMAN B, JIAO X Z, WANG X Y, LIU F, QIN B X, LI R B, QIU Y F. High-resolution mapping and breeding application of a novel brown planthopper resistance gene derived from wild rice ( Griff)[J]. Rice, 2019, 12: 41.
[4] 陳 曙, 刘 芳, 薛艳霞, 祝 亚, 覃宝祥, 韦 政, 邱永福, 李容柏. 水稻对褐飞虱的抗性鉴定及其抗性机制研究[J]. 西南农业学报, 2016, 29(9): 2125-2130.CHEN S, LIU F, XUE Y X, ZHU Y, QIN B X, WEI Z, QIU Y F, LI R B. Study on evaluation and mech- anism of rice resistance to brown planthopper[J]. Southwest China Journal of Agricultural Sciences, 2016, 29(9): 2125-2130. (in Chinese)
[5] PAGUIA P, PATHAK M D, HEINRICHS E A. Honeydew excretion measurement techniques for determining differential feeding activity of biotypes of on rice varieties[J]. Journal of Economic Entomology, 1980, 73(1): 35-40.
[6] QIU Y F, GUO J P, JING S L, ZHU L L, HE G C. Fine mapping of the rice brown planthopper resistance gene BPH7 and characterization of its resistance in the 93-11 background[J]. Euphytica, 2014, 198: 369-379.
[7] KLINGLER J, CREASY R, GAO L, NAIR R M, CALIX A S, JACOB H S, EDWARDS O R, SINGH, APHID K B. Resistance in medicago truncatula involves antixen- osis and phloem-specific, inducible antibiosis, and maps to a single locus flanked by NBS-LRR resi- stance gene analogs[J]. Plant Physiology, 2005, 137(4): 1445-1455.
[8] JONES J D G, DANGL J L. The plant immune system[J]. Nature, 2006, 444(7117): 323-329.
[9] VÖLZ R, PARK, J Y, KIM S, PARK, S Y, HARRIS, W, CHUNG H J, LEE Y H. The rice/maize pathogen spp. infect and reproduce on Arabidops- is revealing differences in defensive phytohormone function between monocots and dicots[J]. The Plant Journal, 2020, 103(1), 412-429.
[10] LI S S, ZHAO J P, ZHAI Y S, YUAN Q, ZHANG H Z, WU X Y, LU Y W, PENG J J, SUN Z T, LIN L, ZHENG H Y, CHEN J P, YAN F. The hypersensitive induced reaction 3 (HIR 3) gene contributes to plant basal resistance via an EDS 1 and salicylic aciddependent pathway[J]. The Plant Journal, 2019, 98(5): 783-797.
[11] SHARMA A, SHAHZAD B, REHMAN A, BHARDWAJ R, LANDI M, ZHENG B. Response of phenylpropanoid pathway and the role of polyphenols in plants under abiotic stress[J]. Molecules, 2019, 24(13): 2452.
[12] 楊 涛, 王 艳. 植物病程相关蛋白PR-10的研究进展[J]. 植物生理学报, 2017, 53(12): 2057-2068.YANG T, WANG Y. Research progress of plant pathogennesis related protein PR-10[J]. Plant Physiology Journal, 2017, 53(12): 2057-2068. (in Chinese)
[13] WANG J, SONG L, GONG, X, XU J, LI M. Functions of jasmonic acid in plant regulation and response to abiotic stress[J]. International Journal of Molecular Sciences, 2020, 21(4): 1446.
[14] COHEN M B, ALAM S N, MEDINA E B, BERNAL C C. Brown planthopper,, resistance in rice cultivar IR64: mechanism and role in successful management in Central Luzon, Philippines[J]. Entomologia Experimentalis et Applicata, 1997, 85(3): 221-229.
[15] DU B, ZHANG W L, LIU B F, HU J, WEI Z, SHI Z Y, HE R F, ZHU L L, CHEN R Z, HAN B, HE G C. Identification and characterization of , a gene conferring resistance to brown planthopper in rice[J]. Proceedings of the National Academy of Sciences, 2009, 106(52): 22163-22168.
[16] QUILICHINI T D, FRIEDMANN M C, SAMUELS A L, DOUGLAS C J. ATP-binding cassette transporter G26 is required for male fertility and pollen exine formation in [J]. Plant Physiology, 2010, 154(2): 678-690.
[17] 徐雪亮, 肖葉青, 陈大洲, 胡兰香, 姚英娟. 2个新培育水稻材料对褐飞虱的抗性机制研究[J]. 中国农学通报, 2015, 31(10): 171-175.XU X L, XIAO Y Q, CHEN D Z, HU L X, YAO Y J. Resistance mechanism of different rice varieties to brown planthopper[J]. Chinese Agricultural Science Bulletin, 2015, 31(10):171-175. (in Chinese)
[18] LIU Y Q, WU H, CHEN H, LIU Y L, HE J, KANG H Y, SUN Z G, PAN G, WANG Q, HU J L, ZHOU F, ZHOU K N, ZHENG X M, REN Y L, CHEN L M,WANG Y H, ZHAO Z G, LIN Q B, WU F Q, ZHANG X, GUO X P, CHENG X N,L JIANG L, WU C Y, WANG H Y, WAN J M. A gene cluster encoding lectin receptor kinases confers broadspectrum and durable insect resistance in rice[J]. Nature Biotechnology, 2015, 33(3): 301-305.
[19] TAMURA Y, HATTORI M, YOSHIOKA H, YOSHIOKA M, TAKAHASHI A, WU J Z, SENTOKU N, YASUI H. Map- based cloning and characterization of a brown planthopper resistan-ce gene from L. ssp. indica cultivar ADR52[J]. Scientific Reports, 2014, 4(1): 1-8.
[20] 何 俊. 水稻抗褐飞虱主基因Bph22(t)的精细定位[D]. 南京: 南京农业大学, 2011.HE J. High-resolution mapping of the brown planth- opper resistance gene Bph(t) rice[D]. Nanjing: Nanj- ing Agricultural University, 2011. (in Chinese)
[21] QIU Y, GUO J, JING S, ZHU L, HE G. High-resolution mapping of the brown planthopper resistance gene in rice and characterizing its resistance in the 9311 and Nipponbare near isogenic backgrounds[J]. Theoretical and Applied Genetics, 2010, 121(8): 1601- 1611.
[22] WANG Y, CAO L M, ZHANG Y X, CAO C X, LIU F, HUANG F K, QIU Y F, LI R B, LUO X J. Map- based cloning and characterization of , a B3 domain-containing recessive gene conferring brown planthopper resistance in rice[J]. Journal of Experimental Botany, 2015, 66(19): 6035-6045.
