水稻蔗糖转运蛋白OsSUT4 参与蔗糖转运的功能研究
2020-11-23李孟珠王高鹏巫月任怡李刚华刘正辉丁艳锋陈琳
李孟珠 王高鹏 巫月 任怡 李刚华 刘正辉 丁艳锋 陈琳
(南京农业大学 农学院, 南京 210095;*通信联系人, E-mail: linchen@njau.edu.cn)
同化产物蔗糖运输能力不足,造成空瘪粒高,已成为限制水稻产量潜力发挥的主要因素。植物光合固定的碳水化合物一部分直接通过糖酵解等方式参与细胞代谢[1],一部分以蔗糖或者淀粉的形式储存在液泡与叶绿体中,大部分光合固定的碳水化合物直接通过韧皮部装载,并以蔗糖的形式由叶肉细胞输出,经过长距离运输和韧皮部卸载转运至“库”器官,维持植物的生长发育过程[2,3]。生物信息学和细胞亚显微结构分析表明,水稻叶片中薄壁细胞和伴胞的胞间连丝频率仅为其他各类细胞间胞间连丝总频率的1.4%[4];水稻中存在可以驱动蔗糖/H+跨膜转运的质膜ATPase 质子动力势[5];小叶脉中存在可以为质外体装载提供动力所必需的蔗糖合酶、质膜定位的质子焦磷酸酶[6]等,表明水稻可能主要采用质外体进行装载。韧皮部装载效率直接影响蔗糖转运及其在库端的卸载能力。因此,鉴定参与装载的主效蔗糖转运蛋白对提高作物源库效率具有重要意义。
光合同化产物蔗糖的运输与分配主要由蔗糖转运蛋白来调控。蔗糖转运蛋白执行蔗糖从“源”到“库”的质外体运输,在蔗糖的感应、“源”器官装载、韧皮部长距离运输和“库”器官卸载等过程中都发挥着重要作用[7]。目前,已从水稻中鉴定出 5 个 SUT 家族成员,分别为 OsSUT1、OsSUT2、OsSUT3、OsSUT4 和 OsSUT5[8]。OsSUT1 是研究最为广泛的SUT 家族成员,在发芽种子中具有最高的表达量。反义抑制OsSUT1的表达会导致种子发芽迟缓[9],叶片中碳水化合物含量没有显著变化,植株灌浆受到抑制,水稻结实率下降[10],表明OsSUT1 是籽粒灌浆过程中影响蔗糖卸载的关键因子。OsSUT1的GUS 染色和免疫定位结果显示其存在于所有营养组织的成熟韧皮部中,且在籽粒灌浆期参与同化物蔗糖的长距离运输过程。此外,OsSUT1 还能在蔗糖运输途径中从质体外回收蔗糖,保证籽粒灌浆过程中同化物的供应[11]。OsSUT2 定位在液泡膜上[12],将蔗糖从液泡转运至叶肉细胞,供给韧皮部装载所需的蔗糖,维持植株正常生长。OsSUT2突变后导致叶片可溶性糖积累,向外输出减少,库端蔗糖供应不足,产量下降[13]。OsSUT3与OsSUT5表达模式类似,在叶片中表达量较高,在萌发的种子中表达量较低,对OsSUT3的定位研究发现其在花粉中大量表达,表明OsSUT3 可能在蔗糖进入花粉细胞过程中起重要作用[8]。目前对OsSUT4 的功能研究比较少。本研究应用CRISPR/Cas9 技术构建ossut4单缺失变体材料研究水稻的表型生理变化,进一步结合亚细胞和组织定位试验揭示OsSUT4 在水稻蔗糖转运中的功能。研究结果可为精确运用生物技术和分子育种技术来改善“源”、“库”、“流”效率提供理论基础。
1 材料与方法
1.1 亚细胞定位
以日本晴水稻cDNA 为扩增模板,使用设计的正向引物 5′-GGACTAGTCGACCAACGCATCA ATCA-3′和反向引物 5′-GCTCTAGACGTCCCA TCCAGTCAGTATCA-3′将OsSUT4进行扩增,引物两端酶切位点分别为SpeⅠ和XbaⅠ。将目的基因片段连入克隆载体pMD18-T,转入DH5α 大肠杆菌,经过测序验证正确后用限制性内切酶HindⅢ和EcoRⅠ将切下的目的片段分别连接到中间载体pSAT6-EGFP-N1 上,验证正确后用限制性内切酶 PI-PspⅠ将目的片段切下来再连入pCAMBIA1305-GFP载体,比对序列选出测序正确的质粒保存待用。使用OSMCA1-RFP 作为质膜标记[14]。按照已发表的方法[15]提取和转化水稻原生质体,将水稻种子去壳后进行消毒,置于1/2 MS 培养基中避光培养 14 d 后得到的黄化苗可进行原生质体提取。操作步骤及溶液配方参考钟英健等[15]。
1.2 pCAMBIA 1300::GUS 转基因水稻材料的构建及组织定位观察
以日本晴水稻cDNA 为扩增模板,使用设计的正向引物序列 5′-GGTCGACTTGCATGACTTGA AGCCTGCTG-3′和反向引物序列为 5′-GTCTA GAGGCGGGGCGCAGATCTGGTA-3 ′ 扩 增 出OsSUT4序列的启动子片段,引物两端酶切位点分别为BsaI 和EcoR I。将启动子片段连入克隆载体pMD18-T,转入DH5α 大肠杆菌,测序正确后,HindⅢ与SacⅠ双酶切、胶回收再连入pCAMBIA 1300::GUS载体,委托武汉伯远生物科技有限公司进行转化,获得OsSUT4的GUS 转基因植株材料。
种子发芽后,用营养液(根据Yoshida 等的配方修改)培养(0.5 mmol/L KNO3; 0.5 mmol/L NH4Cl;0.32 mmol/L NaH2PO4·2H2O; 0.5 mmol/L KCl; 0.011 mmol/L MnCl2·4H2O; 0.0185 mmol/L H3BO3; 0.0006 mmol/L Na2MoO4·2H2O; 0.0014 mmol/L ZnSO4·7H2O; 0.0016 mmol/L CuSO4·5H2O; 0.3 mmol/L MgCl2·6H2O; 0.66 mmol/L CaCl2; 0.0448 mmol/L FeSO4·7H2O; 0.05 mmol/L Na2EDTA·2H2O),调 pH 值至 5.5 左右,每 7 d 更换一次。苗期取pOsSUT4::GUS转基因植株的根系、叶片和茎鞘;之后将水稻苗在土壤中培养至抽穗扬花期,取花器官。取样后将其完全浸没在充分混合了 1 mmol/L x-GLUC 的GUS 染色缓冲液中,打开容器盖在真空泵中泵30 min,然后盖上盖子,静置在37℃恒温箱中过夜,从恒温箱中取出染色的植物组织,去除染色溶液,加入75%乙醇溶液煮沸脱色,直至植物组织样品变白,在体视显微镜下(Olympus SZX16)观察,并拍照记录。
1.3 ossut4 缺失突变体材料的构建
利用CRISPR/Cas9 技术构建水稻ossut4突变体材料,设计的靶点序列PAM 为CCTCACGGCCAT CCGCCTGCCCT。以日本晴为遗传背景,将构建好的载体委托武汉伯远生物科技有限公司进行转化,获得转基因材料。SDS 法提取 T0代突变体水稻基因组DNA,筛除T-DNA 插入的植株后使用对应的引物进行PCR 扩增,测序并与靶点序列进行比对,确定突变类型(图 1),挑选出纯合突变的植株后繁种保存,用于后续试验。
1.4 试验材料的种植和取样
供试水稻品种为ossut4纯合突变体的三个株系sut4-15-1、sut4-15-2、sut4-46和野生型日本晴。将T2种子和野生型使用 1.5%双氧水浸种消毒后,在72 孔穴盘中播种育秧,待水稻长至4 叶1 心期,挑选长势一致的健康幼苗移栽到桶中,每桶4 穴,1 穴1 苗,统一常规水肥管理。基肥于移栽前一天施用,每桶施尿素、磷酸二氢钾、氯化钾量分别2.1 g、0.958 g、0.744 g;穗肥于幼穗分化期施用,每桶分别施尿素、磷酸二氢钾、氯化钾各2.1 g、0.958 g、0.744 g。水稻盛花期时,采用不同颜色的标牌记录不同小穗的开花时间。于水稻抽穗前剪取ossut4突变体材料和野生型的剑叶,液氮速冻后放于–80℃冰箱保存,用于基因表达量的测量。于白天结束(18:00)和夜晚结束(6:00)时取ossut4突变体材料和野生型的剑叶,105℃下杀青后放入 80℃烘箱内烘干至恒重,用于淀粉、蔗糖含量的测定。于水稻成熟期对试验材料进行田间性状的考查,包括分蘖数、株高等,成熟期取样后统计产量构成。
1.5 荧光定量检测
总RNA 提取采用Omega 公司的Plant RNA Kit试剂盒,RNA 浓度和纯度测定合格后,反转录使用TaKaRa 的 PrimeScript™ RT Master Mix 试剂盒并按说明书配制反应体系,RT-PCR 使用 TaKaRa 的SYBR®Premix ExTaq™试剂盒,以Actin为内参,引物序列见表1。每个处理的样品测定3 个生物学重复,每个生物学重复进行3 次技术重复。
1.6 叶片、籽粒中淀粉、可溶性糖含量的测定
烘干样品粉碎后过1 mm 筛,称取0.1 g 粉样,用80%乙醇在80℃下水浴提取30 min 后5000 r/min下离心15 min,然后转移上清液至10 mL 容量瓶,重复提取3 次,合并所有上清液至同一容量瓶,用蒸馏水定容后静置,用于测定可溶性糖浓度。将可溶性糖提取后的残渣60℃下烘干,加入2 mL 蒸馏水,放入100℃水浴糊化20 min。冷却后加入2 mL预冷9.2 mol/L HClO4,冰浴条件下间歇震荡提取15 min,加入6 mL 蒸馏水,然后5000 r/min 下离心15 min,转移上清液至50 mL 容量瓶,再加入2 mL 9.2 mol/L HClO4重复提取一次,合并两次上清液至50 mL 容量瓶,用蒸馏水定容,用于测定淀粉浓度。
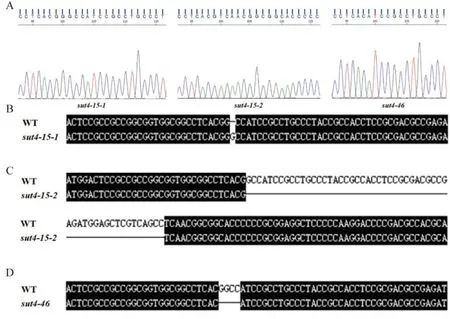
图1 ossut4 突变体株系与野生型的序列比对结果Fig. 1. Results of sequence alignment between the ossut4 mutant lines and the wild-type.

表1 荧光定量PCR 引物序列Table 1. Primer sequences of RT-PCR.
采用超高效液相色谱仪测定提取液中蔗糖、葡萄糖、果糖的浓度。蒽酮比色法淀粉浓度,吸取0.1 mL 提取液,加入4 mL 0.2%蒽酮,沸水浴15 min后冷却,吸取0.2 mL 至酶标板中,使用酶标仪(Nano Quant, infinite M200, Tecan, 瑞士)于 620 nm 波长下测定吸光值。绘制淀粉标准曲线计算淀粉含量。
1.7 叶片光合作用与SPAD 值的测定
于花后7 d 分别选取ossut4突变体和野生型长势一致的3~5 个标记主茎,在9:00–11:00 用Li-6400型光合仪测定净光合速率(Pn),每处理重复 3 次,测定时使用开放式气路,CO2浓度为380 μmol/mol;选择红蓝光源叶室,设定光量子密度(PAR)为1500 μmol/(m2·s)。与此同时使用 SPAD-502 型叶绿素计测定植株剑叶的SPAD 值(对叶片上、中、下三个部位读数取平均值),每处理重复15 次。
1.8 花粉I2-KI 染色和花粉可染率的计算
在即将开花时,每株系取主穗上3 朵比较一致的小穗,用镊子去除内外颖壳,取出6 个花药并用镊子夹碎置于含1% I2-KI 染液的载玻片上,室温放置5 min,在体视镜下观察突变体和野生型花粉的染色情况,染色浅和形状不规则的视为不育。每张片子观察5 个有较多花粉数目的视野,数出总花粉数和败育花粉数。花粉可染率=(总花粉数–败育花粉数)/总花粉数×100%。
1.9 灌浆速率的测定
自开花至花后30 d,依次取花后3、6、9、12、15、20、30 dossut4突变体材料和野生型的穗。将样品置于烘箱中,105℃下杀青30 min,结束后80℃烘干至恒重,称量籽粒干质量。利用Richards 方程对籽粒灌浆过程进行拟合,计算灌浆速率[16]。

对方程(1)求导,得到灌浆速率R:
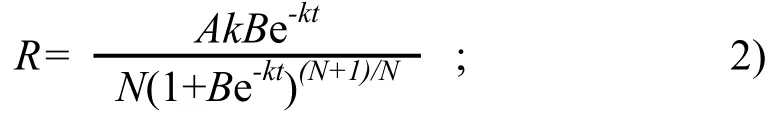
以上算式中,B、k、N均为参数。W代表生长势,即粒重(mg);A代表生长终止量,即最终粒重;t为开花后的天数(d)。
1.10 统计分析
采用Microsoft Excel 2016 对数据进行整理和作图,并用SPSS 25.0 进行统计。通过CurveExpert Pro 对籽粒灌浆过程进行Richards 方程拟合。
2 结果与分析
2.1 OsSUT4 突变对水稻株高、分蘖及产量的影响
OsSUT4基因突变后株高显著降低,与野生型相比,突变体株系sut4-15-1、sut4-15-2和sut4-46的株高分别下降5.8%、6.5%及4.8%(图2、表2)。突变体株系sut4-15-1、sut4-15-2和sut4-46的分蘖数的增幅分别为 9.9%、8.9%及 7.5%(表 2)。和野生型相比,ossut4突变体每穗粒数、结实率、一次枝梗数、二次枝梗数以及千粒重均显著降低,下降幅度分别为22.5%、15.9%、19.6%、19.4%及5.0%。
2.2 OsSUT4 突变对水稻叶片OsSUT1、OsSUT3及OsSUT5 相对表达量的影响
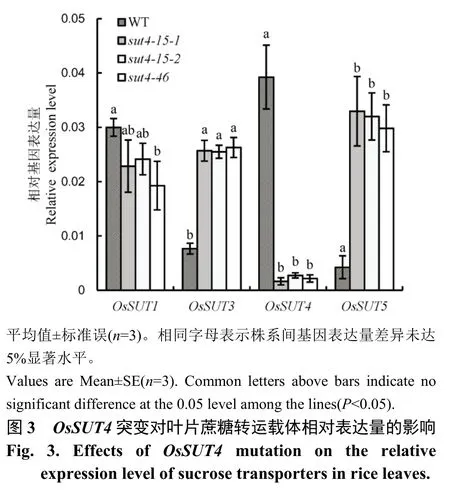
图3 所示,野生型叶片OsSUT4相对表达量最高,显著高于OsSUT1、OsSUT3和OsSUT5;OsSUT4基因突变后其表达量非常低,降幅达 90%以上;OsSUT4突变体植株叶片的OsSUT1相对表达量下降26.3%,但OsSUT3和OsSUT5的相对表达量则显著增加,平均为对照的3.3 和7.5 倍。

图2 OsSUT4 突变对水稻株高的影响Fig. 2. Effects of OsSUT4 mutation on plant height in rice.

表2 OsSUT4 突变对株高和产量构成的影响Table 2. Plant height and yield components of ossut4 mutant and wild type.
2.3 OsSUT4 突变对叶片光合代谢的影响
由图 4 可知,OsSUT4基因突变后,白天结束时3 个突变体株系蔗糖含量显著增加,蔗糖含量最高的突变体株系sut4-15-2较野生型增加7.4%,夜晚结束时其蔗糖含量除sut4-15-1株系外呈上升趋势,其中突变体株系sut4-15-2较野生型增加约8.7%(图 4-A)。OsSUT4突变体中除sut4-46株系外,淀粉含量在白天结束时和夜晚结束时较野生型均显著增加,突变体株系sut4-15-1、sut4-15-2在白天结束时淀粉含量增加7.4%、7.9%,夜晚结束时淀粉含量增加8.2%、5.6%(图4-B)。花后7 d 测定了ossut4突变体株系和野生型的净光合效率,除sut4-46株系,其他两个株系较野生型显著降低(图 4-C),SPAD 值无显著差异(图4-D)。
2.4 OsSUT4 突变对花粉活力的影响
因蔗糖转运对花粉育性和受精率有影响,研究了OsSUT4基因突变后花粉活力的变化。图5-A 分别为野生型和ossut4三个突变体花粉I2-KI 染色情况,可以看出ossut4突变体花粉败育比例更高。由图 5-B 可知,突变体较野生型花粉可染率降低,sut4-15-1、sut4-15-2和sut4-46三个突变体株系分别下降4.9%、6.5%及3.9%。
2.5 OsSUT4 突变对籽粒灌浆的影响
从野生型和ossut4突变体材料的粒重动态(图6-A)和灌浆速率(图6-B)可看出,ossut4突变体材料的粒重始终低于野生型;花后0~10 d 野生型灌浆速率高于ossut4突变体,花后10~25 dossut4突变体的灌浆速率高于野生型,15 d 左右时所有株系灌浆速率达到最大值。花后5~10 d,ossut4突变体籽粒中果糖含量略低于野生型,而10 d 后,ossut4突变体籽粒中果糖含量逐渐增加,并高于野生型;ossut4突变体与野生型籽粒中葡萄糖含量变化趋势与果糖相似。ossut4突变体籽粒中蔗糖含量在花后5~10 d 低于野生型,随着天数的增加,ossut4突变体籽粒中蔗糖含量逐渐升高,而野生型籽粒中蔗糖含量有降低的趋势(图6-C~E)。
2.6 OsSUT4 的亚细胞定位和组织定位分析
通过构建OsSUT4::GFP 融合蛋白,转化水稻原生质体来对OsSUT4进行亚细胞定位。
图7 结果显示,OsSUT4 和GFP 的融合蛋白只在细胞质膜上表达,且与质膜标记 OSMCA1-RFP结果完全重合,表明 OsSUT4 定位在细胞质膜上,具备跨膜转运蔗糖的特征。构建pOsSUT4::GUS转基因材料研究OsSUT4在不同组织中的表达,对营养生长时期的pOsSUT4::GUS植株的叶片、叶鞘、茎、根以及开花期的小穗,灌浆期的颖果进行染色,进一步对浸种萌发的籽粒进行了染色,发现OsSUT4在萌发种子的胚、胚芽鞘的维管束,叶片和根的维管组织,在开花期颖壳、花梗、花药,灌浆期颖果的糊粉层中都有表达,在叶鞘中也检测到GUS 活性(图7)。
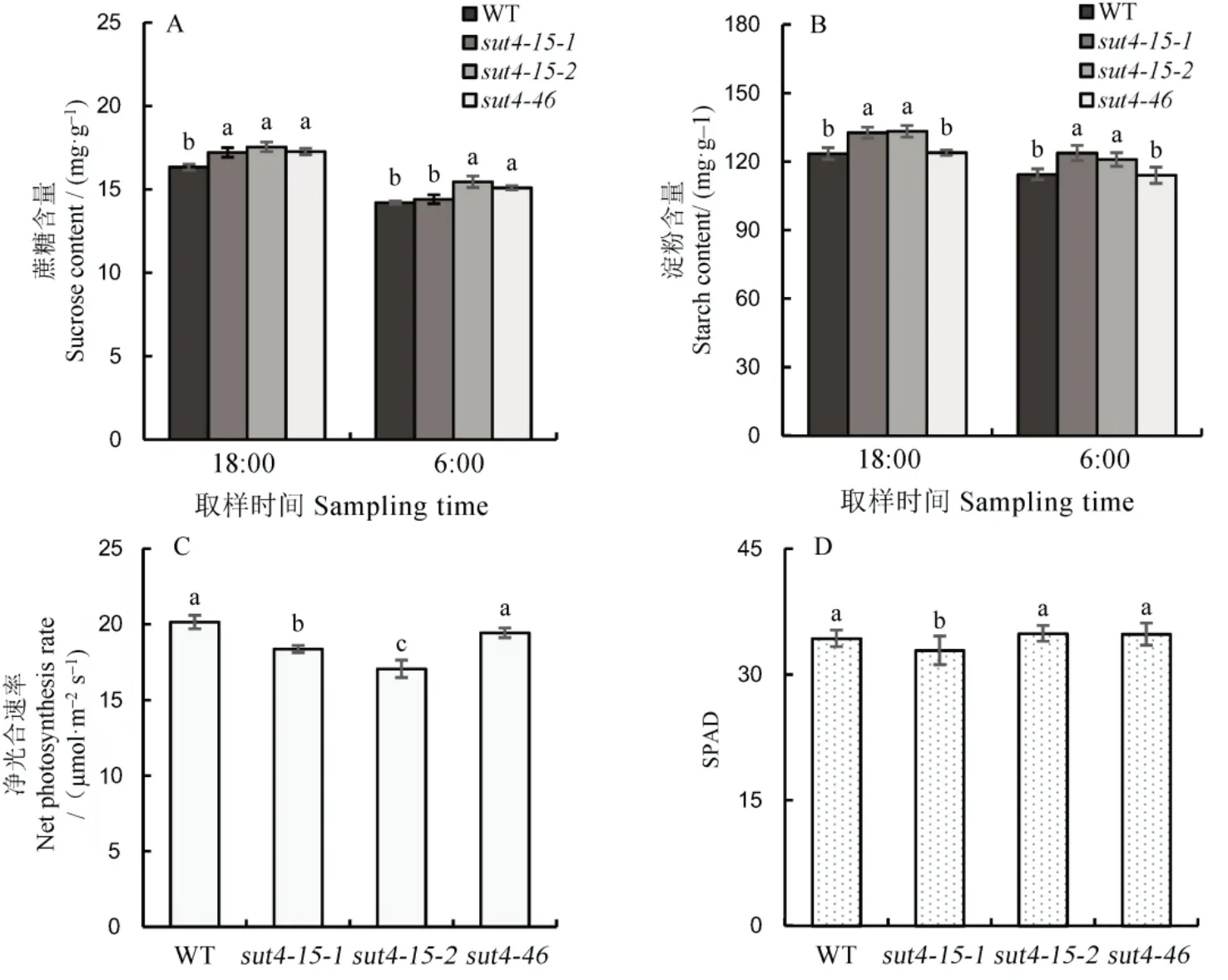
图4 OsSUT4 突变对水稻蔗糖含量、淀粉含量、净光合速率和SPAD 值的影响Fig. 4. Effects of OsSUT4 mutation on sucrose, starch contents, photosynthetic rate and SPAD value in rice leaves.
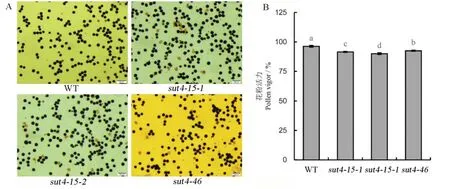
图5 OsSUT4 突变对水稻花粉活力的影响Fig. 5. Effects of OsSUT4 mutation on pollen vigor in rice.
3 讨论
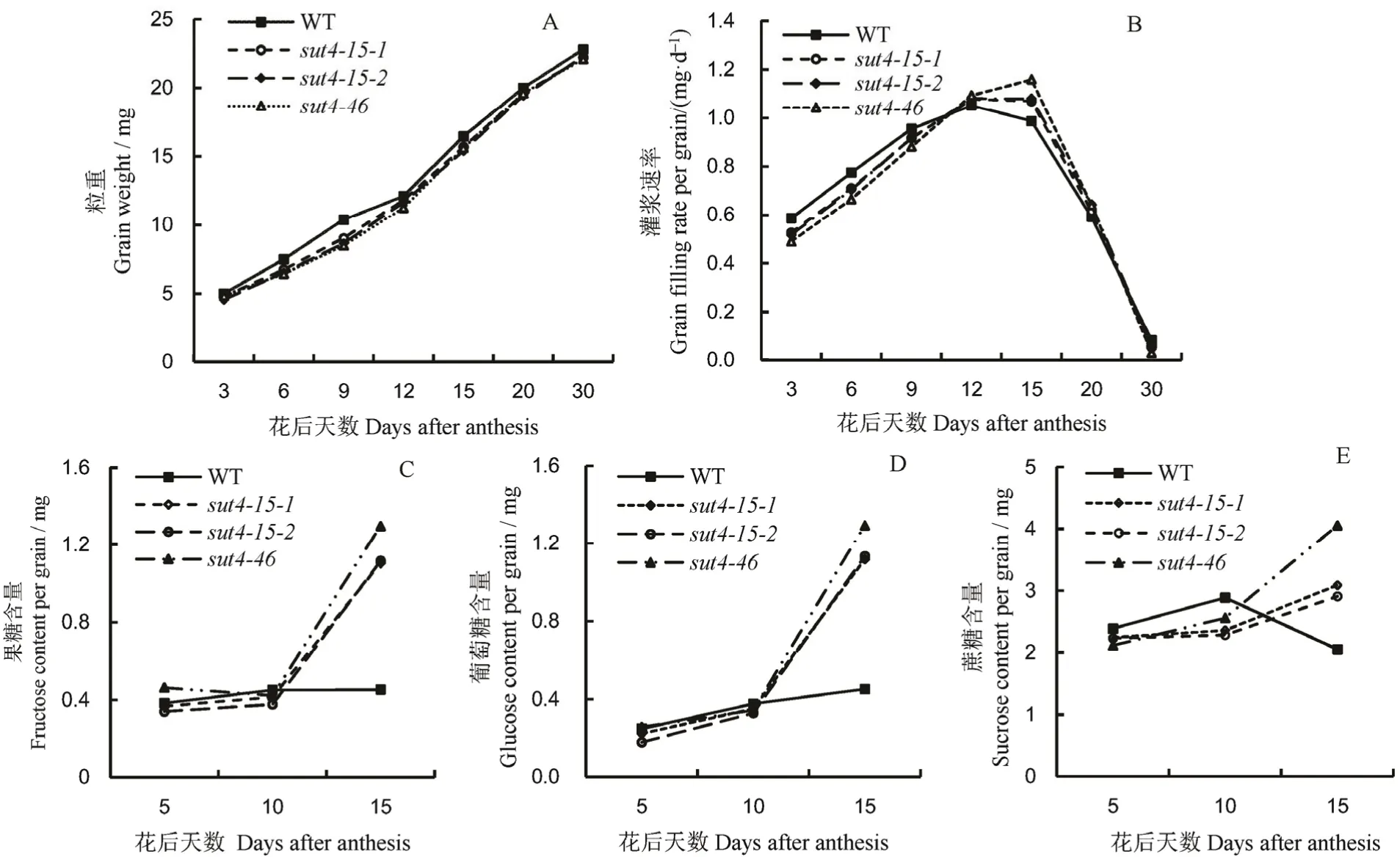
图6 OsSUT4 突变对水稻籽粒灌浆的影响Fig. 6. Effects of OsSUT4 mutation on grain filling in rice.
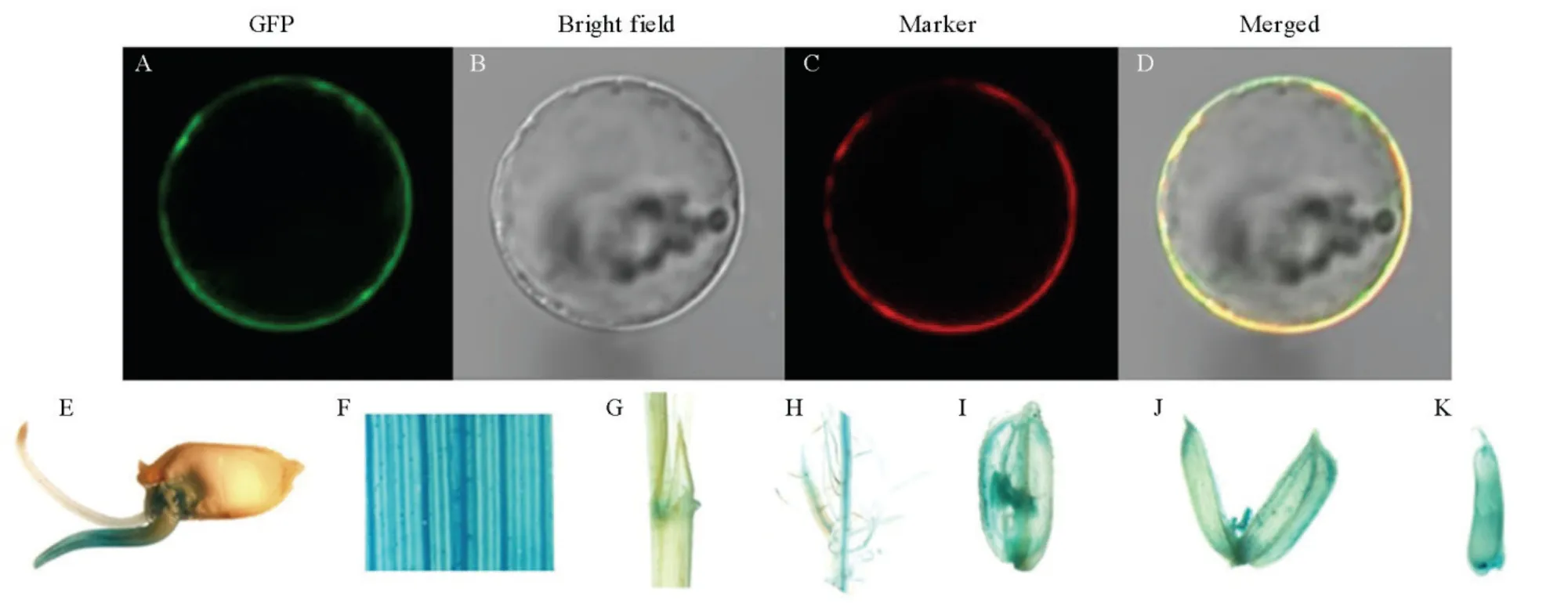
图7 水稻蔗糖转运蛋白OsSUT4 的亚细胞定位(A-D)和组织定位(E-K)Fig. 7. Sub-cellular localization(A-D) of OsSUT4 and tissue expression(E-K) of pOsSUT4::GUS transgenic rice.
蔗糖是作物产量形成的基础,水稻叶片光合作用合成的蔗糖需经源端韧皮部装载、长距离转运、库端卸载进入籽粒合成淀粉形成最终产量。植物体内蔗糖的主动运输主要由SUT 负责完成。水稻基因组中已鉴定出5 个蔗糖转运蛋白。OsSUT1、OsSUT2、OsSUT3 和OsSUT5 的功能已有研究报道,OsSUT4的功能尚不清楚。本研究采用CRISPR/Cas9 基因编辑技术构建了ossut4缺失变体材料,试图揭示它在水稻生长发育过程中的功能。研究发现ossut4突变体植株株高变矮、分蘖数增加,且最终产量降低,表现在每穗粒数、千粒重和结实率降低。ossut4缺失变体表型可能与蔗糖转运、分配有关,进一步研究了源、库端的碳水化合物变化。ossut4缺失变体水稻植株叶片中蔗糖、淀粉出现积累,净光合速率显著降低,出现了典型的韧皮部装载受阻表型[17-18],OsSUT4 的亚细胞定位结果表明其定位在细胞质膜上,具备跨膜转运蔗糖的特征,证明OsSUT4 参与了水稻韧皮部蔗糖装载过程。
蔗糖的装载受到抑制,对库端籽粒灌浆有何影响?从灌浆初期籽粒的灌浆速率和粒重可以看出,ossut4突变体的灌浆速率和粒重低于野生型,这可能与籽粒糖的卸载供应有关。对籽粒灌浆初期蔗糖的含量进行测定,发现ossut4突变体灌浆初期蔗糖含量要低于野生型。推测是由于源端叶片蔗糖的装载受阻,韧皮部转运量减少,到库端籽粒的糖卸载量减少导致灌浆初期籽粒糖供应不足,产量降低。随着灌浆进程的推进,ossut4突变体籽粒中蔗糖出现积累,可能是因其籽粒蔗糖-淀粉转化效率低,库活性低导致,这也是下一步研究关注的重点。
从OsSUT4组织定位结果可以看出,其在萌发种子的胚、胚芽鞘,开花期小穗的颖壳、花梗、花药,灌浆期颖果的糊粉层中都有表达。前人对pOsSUT3::GUS转基因水稻植株的研究证实了OsSUT3在花粉发育中发挥作用[19]。本研究也发现OsSUT4在花粉中有表达,当OsSUT4基因突变后其花粉活力显著下降,影响水稻的受精,导致水稻结实率降低,表明OsSUT4 可能参与了花粉中蔗糖转运。综上所述,OsSUT4 在水稻蔗糖转运过程包括源端装载以及籽粒库端卸载等生理过程中起重要作用。
