一例侵袭性肺曲霉菌病患者的诊治
2020-11-12田银君刘前桂张媛赵黎黎赵双燕吴海玲胡晓凤
田银君 刘前桂 张媛 赵黎黎 赵双燕 吴海玲 胡晓凤
北京老年医院呼吸康复科100095
曲霉是自然界分布最广泛的真菌之一,其孢子大小为2~5μm,易在空气中悬浮并随气流播散,进入人体呼吸道后可以暂时黏附和寄居,如果吸入量大或人体免疫功能损害,可在肺内生长而引起疾病。引起肺曲霉菌病最常见的是烟曲霉,其次为黄曲霉、黑曲霉和土曲霉等。肺曲霉菌病分三大类:侵袭性肺曲霉菌病 (invasive pulmonary aspergillosis,IPA)、慢性曲霉菌病及过敏性曲霉菌病。IPA临床表现严重,若治疗反应不好,可进展为致死性肺炎,是导致患者死亡的主要原因。现将北京老年医院呼吸康复科收治的1例重症IPA 病例报道如下。
1 病例资料
患者男,64岁,因“反复咳嗽、咳痰、喘憋18年,加重20余天”于2018年1月26日入院。患者近18年反复出现咳嗽、咳痰、喘憋,诊断为COPD、肺气肿、肺大疱、矽肺Ⅰ期等。近3年因COPD 急性加重多次住院,经抗感染、化痰、平喘等治疗可好转,院外长期吸入沙美特罗替卡松粉(舒利迭)、噻托溴铵粉(思力华),口服止咳、化痰药物。2018年1月3日患者受凉后再次出现咳嗽、咳痰、喘憋加重,就诊于北京某医院。2018年1月3日胸部CT 示两肺见多发粗大索条影,边缘模糊,肺气肿,多发肺大疱,左肺下叶球形肺不张,双侧胸膜肥厚,右侧胸膜钙化,右肺下叶支气管扩张(图1),考虑肺部感染。住院后给予哌拉西林舒巴坦钠、比阿培南、莫西沙星等抗感染,并给予甲泼尼龙抗炎(具体不详)。患者病情好转,于2018年1月24日出院。出院后按医嘱继续口服醋酸泼尼松40 mg/d。2018年1月26日患者出现发热,体温最高达38 ℃,咳嗽、咳痰、憋喘较前加重,安静状态憋喘,咳痰带鲜红血丝,伴纳差、乏力,无盗汗,无胸痛,无头晕、恶心,来北京老年医院急诊就诊。血常规:白细胞计数23.69×109/L,红细胞计数5.42×1012/L,血红蛋白158 g/L,血小板计数173×109/L,中性粒细胞比例87.3%,淋巴细胞比例5.7%;血气 分 析:p H 值7.45,PaCO2为41.4 mm Hg(1 mm Hg=0.133 k Pa),PaO2为72.2 mm Hg,SaO2为94.5%;血 凝指标、D-二聚体、肌钙蛋白I、肌酸激酶同功酶、B型钠酸肽均正常。2018年1月26日胸部CT 与2018年1月3日比较,双肺新出现散在斑片影及斑点影,伴大小不等空洞,部分空洞周围可见晕征(图2),考虑双肺感染进展,收住北京老年医院呼吸康复科。
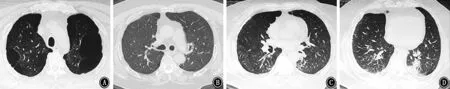
图1 2018年1月3日胸部CT 示两肺见多发粗大索条影,边缘模糊,肺气肿,多发肺大疱,双侧胸膜肥厚,右肺下叶支气管扩张 A:主动脉弓层;B:气管分叉层;C、D:双肺下叶
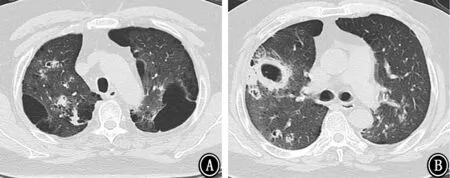
图2 2018年1月26胸部CT 示双肺散在斑片影及斑点影,伴大小不等空洞,部分空洞周围可见晕征 A:主动脉弓层;B:气管分叉层
既往有冠状动脉粥样硬化性心脏病、脂肪肝、高脂血症10余年,长期口服阿司匹林,间断口服降血脂药。2008年患结核性胸膜炎,治疗后遗留胸膜肥厚。2 型糖尿病史10 余年,近1年余皮下注射胰岛素并口服阿卡波糖,近20余天血糖控制不理想,空腹血糖波动于9~18 mmol/L,餐后2 h血糖波动于12~25 mmol/L。40年前有高锰酸钾粉尘接触史4年,2010年经工伤鉴定诊断为矽肺Ⅰ期。吸烟40余年,约20支/d,未戒烟。饮酒史20年,戒酒22年。
入院查体:体温38 ℃,脉搏107 次/min,呼吸频率24次/min,血压96/68 mm Hg;肥胖,憋喘貌,意识清楚,查体合作,口唇轻度发绀,桶状胸,双肺呼吸音低,双肺闻及散在哮鸣音及湿啰音;心界不大,心率107次/min,律齐,各瓣膜听诊区未闻及杂音;腹部查体未见明显异常,双下肢无水肿。
入院诊断:肺部感染,COPD 急性加重,低血氧症,肺气肿,肺大疱,矽肺Ⅰ期,陈旧性结核性胸膜炎,2型糖尿病,冠状动脉粥样硬化性心脏病,脂肪肝,高脂血症。
患者短期内双肺出现散在斑片影及斑点影,伴大小不等空洞,考虑肺部感染性疾病。入院后给予比阿培南(0.6 g,静脉滴注,2次/d)+万古霉素(0.5 g,静脉滴注,每8小时1次)联合抗细菌,继续醋酸泼尼松40 mg/d口服抗炎,并给予多索茶碱静脉滴注、雾化吸入布地奈德及特布他林平喘,氨溴索静脉滴注化痰,皮下注射胰岛素控制血糖等治疗。完善相关检查,ESR 为47 mm/h;C反应蛋白96.10 mg/L;生化:钾4.0 mmol/L,钠131.0 mmol/L,氯96.0 mmol/L,空腹血糖17.0 mmol/L,尿素7.1 mmol/L,肌酐68.0μmol/L,丙氨酸氨基转移酶29.0 U/L,天门冬氨酸氨基转移酶13.0 U/L,乳酸脱氢酶253 U/L,肌酸激酶79 U/L,总蛋白51.1 g/L,白蛋白30.8 g/L。尿常规:葡萄糖++++;血结核菌38k D蛋白阴性,结核菌外膜抗体阳性;结核菌素试验阴性;降钙素原、抗链球菌O、类风湿因子、自身抗体系列、肿瘤相关抗原系列、粪常规均正常。术前四项(乙肝表面抗原、丙肝抗体、人类免疫缺陷病毒抗体、梅毒血清特异性抗体)阴性。心电图大致正常。心脏超声:主动脉瓣钙化,左室后壁运动幅度稍减低,左室舒张功能减低。腹部超声:脂肪肝,余未见异常。肺功能:第1秒用力呼气容积/FVC 为43.22%,第1秒用力呼气容积占预计值百分比为24.9%,提示阻塞性通气功能障碍,小气道功能障碍,残气量/肺总量轻度增高,弥散功能重度减低。痰涂片找抗酸杆菌阴性(3 次)。患者入院当日(2018年1月26日)发热,最高体温达38 ℃;1月27日体温正常;1月28日再次发热,最高体温达38.1 ℃;1月29日之后未再发热,憋喘较前略好转,痰中带血减少。1月29日痰涂片:革兰阳性球菌可见;痰真菌培养:白色假丝酵母菌+。1 月30 日 血1,3-β-D 葡 聚 糖 检 测(G 试 验):247.3μg/L(升高);血常规:白细胞计数12.56×109/L,红细胞计数5.00×1012/L,血红蛋白143 g/L,血小板计数179×109/L,中性粒细胞比例85.3%,淋巴细胞比例7.6%;C 反应蛋 白55.10 mg/L;血 气 分 析:p H 值7.43,PaCO2为48.4 mm Hg,PaO2为81.6 mm Hg,SaO2为95.8%。入院后每日皮下注射胰岛素累积剂量56 IU。1月26日至1月30日血糖控制不理想,空腹血糖波动于11~18 mmol/L,早餐及午餐后2 h血糖波动于10~18 mmol/L,晚餐后2 h血糖波动于15~21 mmol/L。患者痰检见白色假丝酵母菌+,G试验轻度增高(近期有应用哌拉西林舒巴坦钠史,不排除干扰),近期有糖皮质激素应用史,血糖控制欠佳,综合以上因素,考虑肺真菌感染不排除。1 月30 日给予伏立康唑200 mg口 服 抗 真 菌,每12 小 时1 次(第1 个24 小 时400 mg/次),同时减量醋酸泼尼松为30 mg/d。2月2日痰真菌培养:曲霉菌属+(2次),白色假丝酵母菌+,进一步支持真菌感染,建议行气管镜检查,患者因喘憋不适,一直不同意。之后又有2次痰培养:曲霉菌属1~2个菌落。2月5日患者憋喘较重,复查血常规:白细胞计数23.32×109/L,红细胞计数5.22×1012/L,血红蛋白151 g/L,血小板计数208×109/L,中性粒细胞比例92.2%,淋巴细胞比例3.7%;C 反应蛋白229.80 mg/L;血 气 分 析:p H 值7.44,PaCO2为47.3 mm Hg,PaO2为82.3 mm Hg,SaO2为95.7%,提 示 感染加重。2月5日伏立康唑改为0.3 g,静脉滴注,每12小时1次。2月6日胸部CT 示双肺散在斑片影及斑点影,伴大小不等空洞,与1月26日胸部CT 比较右肺上叶空洞增大,右肺上叶病变进展(图3)。继续伏立康唑静脉滴注抗真菌,比阿培南联合万古霉素抗细菌治疗。2月12日胸部CT 示右肺上叶空洞较2月6日进一步增大(图4)。2月12日血气 分 析:p H 值7.45,PaCO2为57.2 mm Hg,PaO2为78.3 mm Hg,SaO2为95.1%。经反复动员,2月13日患者同意气管镜检查,结果(图5)示主气管黏膜表面可见白色分泌物附着;左上叶支气管黏膜充血明显,可见大量脓性分泌物;右上叶支气管各叶段开口变窄,以右上叶尖段开口变窄明显;右上叶支气管黏膜充血水肿明显,活检或刷检易出血。气管镜刷片及灌洗液病理见少许坏死物及中性粒细胞,未见肿瘤细胞。支气管镜肺活检(右上叶)病理:送检肺组织慢性炎,肺间质可见单核细胞浸润,纤维组织增生,肺泡上皮增生,肺组织表面附着成团的坏死物,坏死物中可见真菌菌丝及孢子。气管镜刷片培养:曲霉菌属1个菌落;气管镜后痰培养:曲霉菌属4个菌落。患者IPA 诊断依据充足,应用伏立康唑效果差,2月14日改为两性霉素B脂质体静脉滴注,从10 mg/d始,逐日递增,增至150 mg/d时患者精神萎靡、憋喘、乏力、纳差、尿少、肾功能异常,尿素18.5 mmol/L,肌酐166μmol/L,总蛋白45.6 g/L,白蛋白26.9 g/L。2月18日血 气 分 析:p H 值7.38,PaCO2为55.4 mm Hg,PaO2为72.4 mm Hg,SaO2为93.5%。考虑患者对该药不良反应较大,停用两性霉素B 脂质体。2 月19 日给予伏立康唑(0.3 g,静脉滴注,每12小时1次)联合卡泊芬净(50 mg/d,静脉滴注)抗曲霉菌治疗。2月20日后患者多次血气分析示PaCO2升高,波动于56~79 mm Hg,PaO2低,波动于50~80 mm Hg,给予保肾、人血白蛋白支持、无创呼吸机辅助通气等治疗。口服泼尼松经逐渐减量,于2月17日后停用。住院期间患者一直纳差,进食量少,尽管每日皮下注射胰岛素累积剂量60 IU,但血糖仍控制不理想,空腹血糖波动 于12 ~20 mmol/L,餐 后2 h 血 糖 波 动 于14 ~26 mmol/L;自停用泼尼松后,血糖逐渐好转,空腹血糖波动于8~10 mmol/L,餐后2 h血糖波动于11~14 mmol/L。3月6日血气分析:p H 值7.35,PaCO2为55.4 mm Hg,PaO2为72.4 mm Hg,SaO2为93.5%。3 月6 日胸部CT 示双肺多发空洞,右肺上叶空洞较前增大,双肺病变继续进展(图6)。治疗效果不理想,家属要求转院。
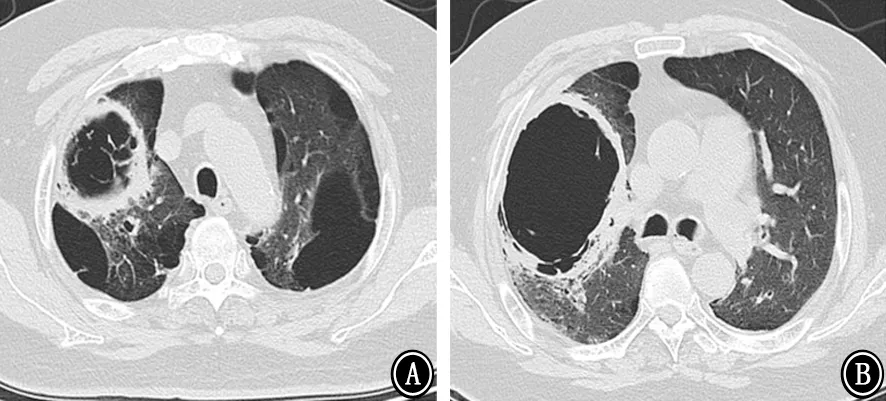
图3 2018年2月6日胸部CT 示右肺上叶空洞较前明显增大,右肺上叶病变进展 A:主动脉弓层;B:气管分叉层
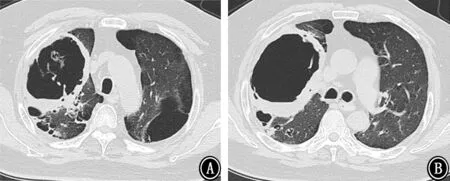
图4 2018年2月12日胸部CT 示右肺上叶空洞较2018年2月6日进一步增大,右肺上叶病变进展 A:主动脉弓层;B:气管分叉层
3月9日患者转院至北京某知名医院分院,多次痰培养见曲霉菌,考虑IPA 诊断明确,先后给予哌拉西林钠他唑巴坦钠、美罗培南、利奈唑胺抗细菌,同时静脉滴注伏立康唑、卡泊芬净联合两性霉素B雾化吸入抗真菌,并给予补充白蛋白、控制血糖、无创呼吸机辅助通气等支持治疗,效果差。2018年3月22日复查胸部CT 示双肺空洞仍较前扩大,且双肺新出现多发实变渗出影(图7),患者仍憋喘、衰弱、不能下地活动,精神极差。2018年3月27日患者再次转院至北京另一知名医院,痰真菌培养:烟曲霉。血半乳甘露聚糖检测(GM 试验):0.65μg/L(升高)。结合病史资料,对IPA 诊断无异议,给予两性霉素B 30 mg/d静脉滴注(60 d,累积总量1.8 g)、卡泊芬净50 mg/d静脉滴注(46 d)联合泊沙康唑混悬液200 mg口服4次/d(6个月)抗真菌治疗,并给予控制血糖、对症等治疗,患者病情逐渐好转。2018 年4 月16日胸部CT(图8)示双肺感染,部分形成空洞,空洞内见条状及结节影,与2018年3月22日胸部CT 对比病变吸收好转。2018年5月25日复查胸部CT(图9)示右肺薄壁空洞,双肺散在炎性病变,较2018年4月16日胸部CT 好转。患者目前活动自如,日常生活可自理。2020 年3 月2 日胸部CT(图9)示右肺薄壁空洞,较前明显缩小。
2 讨论
曲霉为条件致病菌,在免疫受损宿主中易引起机会性感染。以往关注的免疫受损人群多为造血干细胞移植、实体器官移植、肿瘤化疗、人类免疫缺陷病毒感染等,因为这些患者的免疫低下原因明确,容易想到真菌感染,而对于慢性病合并侵袭性肺真菌感染的警惕性不够。资料[1]表明,年龄因素(>65岁)、COPD、糖尿病、长期应用广谱抗生素、大量糖皮质激素(简称激素)等均是侵袭性肺真菌感染的高危因素。大量激素是COPD 患者发生曲霉菌病的独立危险因素,研究报道COPD 合并IPA 的患者70%以上接受过长期激素治疗[2]。激素可以抑制Th1型细胞因子、增加Th2型细胞因子的产生,从而降低机体对曲霉菌的抵抗力;激素可抑制中性粒细胞和单核/巨噬细胞的吞噬功能,干扰其杀死孢子和菌丝[3];体外试验表明,激素可以使真菌的生长速度提高30%~40%[4]。回顾性分析发现,每日泼尼松剂量>20 mg或累积剂量>700 mg的COPD 患者感染曲霉菌的概率升高[5]。高血糖同样是IPA 的高危因素,高血糖状态下,血液渗透压增高,抑制了中性粒细胞的吞噬功能,使机体抵抗力降低;高糖环境促进了真菌的生长繁殖,清除功能的降低和有利的生长环境使糖尿病患者易继发真菌感染[6-7]。本例患者同时存在COPD 及糖尿病,本次发病后有激素及广谱抗菌素应用史,且血糖控制欠佳,诸多的易感因素导致IPA发病。
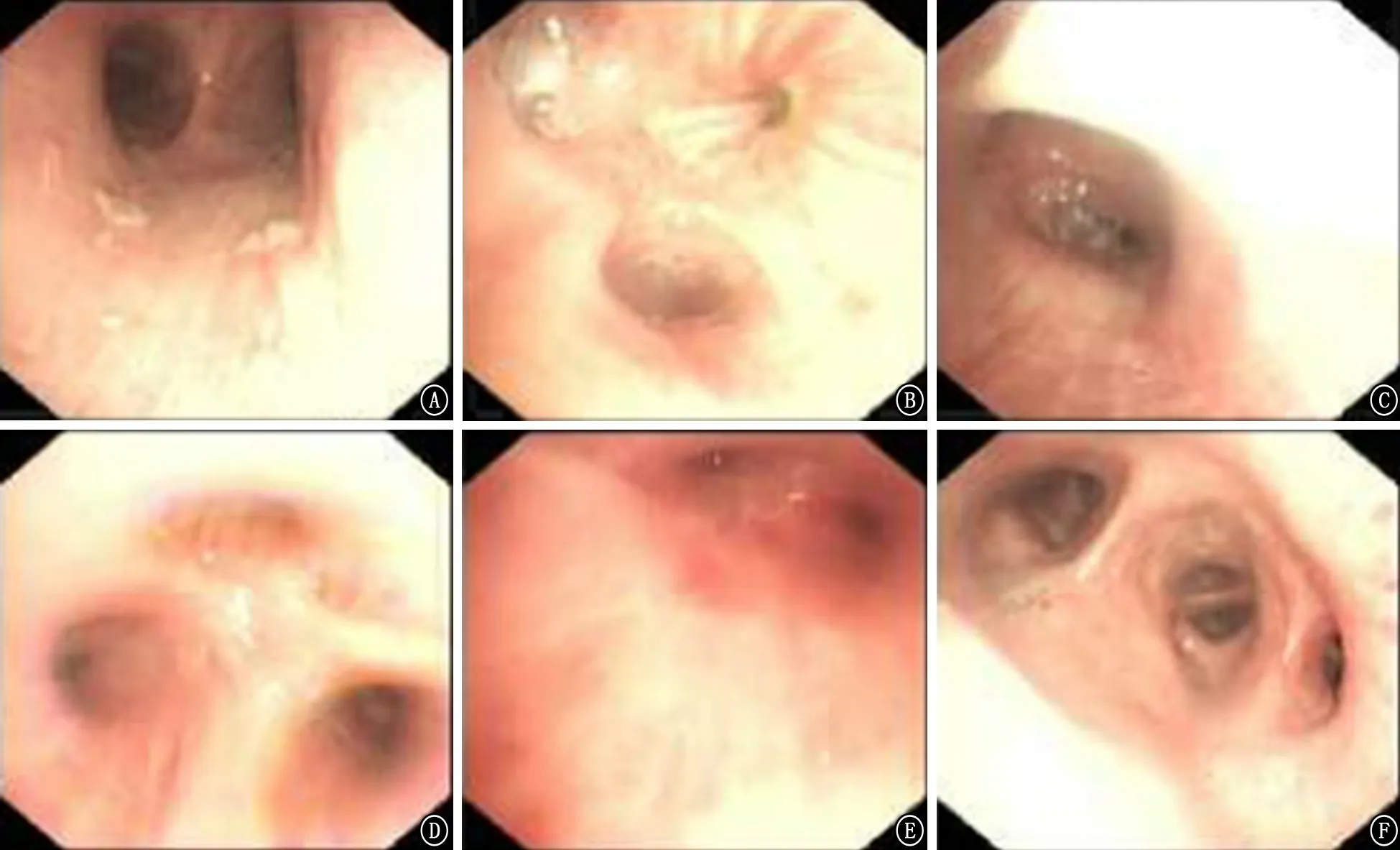
图5 2018年2月13日气管镜检查结果 A:主气管及隆突;B、C:左上叶;D:右上叶;E:右上叶尖段;F:右中下叶
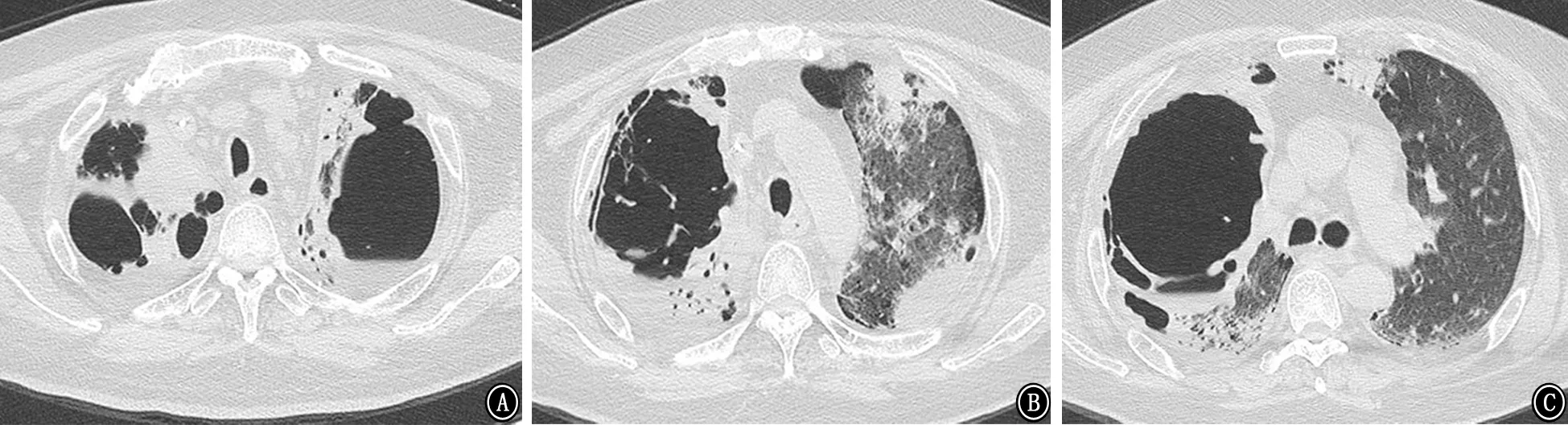
图6 2018年3月6日胸部CT 示双肺多发空洞,右肺上叶空洞较前增大 A:主气管层;B:主动脉弓层;C:气管分叉层
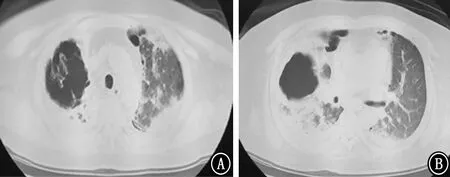
图7 2018年3月22日胸部CT 示双肺空洞较前扩大,双肺新出现多发实变渗出影 A:主动脉弓层;B:双肺下叶
IPA 的影像学特点为早期出现多发密度增高的结节影,周围可见晕征。晕征为最具提示性的CT 表现,为围绕结节周围的略低于结节密度而又高于肺实质密度的环行带状区,不典型时表现为结节边缘模糊毛糙。其病理基础是出血性肺梗死引起结节中心的凝固性坏死,相邻肺泡出血使结节周围可见出血性边缘。新月形空气征、实变区域内出现空腔等也是较典型CT 表现,但并非早期征象。在免疫功能低下患者,病变进展迅速,可出现大片实变。关于COPD 合并IPA,Samarakoon和Soubani[8]报道其CT 表现主要为非特异性渗出和实变影,两者所占比例为63%,空洞占20%,单发或多发结节影占6%。是否出现上述典型影像特征,取决于基础疾病、病程阶段、免疫状态。回顾本患者多次胸部CT,有结节影、晕征、空洞等,影像表现较为典型,因此在影像学出现以上表现时应警惕IPA,多思考并鉴别诊断,避免漏诊或误诊。
半乳甘露聚糖是大部分曲霉菌细胞壁的重要成分,当曲霉菌侵入深部组织或进入血液时,半乳甘露聚糖从其细胞壁中释放入体液,因此通过血液检测曲菌抗原便成为判断真菌感染的一个重要方法。2016 年美国感染病学会(Infectious Diseases Society of America,IDSA)[9]建议对于高危人群如血液系统恶性肿瘤及造血干细胞移植患者,以血清和肺泡灌洗液的GM 试验作为侵袭性曲霉感染的精确诊断标志物。但在非粒细胞缺乏患者中血GM 试验存在局限性,常遇到假阳性或假阴性结果,使临床决策陷入僵局。近期研究[10]显示,肺泡灌洗液GM 试验对IPA 的敏感度、特异度明显优于血清,有利于早期诊断。但由于条件限制,GM 试验并不能在各级医院中广泛开展。
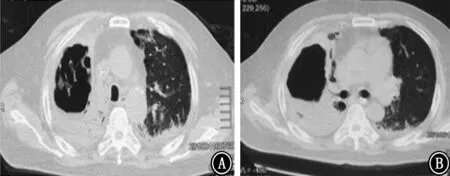
图8 2018年4月16日胸部CT 示双肺感染,部分形成空洞,与2018年3月22日胸部CT 对比,病变吸收好转 A:主动脉弓下;B:气管分叉下
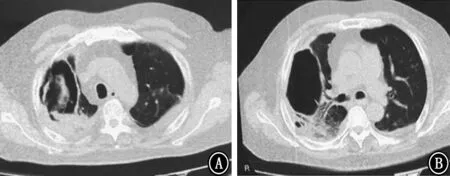
图9 2018年5月25日胸部CT 示右肺薄壁空洞,双肺散在炎性病变,较2018年4月16日胸部CT 好转 A:主动脉弓层;B:气管分叉下
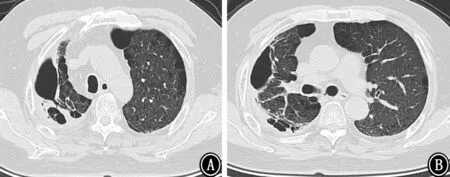
图10 2020年3月2日胸部CT 示右肺薄壁空洞,较前明显缩小 A:主动脉弓层;B:气管分叉下
肺曲霉菌病起病隐匿,缺乏特异的临床表现,影像表现多样,易被误诊为肺结核、肺炎、肺癌等。2016年IDSA 指出“组织病理学和无菌部位的真菌培养结果”是确诊曲霉菌病的标准。本病例IPA 危险因素明确,多次合格痰标本见曲霉菌生长,气管镜刷片培养见曲霉菌属,气管镜下支气管黏膜活检病理可见真菌菌丝及孢子,因此IPA 诊断明确。
IPA 治疗的关键在于尽早诊断、及时治疗、尽早应用抗真菌药并改善免疫缺陷状态。2016年IDSA 推荐[9]IPA 治疗的药物包括三唑类(伊曲康唑、伏立康唑、泊沙康唑、艾沙康唑)、多烯类(两性霉素B及其脂质体)和棘白菌素类(米卡芬净或卡泊芬净)。伏立康唑为IPA 首选治疗药物。无法应用伏立康唑以及曲霉菌感染初始治疗无效时可采用两性霉素B及其脂质体进行补救治疗。对中性粒细胞长期减少的患者及肺移植受者可考虑使用两性霉素B 雾化吸入进行预防性治疗。棘白菌素类也是IPA 补救治疗的有效药物(单用或联合用药),但不建议用于IPA 常规单药治疗。多烯类或唑类药物与棘白菌素类联合应用可发挥协同或加强作用。补救药物的调整可在当前方案中添加其他抗真菌药,或联合使用与初始治疗方案类别不同的抗真菌药。选用药物包括两性霉素B脂质制剂、米卡芬净、卡泊芬净、泊沙康唑或伊曲康唑。IPA 的疗程至少6~12周。
本例患者考虑到IPA 诊断后,立即给予伏立康唑,15 d后疗效不佳;改为两性霉素B 脂质体治疗,因不良反应大而被迫停用;根据IDSA 推荐,病情危重患者推荐联合用药,因此选择伏立康唑联合卡泊芬净,16 d后胸部CT 仍示病变进展。患者转院至北京某知名医院分院,考虑IPA 诊断无误,继续给予伏立康唑及卡泊芬净并联合两性霉素B雾化吸入,效果仍不佳。患者IPA 早期治疗效果不佳,分析原因可能为:全身激素未停用、广谱抗菌素的应用、血糖控制不佳、肥胖、低蛋白血症、肺部病变范围广、患者免疫低下等。IPA 治疗效果不佳,曲霉菌的内毒素作用使肺血管形成出血性肺梗死,造成组织坏死、坏死性血管炎,影像表现为浸润、实变、空洞、支气管周围炎等病变持续进展。最后患者再次转院至北京另一家知名医院,在前期治疗的基础上,考虑患者应用伏立康唑效果差,应用两性霉素B 脂质体不良反应大,联合应用伏立康唑及卡泊芬净也未起到良好效果,因此选择两性霉素B、卡泊芬净联合泊沙康唑三联强化治疗,病情逐渐好转。泊沙康唑是一种新型三唑类抗真菌药,临床用于治疗曲霉菌等引起的难治性、对其他药物不耐受或耐药的真菌感染。卡泊芬净为棘白菌素类抗真菌药,不良反应发生率低于两性霉素B,对传统药物治疗无效或不耐受的侵入性曲霉菌病患者,卡泊芬净是一种较为安全的替代药。该患者早期应用两性霉素B脂质体不良反应大,可能与短期内增量较快有关,因此转院后应用两性霉素B时从小剂量开始,最后选择患者能耐受的30 mg/d维持。联合应用抗真菌药可能有以下好处[1]:(1)由于不同药物的作用机制和作用靶位不同,联合用药可产生协同或相加效应,或者可以更快地产生抑菌或杀菌效应;(2)可以减少真菌发生继发耐药的机会;(3)可以减少毒性较大的药物的剂量,从而降低药物不良反应的发生率。
本例患者病情危重,患者多次转院,最终应用三联抗真菌治疗病情才得以控制,治疗过程较为艰辛曲折,病情好转来之不易。警示临床医师,COPD 合并糖尿病患者出现肺部感染等病情急性加重时,慎用糖皮质激素,尽量给予最小剂量、最短疗程,尽量保持血糖良好控制,警惕出现IPA。
利益冲突所有作者均声明不存在利益冲突
