芪归方有效组分治疗特发性肺纤维化的实验研究
2020-11-02彭艳芳张莹雯张亚兵
彭艳芳 张莹雯 张亚兵


摘要 目的:基于Smurf2串话TGF-β1/Smad信号通路研究芪归方有效组分对转化生长因子β1(TGF-β1)诱导人胚肺成纤维细胞MRC-5的影响及机制。方法:体外予以10 ng/mL TGF-β1培养MRC-5细胞,PCR仪检测α-SMA的mRNA水平判断模型是否成功。设立正常对照组、模型组(10 ng/mL TGF-β1处理)、泼尼松处理组、芪归方有效组分高剂量组、中剂量组、低剂量组,采用CCK-8法检测MRC-5的增殖情况,Western blot检测各组细胞Smad7、SnoN蛋白的表达水平,RT-PCR检测各组细胞Smurf2的mRNA水平。结果:与正常对照组比较,48 h模型组细胞增殖明显,α-SMA的mRNA水平增加(P<0.01),造模成功。经10 ng/mL TGF-β1处理细胞MRC-5,与正常对照组比较,Smad7、SnoN蛋白水平显著降低,Smurf2蛋白mRNA水平升高(P<0.01或P<0.05)。不同浓度芪归方有效成分处理組细胞增殖降低,可逆转以上各指标的改变,呈一定的量效关系。结论:芪归方有效组分能抑制MRC-5细胞增殖,可通过减少MRC-5细胞中Smurf2所介导的Smad7、SnoN的泛素化,恢复Smad7、SnoN蛋白的表达,从而调节肺纤维化的发生发展。
关键词 芪归方有效组分;Smad泛素化调节因子2;Smad蛋白;核转录共抑制因子;特发性肺纤维化
Abstract Objective:Based on Smurf2 crosstalk TGF-β1/Smad signaling pathway to study the effect and mechanism of Qigui Fomula active components on transforming growth factor β1 (TGF-β1)-induced human embryo lung fibroblast MRC-5. Methods:MRC-5 was cultured with 10 ng/mL TGF-β1 in vitro, mRNA level of α-SMA was detected by PCR instrument to judge whether the model was successfully made. Normal control group, model group (10 ng/mL TGF-β1 treatment), prednisone treatment group, high-dose group, middle-dose group and low-dose group of effective components of Qigui Fomula were set, CCK-8 method was used to detect the proliferation of MRC-5, Western blot was used to detect the expression level of Smad7 and SnoN protein in each group, and RT-PCR was used to detect the mRNA level of Smurf2 in each group. Results:Compared with the normal control group, the 48 h model group had significant cell proliferation, and the mRNA level of α-SMA increased (P<0.01), and the modeling was successful. Compared with the normal control group, MRC-5 treated with 10 ng/mL TGF-β1 showed that Smad7 and SnoN protein levels were significantly reduced and Smurf2 protein mRNA levels were increased (P<0.01 or P<0.05). The cell proliferation of the Qigui Foluma group with different concentrations was reduced, which could reverse the changes of the above indicators and showed a certain dose-effect relationship. Conclusion:The effective components of Qigui Foluma can inhibit the proliferation of MRC-5 cells, and can reduce the ubiquitination of Smad7 and SnoN mediated by Smurf2 in MRC-5 cells, restore the expression of Smad7 and SnoN proteins, and thereby regulate the occurrence of pulmonary fibrosis development.
Keywords Effective Component of Qigui Foluma; Smad ubiquitination regulator 2; Smad protein;Nuclear transcription co-suppressor; Idiopathic pulmonary fibrosis
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.12.009
特发性肺纤维化(Idiopathic Pulmonary Fibrosis,IPF)是一种病因不明,以肺泡间质炎性细胞浸润、成纤维细胞异常增殖和胶原蛋白沉积为特征的免疫介导的慢性进行性纤维化性间质性肺炎,好发于中老年男性,主要表现为干咳、进行性加重的呼吸困难,伴限制性通气功能障碍和气体交换障碍,导致低氧血症,患者最终因呼吸衰竭而死亡[1-2]。我国IPF发病率呈较快上升趋势,尽管近年来我们对IPF发病机制的认识和治疗有了一定的进展,但目前除了肺移植及长期氧疗,尚无疗效确切的治疗手段,该病给社会、家庭、患者带来了严重的压力和经济负担。中医药[3]在防治IPF上的研究亦日趋增多,积累了宝贵的经验,能起到缓解临床症状和减轻患者服用激素等后出现的不良反应,显示了良好的应用前景,日益受到国内外学者的重视。
文献研究发现,气虚血瘀是IPF常见的证候特征,益气活血是该病的基本治法,采用中药治疗IPF的药物多具有补气益肺、化痰止咳、活血化瘀等功效,而黄芪、当归及其药效成分则是相关研究的热点,我们前期以芪归方治疗IPF进行了临床和实验研究[4],提示芪归方联合泼尼松治疗特发性肺纤维化,可以明显改善IPF患者症状,抑制TNF-α、转化生长因子β1(Transforming Growth Factor β1,TGF-β1)等炎性反应因子表达;芪归方可通过调控miRNA及其TGF-β1信号通路而改善特发性肺纤维化。但中药复方成分复杂,不易进行质控,中药有效单体成分的药理作用更明确,故本研究在现代医学技术和研究方法的指导下,进行体外实验,以TGF-β1刺激人胚肺成纤维细胞MRC-5为研究对象,观察芪归方有效组分能否通过调节Smad泛素化调节因子2(Smad ubiquitin regulatory factor2,Smurf2)所介导的Smad7、核转录共抑制因子SnoN(Ski-related novel protein N)的泛素化,影响TGF-β1/Smad通路继而发挥抗肺纤维化作用,为肺纤维化的治疗提供新的方向。
1 材料
1.1 细胞与药物 MRC-5人胚肺成纤维细胞使用1株,购自武大细胞库。芪归方有效组分(黄芪甲苷,含量>98%,分子式C41H68O14,分子量784.97;阿魏酸,含量>99%,分子式C10H10O4,分子量194.19)均购自上海哈灵生物科技有限公司,常温避光防潮保存。
1.2 仪器 CO2恒温培养箱(3111型,美国Thermo公司);超净工作台(SW-CJ-1D型,苏州净化设备有限公司);荧光定量PCR仪(CFX-Connect 96型,Bio-Rad公司);高速冷冻离心机(Icen-24R型,杭州奥盛设备有限公司);超微量分光光度计(Nano-300型,杭州奥盛设备有限公司);酶标仪(AMR-100型,杭州奥盛设备有限公司);倒置荧光显微镜(DMIL LED型,Leica公司);全自动化学发光分析仪(Tanon-5200型,上海天能设备有限公司);电泳仪(mini protean 3 cell型,BIO-RAD公司)。
1.3 试剂 MEM(Gibco公司,批号:c11095500bt);胎牛血清(Gibco公司,批号:10270-106);CCK8(Solarbio公司,批号:CA1210);TGF-β1(Abcam公司,批号:ab92486);α-SMA(Bioswamp,批号:PAB35136);Smad7(Bioswamp,批号:PAB30992);SnoN(Bioswamp,批号:PAB41857);Smurf2(Bioswamp,批号:PAB37109);BCA蛋白浓度测定试剂盒(Solarbio,批号:PC0020)。
2 方法
2.1 TGF-β1诱导人胚肺成纤维细胞MRC-5肺纤维化模型的构建
2.1.1 细胞培养 将MRC-5细胞培养在含10%胎牛血清的MEM/EBSS培养基中,加入105 U/L的青霉素和100 g/L的链霉素,并置于37 ℃,5%CO2的无菌培养箱中培养,5~7 d传代,以1∶2的比例进行。
2.1.2 特发性肺纤维化模型的构建 将MRC-5细胞以1×105/L的密度分于6孔板,每孔加入2 mL培养基,置37 ℃、5% CO2培养箱中培养过夜,使细胞贴壁。正常组换正常培养基,模型组细胞培养基中加入终浓度为10 ng/mL的TGF-β1,继续培养24 h、48 h、72 h后收取细胞样品。使用TRIzolTM Plus RNA Purification Kit进行RNA抽提,测定RNA浓度及纯度,并用反转录试剂Rever Tra Ace Qrcr RT Master Mix按照1 μg/10 μL体系进行逆转录;之后以GAPDH为内参,于qRT-PCR仪检测α-平滑肌肌动蛋白(α-smoothmuscleactin,α-SMA)的mRNA表達水平,α-SMA引物:F:GGTGATGGTGGGAATGG,R:CAGGGTGGGATGCTCTT;产物长度187 bp。GAPDH引物:F:CCACTCCTCCACCTTTG,R:CACCACCCTGTTGCTGT;产物长度106 bp。PCR引物由武汉天一辉远生物科技有限公司合成。
2.2 药物干预和分组 根据预实验结果,设立正常对照组、模型组即10 ng/mL TGF-β1处理组、芪归方有效组分低剂量组即10 ng/mL TGF-β1联合药物(黄芪甲苷30 μmol/L+阿魏酸20 μmol/L)处理组、芪归方有效组分中剂量组即10 ng/mL TGF-β1联合药物(黄芪甲苷60 μmol/L+阿魏酸40 μmol/L)处理组和芪归方有效组分高剂量组即10 ng/mL TGF-β1联合药物(黄芪甲苷120 μmol/L+阿魏酸80 μmol/L)处理组、泼尼松对照组即10 ng/mL TGF-β1联合泼尼松1 umol/L处理组。每组设3个复孔,加药后充分混匀,培养48 h。
2.3 CCK-8法检测细胞增殖 收集细胞,调整细胞悬液浓度,分于96孔板,3×103个细胞/孔,每孔100 μL,置37 ℃、5%CO2培养箱中培养过夜,使细胞贴壁。按照不同分组处理细胞,继续培养48 h。取出细胞培养板,向每孔加入10 μL CCK8溶液,继续培养4 h。在酶联免疫检测仪450 nm处测量各孔的吸光值。同时设置调零孔(培养基、CCK8),对照孔(细胞、相同浓度的药物溶解递质、培养基、CCK8),每组设定3复孔。计算各组细胞的相对增殖率。
2.4 Western blot检测各组细胞Smad7、SnoN蛋白的表达水平 将需要抽提的蛋白的细胞从培养箱中取出,吸去培液,适量预冷的1×PBS洗涤2次,吸去PBS,低温高速离心,提取上清总蛋白。BCA蛋白定量试剂盒测定细胞蛋白浓度。取等量的总蛋白行SDS-PAGE凝胶电泳,并转至PVDF膜上。5%脱脂奶粉室温封闭4 ℃过夜,分别加入1∶1 000稀释的兔抗Smad7抗体、兔抗SnoN抗体;孵育一抗的膜用PBST洗涤3次,按照1∶10 000稀释HRP标记的二抗,与膜室温孵育1 h。将膜放置在暗室中,根据用量取ECL发光液A和B等量混匀,加在膜的正面与之充分接触。然后将膜置于全自动化学发光分析仪中检测,通过TANON GIS软件读取相关条带灰度值。
2.5 RT-PCR检测各组细胞Smurf2的mRNA水平 收集各组细胞,去除培养基;采用TRIzol法提取总RNA,按说明书操作并逆转录获得cDNA。并溶解于无RNase的水中,将制备好的cDNA进行PCR扩增,Smurf2引物:F:CTCGGTTGTGTTCGTCT,R:CTCCCATTGCGTAGTTC,扩增片段大小为279bp;GAPDH引物:F:CCACTCCTCCACCTTTG,R:CACCACCCTGTTGCTGT,扩增片段大小为106;扩增条件为55 ℃ 2 min;95 ℃ 30 s;95 ℃ 30 s;60 ℃ 60 s,循环40次;根据公式2-△△CT计算各组不同目的基因表达量。实验重复3次,反应结束后进行软件分析。
2.6 统计学方法 采用SPSS 25.0统计软件和GraphPad5.0软件进行图表制作,计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间比较采用t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 TGF-β1诱导MRC-5细胞纤维化模型检测 以10 ng/mL TGF-β1诱导MRC-5细胞纤维化模型,干预时间分别为24 h、48 h、72 h,通过实时定量PCR仪分别检测α-SMA这个特异性纤维化指标的mRNA相对表达水平,比较干预不同时间的效果差别,结果如图1所示:α-SMA的mRNA相对表达水平在48 h出现显著升高(P<0.01),在72 h较48 h稍有下降(P<0.01),可见MRC-5细胞在TGF-β1诱导下48 h时出现充分纤维化,说明48 h时此模型诱导成功。
3.2 各组细胞增殖情况比较 芪归方有效组分可抑制TGF-β1刺激引起的MRC-5细胞增殖,与正常对照组比较,10 ng/mL TGF-β1处理组的细胞增殖活性明显提高(P<0.01),表明TGF-β1能够促进MRC-5细胞增殖;而经芪归方有效组分干预,与模型组比较,随药物浓度增高,MRC-5细胞增殖活性明显降低,以中高浓度芪归方有效组分处理组抑制效果更明显,差异有统计学意义(P<0.01),表明芪归方有效组分可抑制TGF-β1刺激引起的MRC-5细胞增殖。见图2。
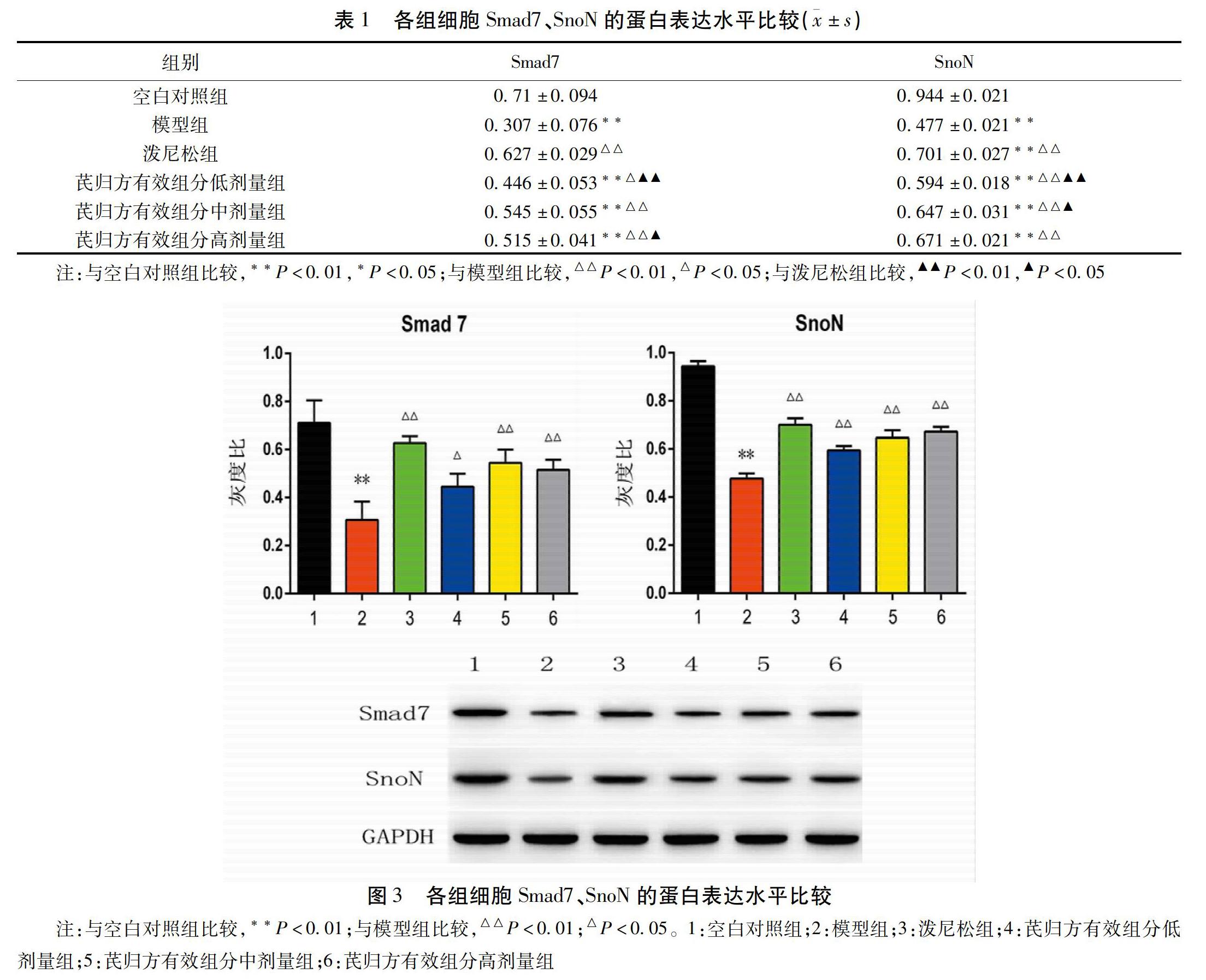
3.3 芪归方有效组分对MRC-5细胞Smad7、SnoN蛋白表达的影响 与空白对照组比较,模型组中Smad7、SnoN蛋白表达明显减少(P<0.01);与模型组比较,各给药组Smad7、SnoN蛋白表达则相对增加,并随芪归方有效组分浓度的增大而升高,其中以芪归方有效组分中剂量组改善Smad7及芪归方有效组分高剂量组提高SnoN蛋白水平更显著(P<0.01)。见表1、图3。
3.4 各组细胞Smurf2的mRNA水平比较 与空白对照组比较,模型组Smurf2表达水平显著升高(P<0.01);与模型组比较,芪归方有效组分及泼尼松组Smurf2表达水平显著下降(P<0.01)。与泼尼松1 μmol/L处理组比较,芪归方有效组分中高剂量组Smurf2表达水平显著降低(P<0.01)。见表2。
4 讨论
近年来我国人口老龄化加速,加之空气质量变差,IPF在我国发生率呈上升趋势。中医学无IPF的病名,根据其发生发展过程所表现的证候特点,可归属于“肺痹”“肺痿”等病范畴[5]。肺痿从本虚而言,肺气受损,津液耗伤;肺痹从邪实而言,痹阻不通,气血失畅。肺为娇脏,易感受外邪如风寒湿邪气,客于肺引发痰浊、瘀血停滞于内,久则产生肺痹之征,邪气胶着不解,损伤人体正气,肺叶失于濡养,日久而痿。故临证时当把握住气虚血瘀的核心病机,气虚为本,血瘀为标,从气虚血瘀论治是治疗IPF的重要方法。治疗时在活血化瘀通络同时,补虚扶正,黄芪味甘而薄,具补气之功;当归味甘而重,故专能补血;其气轻而辛,故又能行血,且近年来许多体内和体外研究表明黄芪、当归单药及其组合用药等能治疗和预防肺纤维化。而黄芪甲苷和阿魏酸为其主要有效活性成分之一,现代研究表明[6],当归和黄芪配伍后,复方中的组分绝大部分来源于各单味药的化学成分,阿魏酸和黄芪甲苷分别是中药当归和黄芪的代表性成分,是芪归方(当归补血汤)中的主要有效成份。Dong H等[7]取黃芪的有效成分黄芪甲苷和当归的活性成分阿魏酸,通过利用中效原理(Chou-Talalay联合指数法)优选了黄芪甲苷和阿魏酸配伍剂量,组成芪归方有效组分方剂。有多项研究[8]对芪归方的活性成分(黄芪甲苷和阿魏酸)的含量进行了测定,在芪归方(黄芪:当归5∶1,当归补血汤)制备和纯化之后,黄芪甲苷和阿魏酸分别为2∶3。在肺纤维化发病中TGF-β1[9]是公认的最关键最直接的多功能促纤维增生细胞因子,在纤维形成过程中起重要作用;其在受累器官中的表达持续升高,会导致细胞外基质(ECM)的反复破坏、修复进而引起肺纤维素的沉积,因此常用于构建肺纤维化细胞模型。肌成纤维细胞以表达α-SMA为特征,在TGF-β1的刺激下合成增多,造成细胞外基质的异常沉积,进一步加速肺纤维化的发展。本实验采用TGF-β1进行细胞模型的构建,实时定量PCR法检测结果显示,模型组细胞增殖水平较正常对照组明显增高,表达大量的α-SMA,分化明显,提示造模成功。经不同浓度的芪归方有效组分处理,MRC-5细胞增殖降低,以芪归方有效组分中高浓度组作用更为明显,提示芪归方有效组分可通过抑制MRC-5的增殖,减缓肺纤维化进展,可能与其抑制ECM异常蓄积有关。
Smad蛋白[10]是TGF-β信号传导通路中最关键的信号转导因子,是其目的转录基因的主要信号传导蛋白,从而建立起胞膜与胞核之间的信号转导通路,TGF-β1信号传导通路发挥效应时大部分需要下游Smad蛋白参与。Smad7[11]可与TGF-βⅠ类受体紧密结合,在TGF-β1刺激后阻止Smads蛋白(Smad2/3)发生磷酸化,是TGF-β信号传递的关键负调控因子,共同调节α-SMA的表达。SnoN是[12]TGF-β1信号通路的负性调节因子,在组织细胞存活中,SnoN表达的调节有重要作用,与Smad蛋白相互作用,在细胞核和细胞质中均可抑制TGF-β1信号通路的激活、负向调控TGF-β1信号通路,而TGF-β1通过多种方式调节SnoN的表达,利用SnoN靶向调控TGF-β1/Smad信号通路,可抑制组织纤维化的发生发展。研究发现[13],SnoN过表达的模型可抑制组织细胞纤维化,而减少SnoN的表达则有促进组织纤维化功能。本研究通过Western blot检测各组细胞Smad7、SnoN检测发现,TGF-β1处理组Smad7、SnoN蛋白表达水平下降,不同浓度芪归方有效组分处理TGF-β1诱导的MRC-5后,上调Smad7、SnoN的表达,有效地阻止下游信号转导,提示芪归方有效组分可阻断TGF-β1/Smads在纤维化的信号转导,降低细胞对TGF-β1的反应性,而起抗肺纤维化的作用。
泛素-蛋白酶体途径(Ubiquitin Proteasome Pathway,UPP)是真核细胞中蛋白质选择性降解的重要途径,在TGF-β1/Smad信号传导通路中,E3泛素连接酶通过选择性介导Smads蛋白、TGF-β受体等的泛素化降解,在TGF-β1/Smad信号活性的调节中起枢纽作用。Smurf2是泛素连接酶E3的一种,在多种纤维化疾病中表达异常,可选择性通过泛素化降解Smad7、SnoN、Ski(Sloan-Kettering Institute proto-oncogene)等影响了TGF-β1信号传导通路,其功能失调会导致TGF-β1/Smad信号传导异常,参与了纤维化疾病的发生、发展[14]。研究发现,Smurf2与ECM积聚形成IPF密切相关。在TGF-β诱导人肺成纤维细胞活化实验中,Smurf2[14]促进了TGF-β1/Smad信号通路重要分子TGF-β1的上调表达;而通过RNA干扰技术沉默Smurf2表达,则可见MRC-5细胞α-SMA和CollagenI(I型胶原蛋白)表达下降,Smad7蛋白则可见表达升高,TGF-β1的表达被抑制,推测Smurf2可能通过泛素化降解Smad7和SonN蛋白分子,调控TGF-β1/Smad信号通路;而用泛素蛋白酶体抑制剂MG132可阻止Smad7和SnoN泛素化降解,抑制TGF-β1诱导人肺成纤维细胞活化。本研究显示,与正常空白组比较,模型组Smurf2蛋白增加,促进Smurf2介导的Smad7、SnoN蛋白发生泛素化降解过程,使Smad7、SnoN蛋白水平降低,不能发挥其负调控IPF的作用,加速IPF进程。既往研究提示Smurf2通过调节Smad信号通路上的负调节因子SnoN和Smad7蛋白的降解,这和以往的研究相符[15]。经芪归方有效组分干预后,与模型组比较,Smurf2蛋白mRNA水平有下调,阻止Smad7和SnoN进一步泛素化降解,SnoN、Smad7蛋白水平增加,从而上调恢复SnoN、Smad7蛋白水平,延缓IPF。
综上所述,本研究提示TGF-β1诱导人肺成纤维细胞活化后出现增殖能力下降,并伴SnoN、Smad7蛋白减少,Smurf2升高,芪归方有效组分能有效抑制体外培养的人胚肺成纤维细胞MRC-5生长,通过阻止Smurf2介导的SnoN、Smad7泛素化,恢复其表达,调控TGF-β1/Smad信号途径,从而发挥对肺纤维化治疗效果,这从新的视角阐明了芪归方有效组分抑制肺纤维化发生、发展的机制,为进一步深入研究芪归方抗肺纤维化的作用机制提供了一定基础。
参考文献
[1]中华医学会呼吸病学分会间质性肺疾病学组.特发性肺纤维化诊断和治疗中国专家共识[J].中华结核和呼吸杂志,2016,39(6):427-432.
[2]Buendía-Roldán I,et al.Idiopathic pulmonary fibrosis:Clinical behavior and aging associated comorbidities[J].Respir Med,2017,129:46.
[3]Li L C,Kan L D.Traditional Chinese medicine for pulmonary fibrosis therapy:progress and future prospects[J].J Ethnopharmacol,2017,198:45-63.
[4]彭艷芳,张莹雯,赵映前.芪归方联合泼尼松治疗特发性肺纤维化的临床研究[J].世界中医药,2018,13(8):1908-1912,1917.
[5]徐田田,孔爱华,宁康.特发性肺纤维化的中医治疗新进展[J].临床医学研究与实践,2018,3(16):197-198.
[6]国家药典委员会.中华人民共和国药典.[M]:一部.北京:化学工业出版社,2005,142-143;249-250.
[7]Dong H,Guo H,Liang Y,et al.Astragaloside IV synergizes with ferulic acid to suppress hepatic stellate cells activation in vitro[J].Free Radic Res,2017,51(2):167-178.
[8]寿迪文,马伟斌.当归补血汤的不同配比对黄芪甲苷、阿魏酸及芒柄花素含量的影响[J].新中医,2016,48(6):274-276.
[9]Na M,Hong X,Fuyu J,et al.Proteomic profile of TGF-β1 treated lung fibroblasts identifies novel markers of activated fibroblasts in the silia exposed rat lung[J].Exp Cell Res,2019,375(2):1-9.
[10] Budi EH,Xu J,Derynck R.Regulation of TGF-β Receptors[J].Methods Mol Biol,2016,1344:1-33.
[11]Xu F,Liu C,Zhou D,et al.TGF/SMAD pathways and its regulation in hepatic fibrosis[J].J Histochem Cytochem,2016,64(3):157-167.
[12]Zeglinski MR,Hnatowich M,Jassal DS,et al.SnoN as a novel negative regulator of TGF-β/Smad signaling:a target for tailoring organ fibrosis[J].Am J Physiol Heart Circ Physiol,2015,308(2):H75-82.
[13]Liu L,Shi M,Wang Y,et al.SnoN upregulation ameliorates renal fibrosis in diabetic nephropathy[J].PLoS One,2017,12(3):e0174471.
[14]曹述任,楊俊侠,张敏.MG132抑制TGF-β1诱导的人肺成纤维细胞活化[J].基础医学与临床,2016,36(2):156-160.
[15]Wang J,Li HY,Wang HS,et al.MicroRNA-485 Modulates the TGF-β/Smads Signaling Pathway in Chronic Asthmatic Mice by Targeting Smurf2[J].Cell Physiol Biochem,2018,51(2):692-710.
(2020-04-25收稿 责任编辑:王杨)
