百里香精油微胶囊对摩根氏菌和变形杆菌产组胺机制的影响
2020-10-29于红红吴明颖王庆玲卢士玲
于红红,吴明颖,王庆玲,董 娟,卢士玲
(石河子大学食品学院,新疆 石河子 832000)
组胺是毒性最强的生物胺,其广泛存在于多种发酵食品中,如豆制品、红酒、奶酪、香肠等,适量的组胺对人体的某些生理功能具有调节作用,而过量的组胺摄入会引起食物过敏和食物中毒[1-2]。在发酵肉制品中,肠细菌是很主要的产组胺菌种,如阴沟肠杆菌、摩根氏菌、产气肠杆菌、大肠埃希氏菌和变形杆菌[3]。研究发现组胺是由组氨酸经组氨酸脱羧酶(histidine decarboxylase,HDC)催化脱羧生成,并且这是组胺合成的唯一途径[4-5]。HDC是氨基酸脱羧酶的一种,其专一性催化L-组氨酸脱羧,从而生成组胺。大量的研究表明,HDC基因主要由hdcA、hdcP、hdcRS、hdcB组成。hdcA基因编码HDC,hdcP基因编码转运组氨酸/组胺的蛋白,hdcRS基因编码氨酰-tRNA合成酶,hdcB基因的功能暂未明确[6-7]。
百里香精油的主要成分为百里香酚和香芹酚,研究表明,百里香精油有较强的抗菌抗氧化作用[8]。但是百里香精油具有刺激性气味,且在贮存过程中极易挥发或发生氧化劣变,这极大限制了百里香精油在食品工业中的应用,微胶囊化技术是解决这一问题的措施之一。百里香精油经过微胶囊化后,壁材可较好地保护芯材中的香气成分,解决其易挥发和难保存的问题,可使其长期保持稳定的抑菌活性[9]。Hong Jiachi[9]和Comunian[10]等研究发现植物精油包埋复合物可以改善食物的品质,增强植物提取物的稳定性,并使其保持稳定的抑菌活性。孟祥俭等[11]制备的缓释微胶囊对大肠杆菌的生长具有一定的抑制作用,随着微胶囊浓度的增大,对大肠杆菌的抑制率呈现增长的趋势。目前,关于百里香精油微胶囊对肠细菌中组胺产生影响以及产组胺途径中相关基因表达的研究鲜有报道。
本实验旨在研究不同百里香精油微胶囊精油质量浓度对高产组胺的摩根氏菌和变形杆菌的作用效果和产组胺量,并探究百里香精油微胶囊对产组胺菌HDC基因簇相关基因表达水平的影响,为熏马肠中组胺含量的控制提供理论参考。
1 材料与方法
1.1 菌株、材料与试剂
摩根氏菌ND(Morganella morganii ND),GenBank登录号为MN483274;变形杆菌R3(Proteus bacillus R3),GenBank登录号为MN483275,均为石河子大学畜产实验室从熏马肠中分离筛选。
百里香精油(百里香酚纯度≥36%,香芹酚纯度≥25%)、β-环糊精(β-cyclodextrin,β-CD)(纯度≥99%) 天津福晨化学试剂厂;甲醇、乙腈(均为色谱纯) 赛默飞世尔科技(中国)有限公司;TRIzol试剂 美国Invitrogen公司;5×All-In-One RT MasterMix cDNA合成试剂盒、EvaGreen 2×qPCR MasterMix-low-ROX加拿大ABM公司;丹磺酰氯、组胺标准品、磷酸吡哆醛、L-组氨酸 美国Sigma公司。
1.2 仪器与设备
5417R型高速冷冻离心机 德国Eppendorf仪器公司;Universal Hood 11型凝胶成像系统 美国Bio-Rad公司;U B-7 型p H 计 德国赛多利斯公司;E O N BagMixer VW多功能酶标仪 美国伯腾仪器有限公司;ND2000C微量核酸测定仪 香港基因有限公司;LC-2010AHT型高效液相色谱仪 日本岛津公司;MX3000P型实时荧光定量聚合酶链式反应(quantitative polymerase chain reaction,qPCR)仪 美国安捷伦科技公司。
1.3 方法
1.3.1 百里香精油微胶囊的制备及表征分析
1.3.1.1 百里香精油微胶囊的制备
采用饱和水溶液法制备百里香精油微胶囊[12-13]。芯材为百里香精油,壁材为β-CD,准确称取β-CD粉末12 g,溶于40 ℃的100 mL去离子水中,搅拌溶解形成β-CD过饱和溶液;量取4 g百里香精油,按无水乙醇与精油体积比1∶1溶解百里香精油;将溶解后的百里香精油匀速逐滴加到β-CD过饱和溶液中,30 ℃下搅拌包埋2 h后取出,待溶液冷却至室温后,将其放于4 ℃冰箱中24 h,真空抽滤,滤渣用去离子水洗涤后真空抽滤,以便彻底洗去黏附在β-CD外部的百里香精油。后将滤渣转移至玻璃培养皿中,铺平于50 ℃真空干燥箱中干燥至恒质量,得到淡黄色百里香精油微胶囊。
1.3.1.2 百里香精油微胶囊包埋率的测定
参考黄晶等[12]的方法测定总油和表面油体积,按下式计算包埋率。

1.3.1.3 百里香精油微胶囊包埋效果观察
取百里香精油微胶囊与β-CD各20 mg,用蒸馏水分散制备成悬浊液,装片,置于显微镜下观察(400 倍)。
1.3.2 百里香精油微胶囊MBC和MIC的测定
将保存在-18 ℃甘油管中的由畜产实验室从熏马肠中分离的肠杆菌菌株接种于BHI肉汤培养基(pH 5.5)中,活化3 次。
本实验采用液体培养基倍比稀释法测定最低抑菌浓度(minimal inhibitory concentration,MIC)和最低杀菌浓度(minimal bactericidal concentration,MBC)[14]。准备14 支干净的灭菌试管,用移液枪向1号试管中加入含有500 mg百里香精油微胶囊液体培养基10 mL,其他每管中加5 mL的液体培养基,漩涡振荡混匀后,吸取1号试管中5 mL移至2号试管中,依次类推,最后从12号试管中吸去5 mL,然后每管中分别加入100 µL浓度为106CFU/mL的菌液,第13号管为不含百里香精油微胶囊只含等量菌液的对照管,第14号管中不添加百里香精油微胶囊并且不含菌液,作为阴性对照管。37 ℃培养24 h后,观察结果,确定其MIC。在显微镜下涂片观察,视野中细菌或真菌个数小于5 个时作为此种菌的MIC。从无菌生长的试管中各吸取100 µL,并将其涂布于平板培养基上,然后在37 ℃恒温培养箱中培养24 h。用活菌计数法检查琼脂平板上的菌落,平板上无菌落数的最小百里香精油微胶囊质量浓度即为MBC。
1.3.3 百里香精油微胶囊对供试菌生长作用的测定
准备一批10 mL的培养基(接种产组胺菌),分为5 组,第1组为空白对照组,不添加组氨酸和百里香精油微胶囊(A组);第2组仅添加0.5%(质量分数,下同)组氨酸(B组);第3组添加0.5%组氨酸和MIC百里香精油微胶囊(C组);第4组添加0.5%组氨酸和1/2 MIC百里香精油微胶囊(D组);第5组添加0.5%组氨酸和与MIC百里香精油微胶囊中相同量的精油(E组)。每组均含不添加供试菌株的阴性对照。接入供试菌株于37 ℃恒温培养,每隔4 h取样,分别测定菌悬液OD600nm、pH值,每组样品需要各做3 个平行。
1.3.4 HDC相关基因表达量的测定
1.3.4.1 RNA的提取
分别取1.3.3节中培养至稳定期的菌液2.0 mL于无酶离心管中,10 000 r/min离心3 min后,采用TRIzol法提取细菌总RNA[15]。RNA提取完成后使用微量核酸测定仪测定其浓度以及OD260nm/OD280nm,再用质量分数1%琼脂糖凝胶电泳检测RNA的完整性。确保RNA的浓度、纯度以及完整性符合要求后,进行反转录。
1.3.4.2 cDNA的合成
按照5×All-In-One RT MasterMix cDNA合成试剂盒的要求将提取到的RNA置于冰上解冻,其他试剂于室温下解冻。反应体系为(20 μL):RNA模板2 μg、AccuRT Reaction Mix(4×)2 μL、无酶水加至终体积8 μL,在室温下孵育5 min,再加入AccuRT Reaction Stopper(5×)2 μL、5×All-In-One RT MasterMix 4 μL、无酶水6 μL。然后25 ℃孵育10 min,42 ℃孵育15 min,85 ℃孵育10 min终止反应,于冰上冷却。
1.3.4.3 基因表达定量分析
向无酶八连管中加入10.0 μL的EvaGreen 2×qPCR MasterMix、上下游引物(表1)各0.6 μL、2 μL的cDNA模板,加入无酶水补足至20 μL,进行反转录qPCR(reverse transcription qPCR,RT-qPCR)。扩增程序为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火/延伸60 s,40 个循环。每组样品(包括阴性空白对照)做3 个平行。采用2-ΔΔCt计算方法计算HDC基因簇基因的相对表达量[16]。

表1 RT-qPCR所用引物Table 1 Primers used for RT-qPCR
1.3.5 高效液相色谱测定菌悬液中组胺含量变化
1.3.5.1 组胺标准溶液的配制
准确称取组胺标准品5 mg,移入0.4 mol/L的高氯酸将其定容至5 mL,分别吸取25、50、125、250、500、1 000、1 500 μL于5 mL棕色容量瓶中,加入0.4 mol/L的高氯酸使终体积为5 mL,作为组胺标准溶液备用。
1.3.5.2 样品的制备
每隔4 h分别取1.3.4节中供试菌菌悬液1.8 mL,12 000 r/min离心10 min,然后吸取1 mL上清液,移入相同体积的0.4 mol/L的高氯酸,并将其充分混匀,制成菌液样品处理液。
1.3.5.3 衍生化
取1.3.5.1节中组胺标准溶液、菌液样品处理液各1 mL于5 mL容量瓶中,按照Lu Shiling等[19]的方法进行衍生化。最后用0.22 μm滤膜过滤至1.5 mL的样品瓶中,用于上机检测。
1.3.5.4 色谱条件
色谱柱:C18(4.6 mm×250 mm,5 μm),其中流动相B为乙腈,流动相A为超纯水,色谱柱流速为0.8 mL/min,有机滤膜孔径为0.22 μm,紫外检测波长为254 nm,注入样品的点样体积为20 μL,色谱柱的柱温为30 ℃[20];梯度洗脱程序为:0~5 min,65%流动相B;5~24 min,100%流动相B;24~25 min,65%流动相B;25~30 min,65%流动相B。
1.4 数据统计分析
所有实验数据使用Excel 2016软件分析,采用Origin 2017软件绘图。
2 结果与分析
2.1 百里香精油微胶囊包埋效果
根据饱和水溶液法制备的百里香精油微胶囊外观为淡黄色粉末,略有百里香精油气味,其包埋率为78.92%。百里香精油微胶囊与β-CD的显微成像结果如图1所示,百里香精油微胶囊为含有淡黄色透明物的形状不规则的块状或粉末状物质,而β-CD则为半透明规则的板状晶体,表明微胶囊形成,该结果也与马君义等[13]的研究结果相一致。
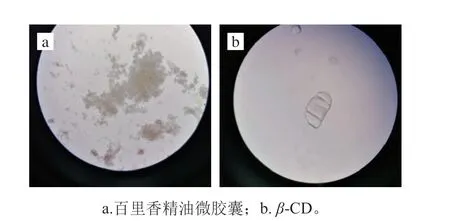
图1 百里香精油微胶囊与β-CD显微成像图(400×)Fig. 1 Microscopic images of thyme essential oil microcapsules and β-CD (400 ×)
2.2 百里香精油微胶囊的MBC和MIC

表2 百里香精油微胶囊对待测菌种的MIC和MBCTable 2 MIC and minimal bactericidal concentration of thyme essential oil microcapsules against test bacteria
百里香精油微胶囊对摩根氏菌ND和变形杆菌R3的MIC和MBC如表2所示,不同质量浓度的百里香精油微胶囊对供试菌株的生长抑制作用不同。百里香精油微胶囊对摩根氏菌ND和变形杆菌R3都具有较强的抑制效果,摩根氏菌ND的MIC和MBC分别为1.56 mg/mL和3.12 mg/mL,变形杆菌R3的MIC和MBC分别为0.78 mg/mL和1.56 mg/mL,这表明变形杆菌R3对百里香精油微胶囊的敏感度要高于摩根氏菌ND。许多研究表明,百里香精油对大肠杆菌、金黄色葡萄球菌、真养产碱杆菌、枯草芽孢杆菌等有较强抗菌作用[21-23]。Inouye等[24]研究了10 种以上精油对3 种病原菌的抑制效果,结果发现百里香精油的抑制效果最好,所用剂量最少。Pinto等[25]研究从葡萄牙种植的百里香植株中提取的百里香精油,发现其对白色念珠菌的抑制剂量范围在0.32~0.64 μL/mL之间,而对黑曲霉的抑制剂量范围在0.16~0.32 μL/mL,这与本研究结果不一致,一方面是因为百里香精油有不同的种类;另一方面是因为本研究用β-CD对精油进行了包埋[26]。供试菌经百里香精油微胶囊处理后,其细胞膜受到损伤,致使膜内物质泄漏,从而达到抑菌效果,这与申莉莉[27]的研究结果相一致。
2.3 百里香精油微胶囊对摩根氏菌和变形杆菌生长的影响
如图2所示,在0~48 h内两株供试菌OD600nm由高到低为A组/B组>E组>D组>C组,这说明百里香精油对摩根氏菌ND和变形杆菌R3的生长具有一定抑制作用,将精油微胶囊化后,其抑制作用更加明显,且微胶囊浓度越大,其抑制作用越强。A、B、C、D、E 5 组都经历延滞期、对数生长期和稳定期等3 个阶段,而添加了百里香精油微胶囊和精油的菌液组(C、D、E组)与空白组和组氨酸组(A、B组)相比,其对数生长期较长,稳定期的到来较迟,菌株的生长受到明显抑制。有研究者认为植物精油对病原菌的抗菌机理可能有以下3 种,改变病原菌的一些形态结构如细胞膜、细胞壁、细胞质等;改变菌丝体的形态结构诱发菌丝体溶解;降低或抑制分生孢子的产生和萌发[28-30],有学者认为精油的微胶囊化有助于精油缓释,增强精油在介质中的扩散性,从而破坏供试菌的细胞膜,使得内溶物外泄,菌体逐渐衰老死亡[27]。从图2可以看出,摩根氏菌ND 1/2 MIC微胶囊+组氨酸组稳定期时最终OD600nm较空白对照A组降低了0.50,而变形杆菌R3组则降低了0.61,说明百里香精油微胶囊对变形杆菌R3更为敏感。
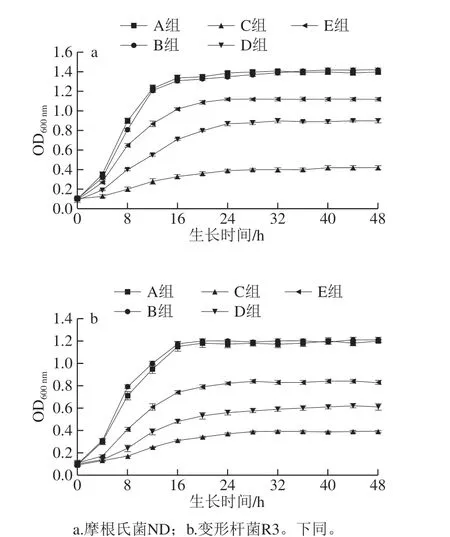
图2 百里香精油微胶囊对摩根氏菌ND和变形杆菌R3生长的影响Fig. 2 Effect of thyme essential oil microcapsules on the growth of M. morganii ND and P. bacillus R3 during 48 h culture
0~48 h内两株供试菌pH值的变化如图3所示,两株菌的空白对照A组在整个过程中pH值都是下降的,在4~12 h内下降较快,20 h后分别稳定在4.19和4.08左右,说明两株供试菌在对数期开始大量快速的繁殖,发酵产物也在慢慢积累。而其他添加组氨酸的4 组(B、C、D、E组)培养液pH值均呈现对数期前逐渐下降,对数期后逐步上升的趋势,这是由于组氨酸是合成组胺的前体物质,随着供试菌株的繁殖,组胺的含量也在不断积累,因此呈碱性的组胺可以中和供试菌产生的酸性物质,这说明两株供试菌在HDC途径下有较强的产组胺能力。Freeman等[32]的研究结果也表明在氨基酸存在的情况下,产生物胺的细菌能够引起培养基pH值增加。4 组pH值的这种变化趋势与张雅晴[20]、赵利利[33]等的研究结果相似,即在含组氨酸底物的培养液中,由于生物胺的产生,导致pH值在对数期后期迅速上升并趋于稳定。在有组氨酸存在的情况下,两株供试菌组氨酸组的pH值大于添加有百里香精油微胶囊和精油组的,这是由于微胶囊组和精油组含有的百里香精油抑制了肠杆菌的生长,降低了供试菌在HDC途径下hdcA和hdcP基因的表达量,使得组胺的积累速率较慢,因此培养液pH值的上升也较微弱。
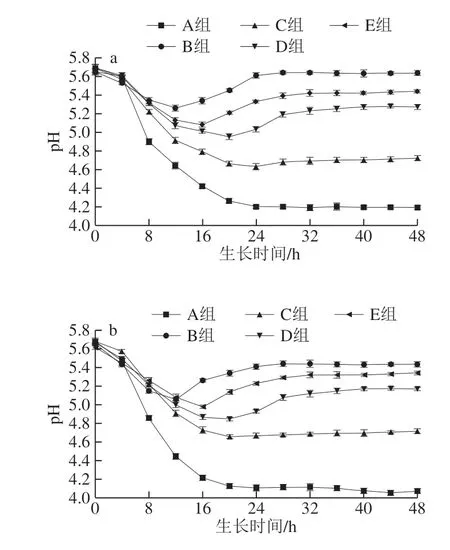
图3 百里香精油微胶囊对摩根氏菌ND和变形杆菌R3生长过程中pH值变化Fig. 3 Effect of thyme essential oil microcapsules on changes in pH during 48 h culture of M. morganii ND and P. bacillus R3
2.4 百里香精油微胶囊对供试菌株基因表达分析结果
HDC体系包括两种类型,来自真核生物和革兰氏阴性细菌的一类需要以磷酸吡哆醛作为辅助因子,而另一类来自革兰氏阳性细菌,以使用共价结合的丙酮酰基部分作为辅助基团[34]。本研究所用的两株菌都属于革兰氏阴性菌,因此其HDC为磷酸吡哆醛依赖型,Satomi等[17]从摩根氏菌中发现的HDC是以磷酸吡哆醛为辅酶而非丙酮酰,虽然在磷酸吡哆醛和丙酮酰作用下,组胺的合成机制不同,但是它们催化组氨酸生成组胺的效率一样高。HDC簇以hdcA基因开始,随后是hdcP、hdcRS,并以hdcB基因结束[35]。由图4可知,凡是添加了组氨酸(B、C、D、E组)的两株菌,其hdcA和hdcP两个基因均有较高水平的表达,摩根氏菌ND的B组这两种基因的表达水平分别是对照A组的512 倍和458 倍,变形杆菌R3是其对照A组的221.32 倍和93.05 倍。这是因为在呈酸性的环境中,供试菌为了应对环境会通过脱羧反应消耗细胞内的质子,诱导hdcA、hdcP基因的表达生成组胺从而产生对酸胁迫的抵抗能力[7]。有研究发现在发光杆菌中HDC是磷酸吡哆醛依赖型的,其hdcA基因编码377 个氨基酸的多肽,而hdcP基因负责将组氨酸带入细胞质空间并从细胞中排出组胺,并且从外界摄取游离组胺酸的同时会将生成的组胺分泌到胞外,这是一个偶联的过程,Northern印迹分析和RT-qPCR结果显示在低pH值和组氨酸过量的条件下hdcA和hdcP的基因表达量很高[7,17,35]。添加有组氨酸(B、C、D、E组)的两株菌hdcRS基因的表达普遍低于A组,这与薛林林等[37]研究发现在粪肠球菌中转运氨酰-tRNA合成酶基因的结果相一致,即氨酰-tRNA合成酶基因表达量与氨基酸浓度呈正相关,这种基因作为生物胺合成机制中的负调节系统,用来阻碍氨基酸脱羧生成生物胺,从而确保有足够的氨基酸来维持供试菌的生长。而hdcB作为一种功能未知的基因,在两株菌中的表达量也各不相同,有研究表明hdcB位于细胞质膜中[6],还有一些学者将这种蛋白质与操纵子的调节或组氨酸和/或组胺的运输联系起来,但其确切的功能仍然未知[35]。de Las等[36]的研究表明hdcA基因和hdcP的同源物以相反的顺序排列,而hdcB和hdcRS不存在同源物,而且在有的组胺产生菌中,并未发现hdcRS和hdcB这两个基因片段,说明这两个基因在组氨酸的代谢机制中不是必需的。
添加百里香精油微胶囊可以明显降低两株供试菌hdcA和hdcP两个基因的表达,其中摩根氏菌ND组氨酸组hdcA和hdcP两个基因表达量分别为组氨酸+MIC微胶囊组的245.57、149.09 倍,分别为组氨酸+精油组的2.79、1.50 倍;而变形杆菌R3组氨酸组hdcA和hdcP两个基因表达量则分别为组氨酸+MIC微胶囊组的42.52、36.50 倍,分别为组氨酸+精油组的2.58、1.43 倍。这表明百里香精油微胶囊对摩根氏菌ND产组胺过程中基因表达的影响要大于变形杆菌R3,这与摩根氏菌ND组胺积累量高于变形杆菌R3的结果相一致,而且有研究表明在组胺形成机制中主要参与的基因是hdcA和hdcP,这进一步表明百里香精油微胶囊可以通过影响HDC和转运组胺/组氨酸蛋白活性来减少相关基因表达量以及组胺的积累[7]。此外,百里香精油微胶囊+组氨酸组的hdcA和hdcP基因表达量要低于精油+组氨酸组,且百里香精油微胶囊精油质量浓度越大,其基因表达量越低,这说明百里香精油微胶囊可以有效地抑制hdcA和hdcP基因的表达,从而减少组胺的积累。
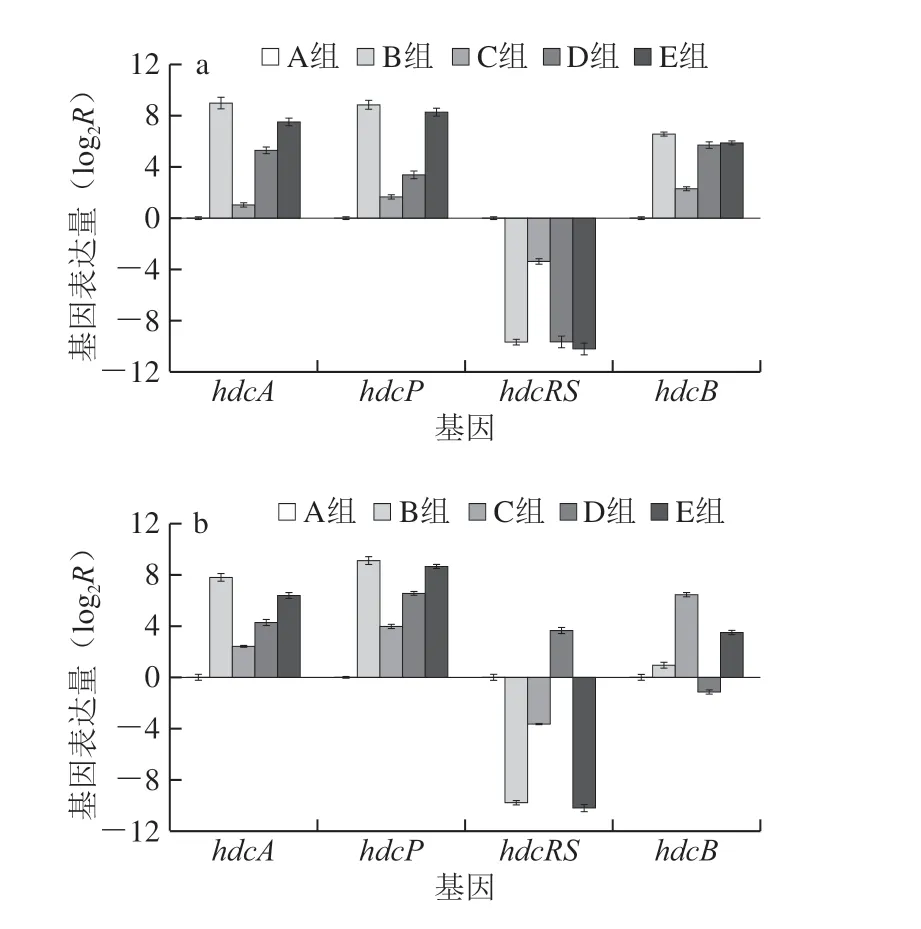
图4 百里香精油微胶囊对摩根氏菌ND和变形杆菌R3 HDC相关基因表达量的影响Fig. 4 Effect of thyme essential oil microcapsules on the relative expression level of HDC-related genes in M. morganii ND and P. bacillus R3
2.5 百里香精油微胶囊对供试菌株产组胺的影响
0~48 h内两株供试菌组胺积累情况如图5所示,在有组氨酸存在的情况下,摩根氏菌ND和变形杆菌R3在8~20 h之间组胺质量浓度明显增加,而在稳定期期间,组胺积累速率明显减慢,含量逐渐趋于稳定,这是因为在对数生长期,菌体增殖速率快,此时细胞的代谢能力最强,因此产组胺量明显增加,而在稳定期时,供试菌生长速率下降,前体物质组氨酸的含量降低,HDC活性降低,hdcA和hdcP基因的表达量降低,从而使组胺的积累速率减缓。在未添加组氨酸的空白对照A组中可以看到,刚开始未检出组胺,4 h之后有少量的组胺产生,48 h两株肠杆菌组胺积累量分别为36.68 μg/mL和26.70 μg/mL。这是因为菌株可以利用外界环境中的物质产生前体物质氨基酸,然后合成生物胺,在延滞期时,供试菌数量较少,因此氨基酸量较少,组胺浓度偏低[18]。在只添加组氨酸的B组中,摩根氏菌ND组胺质量浓度最终稳定在212.40 μg/mL,而变形杆菌R3的组胺质量浓度最终稳定在114.60 μg/mL,这是由于接种供试菌的不同,在前体物质组氨酸相同的情况下,与其他菌相比,摩根氏菌ND产组胺量更多,这与Kim等[38]的研究结果相一致。
从添加有百里香精油微胶囊的组中可以看出,摩根氏菌ND和变形杆菌R3的产组胺量随着微胶囊的添加均明显降低,MIC微胶囊+组氨酸组和精油+组氨酸组(C、E组)与只添加组氨酸组(B组)相比,其组胺积累量分别减少了61.08%、36.23%和55.89%、23.98%,这与赵利利[33]和薛林林[37]等的研究结果相似,另外百里香精油微胶囊对供试菌组胺积累量的影响要大于百里香精油,百里香精油微胶囊精油质量浓度越大,其组胺积累量越低,这表明微胶囊化后的百里香精油可以更加有效地抑制供试菌的生长,降低HDC簇中hdcA和hdcP基因的表达量,从而使组胺质量浓度降低。
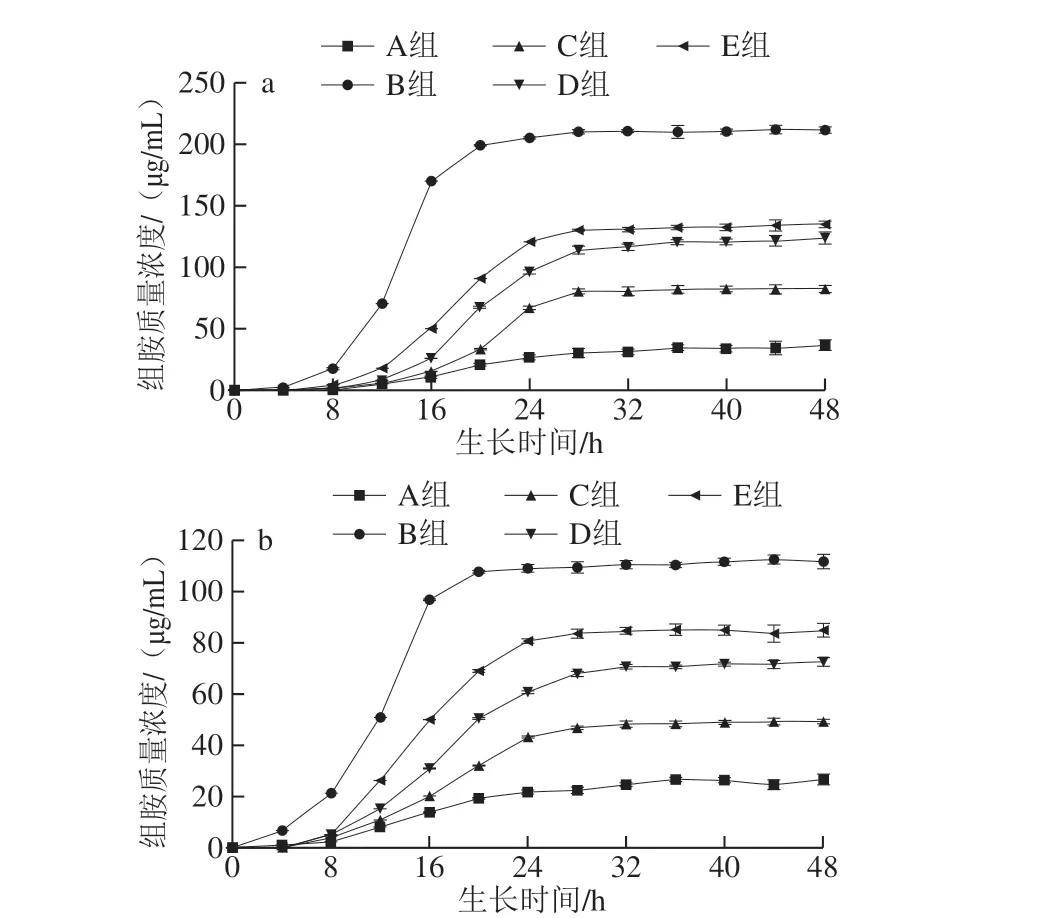
图5 百里香精油微胶囊对摩根氏菌ND和变形杆菌R3培养48 h组胺积累的影响Fig. 5 Effect of thyme essential oil microcapsules on accumulation of histamine in M. morganii ND and P. bacillus R3 during 48 h culture
3 结 论
百里香精油经微胶囊化后对摩根氏菌ND和变形杆菌R3的抑制作用更加明显,且百里香精油微胶囊精油质量浓度越高,抑制作用越明显,其对摩根氏菌ND和变形杆菌R3的MIC分别为1.56 mg/mL和0.78 mg/mL。百里香精油微胶囊对HDC簇中hdcB和hdcRS基因表达量影响不明显,但是可以抑制hdcA和hdcP基因的表达,当培养液中含有百里香精油微胶囊时,一方面菌株的生长受到明显抑制;另一方面hdcA和hdcP基因表达量明显减少,整个组胺合成途径受到抑制,从而使得产组胺量降低。当百里香精油微胶囊的添加量为MIC时,摩根氏菌ND中MIC微胶囊+组氨酸组组胺的生成量较组氨酸组减少了61.08%,变形杆菌R3中MIC微胶囊+组氨酸组组胺的生成量相对于组氨酸组减少了55.89%。因此添加百里香精油微胶囊能够通过抑制供试菌的生长和降低组胺合成途径中hdcA和hdcP的基因表达量来减少组胺的积累。
